
- •Міністерство освіти і науки україни
- •І. Обробка та оформлення результатів лабораторних робіт
- •Іі. Правила роботи в лабораторії з фізичної хімії і техніка безпеки
- •Ліквідація нещасних випадків і надання першої допомоги
- •Ііі. Агрегатний стан речовин
- •1. Визначення маси моля речовини вимірюванням її об’єму в газоподібному стані
- •2. Визначення в’язкості системи етиловий спирт – вода
- •I. Хімічна термодинаміка
- •1. Визначення теплоти згоріння речовин за допомогою калориметра юнкерса
- •Експериментальна частина
- •2. Визначення теплоти розчинення і теплоти гідратації солі
- •V. Поверхневі явища (поверхнева енергія, поверхневий натяг та адсорбція на межі розділу фаз)
- •1. Визначення поверхневого натягу розчинів методом відліку крапель (сталагмометричним методом)
- •Поверхневий натяг води в залежності від температури
- •Густина води в залежності від температури
- •Густина розчинів NaCl при 293 к
- •2. Визначення площі та довжини молекули поверхнево-активної речовини
- •3. Адсорбція оцтової кислоти на активованому вугіллі
- •Методика експерименту
- •4. Дослідження адсорбції забарвлених речовин із розчинів
- •5. Дослідження адсорбції ізоамілового спирту із розчину за допомогою активованого вугілля
- •6. Визначення повної обмінної ємності (оє) катіоніту
- •7. Визначення вмісту лікарської речовини (глюконату кальцію) в розчині методом йонообмінної адсорбції
- •8. Обезсолювання води за допомогою йонітів
- •VI. Розчини неелектролітів
- •1. Визначення критичної температури взаємного розчинення рідин
- •2. Визначення молекулярної маси розчиненої речовини кріоскопічним методом
- •VII. Розчини електролітів
- •1. Визначення електропровідності електролітів і обчислення ступеня дисоціації
- •Експериментальна частина
- •Робота на змінному струмові
- •2. Bизначення розчинності малорозчинних сполук
- •3. Визначення іонного добутку води
- •4.Визначення концентрації кислоти методом кондуктометричного титрування
- •5. Визначення вмісту лікарської речовини в розчині
- •Хід роботи
- •Обробка результатів експерименту
- •VIII. Гальванічні елементи та електродні потенціали
- •1. Вимірювання електрорушійних сил гальванічних елементів
- •2. Визначення водневого показникa потенціометричним методом
- •3. Потенціометричне визначення рН, розрахунок константи дисоціації слабкої кислоти
- •Іх. Хімічна кінетика і каталіз
- •1. Визначення швидкості розкладу тіосульфатної кислоти
- •Дослід 1. Залежність швидкості розкладу тіосульфатної кислоти від її молярної концентрації
- •Дослід 2. Залежність швидкості розкладу тіосульфатної кислоти від температури
- •Виконання роботи
- •Склад реакційної суміші
- •Результати титрування
- •3. Дослідження гідролізу крохмалю в присутності соляної кислоти
- •4. Дослідження гідролізу крохмалю в присутності ферментів і соляної кислоти при температурі 310 к
- •5. Визначення швидкості розкладу пероксиду водню газометричним методом
- •6. Фотохімічний розклад н2о2
- •Послідовність виконання роботи
- •Х. Фізикохім ія дисперсних систем.
- •1. Методи одержання колоїдних розчинів
- •2. Коагуляція колоїдних розчинів електролітами
- •3. Визначення величини електрокінетичного потенціалу методом електрофорезу
- •4. Вивчення ізоелектричної точки білків
- •5. Набухання гелів
- •Хід виконання роботи
- •Хі. Біогенні елементи
- •1. Аналітичні реакції на йони s-елементів
- •Визначення хлор-йонів Cl– в питних водах за методом Фольгарда
- •2. Аналітичні реакції на р-елементи та їх сполуки
- •Реакція на бор (ііі) по кольору полум’я
- •Реакція на йон з розведеними кислотами
- •Реакція на йон з реактивом Несслера
- •Реакція на йон із розчином хлориду барію
- •(Реакція л.А. Чугаєва)
- •Контрольні питання до колоквіумів іii. Агрегатний стан речовин
- •Іv. Хімічна термодинаміка та біоенергетика
- •V. Поверхневі явища (поверхнева енергія, поверхневий натяг та адсорбція на межі розділу фаз)
- •Vі. Розчини неелектролітів
- •Vіі. Розчини електролітів
- •Vііі. Гальванічні елементи та електродні потенціали
- •IX. Хімічна кінетика і каталіз
- •Х. Фізикохімія дисперсних систем
- •Хі. Біогенні елементи
- •Додатки
- •Деякі фізичні константи
- •Густина деяких речовин
- •Густина деяких газів (н.У.)
- •Співвідношення між позасистемними одиницями
- •Пояснювальна записка
- •Зміст дисципліни
- •Тема 1. Предмет фізичної хімії та її значення. Розділи фізичної хімії. Методи дослідження. Розвиток фізичної хімії в Україні.
- •Тема 7.
- •Тема 8.
- •Тема 9.
- •Тема 10.
- •Тема 11.
- •Тема 12.
- •Тема 13.
- •Тема 14.
- •Орієнтовний перелік питань до підсумкового контролю знань з дисципліни.
- •Cписок літератури
- •І. Обробка та оформлення результатів
- •Гомонай Василь Іванович
6. Фотохімічний розклад н2о2
Для роботи необхідно:установка (рис.1), перексид водню.
Фотохімічний розклад Н2О2 являється типовим ланцюговим процесом, механізм якого можна представити таким чином:
![]() - реакція зародження
ланцюга;
- реакція зародження
ланцюга;
![]() - цикл регенерації;
- цикл регенерації;
![]()
![]() - реакція розгалуження;
- реакція розгалуження;
![]() - реакція обриву
ланцюга.
- реакція обриву
ланцюга.
Виділення кисню відбувається в результаті реакції
![]()
Ця
реакція відноситься до ланцюгових
реакцій з „виродженими розгалуженнями”.
В даному процесі розгалуження здійснюється
фотохімічно за рахунок підводу енергії
ззовні. Відносно стійким проміжним
продуктом являється вільний радикал
ОН-.
Кінетика цієї реакції виражається
рівнянням:
![]() ,
де
,
де
φ - константа наростання, що характеризує швидкість розгалуження;
τ – час.
Логарифмування
його дає
![]() .
Це рівняння прямої в системі координат
.
Це рівняння прямої в системі координат![]() .
.
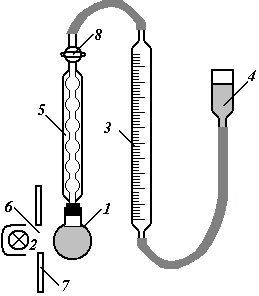
Перед початком роботи необхідно по термодинамічним функціям розрахувати теплові ефекти елементарних стадій реакції та оцінити принципову можливість їх здійснення. Робота проводиться на установці, схема якої приведена на рис.1.
Послідовність виконання роботи
Рис.
1. Схема
установки для вивчення кінетики
фотохімічного розкладу Н2О2
![]() ,
необхідно вирівняти рівні рідин в
зрівнювальній склянц і газовій бюретці.
,
необхідно вирівняти рівні рідин в
зрівнювальній склянц і газовій бюретці.
Дослід припинити, коли виділиться 75-100 см3 газу. Дослідні дані записати в таблицю:
|
№ вимірювань |
Час від початку р-ції, с |
Покази бюретки |
Об’єм О2, що виділився,м3 |
Швидкість р-ції, м/с |
lgv |
|
|
|
|
|
|
|
При
обробці експериментальних даних
побудувати графік в системі координат
![]() .
Ця залежність необхідна для розрахунку
швидкості. Швидкість у різні моменти
часу визначається
.
Ця залежність необхідна для розрахунку
швидкості. Швидкість у різні моменти
часу визначається
![]() .
.
Інтервал
часу
![]() брати рівним 2 хвилини. Аналітична
залежність швидкості від часу виражається
рівнянням
брати рівним 2 хвилини. Аналітична
залежність швидкості від часу виражається
рівнянням
![]() ,
що в логарифмічній формі
,
що в логарифмічній формі
![]() .
.
Для
знаходження емпіричних констант А і φ
побудувати графік залежності v і τ і по
наростаючій кривій взяти значення v в
різні моменти часу і накреслити графік
у системі координат
![]() .
.
Величина
φ визначається як тангенс кута нахилу
одержаної прямої до осі τ, а
![]() - як відрізок, що відтинається прямою
на осі
- як відрізок, що відтинається прямою
на осі![]() при значенні
при значенні![]() .
.
