
- •Міністерство освіти і науки україни
- •І. Обробка та оформлення результатів лабораторних робіт
- •Іі. Правила роботи в лабораторії з фізичної хімії і техніка безпеки
- •Ліквідація нещасних випадків і надання першої допомоги
- •Ііі. Агрегатний стан речовин
- •1. Визначення маси моля речовини вимірюванням її об’єму в газоподібному стані
- •2. Визначення в’язкості системи етиловий спирт – вода
- •I. Хімічна термодинаміка
- •1. Визначення теплоти згоріння речовин за допомогою калориметра юнкерса
- •Експериментальна частина
- •2. Визначення теплоти розчинення і теплоти гідратації солі
- •V. Поверхневі явища (поверхнева енергія, поверхневий натяг та адсорбція на межі розділу фаз)
- •1. Визначення поверхневого натягу розчинів методом відліку крапель (сталагмометричним методом)
- •Поверхневий натяг води в залежності від температури
- •Густина води в залежності від температури
- •Густина розчинів NaCl при 293 к
- •2. Визначення площі та довжини молекули поверхнево-активної речовини
- •3. Адсорбція оцтової кислоти на активованому вугіллі
- •Методика експерименту
- •4. Дослідження адсорбції забарвлених речовин із розчинів
- •5. Дослідження адсорбції ізоамілового спирту із розчину за допомогою активованого вугілля
- •6. Визначення повної обмінної ємності (оє) катіоніту
- •7. Визначення вмісту лікарської речовини (глюконату кальцію) в розчині методом йонообмінної адсорбції
- •8. Обезсолювання води за допомогою йонітів
- •VI. Розчини неелектролітів
- •1. Визначення критичної температури взаємного розчинення рідин
- •2. Визначення молекулярної маси розчиненої речовини кріоскопічним методом
- •VII. Розчини електролітів
- •1. Визначення електропровідності електролітів і обчислення ступеня дисоціації
- •Експериментальна частина
- •Робота на змінному струмові
- •2. Bизначення розчинності малорозчинних сполук
- •3. Визначення іонного добутку води
- •4.Визначення концентрації кислоти методом кондуктометричного титрування
- •5. Визначення вмісту лікарської речовини в розчині
- •Хід роботи
- •Обробка результатів експерименту
- •VIII. Гальванічні елементи та електродні потенціали
- •1. Вимірювання електрорушійних сил гальванічних елементів
- •2. Визначення водневого показникa потенціометричним методом
- •3. Потенціометричне визначення рН, розрахунок константи дисоціації слабкої кислоти
- •Іх. Хімічна кінетика і каталіз
- •1. Визначення швидкості розкладу тіосульфатної кислоти
- •Дослід 1. Залежність швидкості розкладу тіосульфатної кислоти від її молярної концентрації
- •Дослід 2. Залежність швидкості розкладу тіосульфатної кислоти від температури
- •Виконання роботи
- •Склад реакційної суміші
- •Результати титрування
- •3. Дослідження гідролізу крохмалю в присутності соляної кислоти
- •4. Дослідження гідролізу крохмалю в присутності ферментів і соляної кислоти при температурі 310 к
- •5. Визначення швидкості розкладу пероксиду водню газометричним методом
- •6. Фотохімічний розклад н2о2
- •Послідовність виконання роботи
- •Х. Фізикохім ія дисперсних систем.
- •1. Методи одержання колоїдних розчинів
- •2. Коагуляція колоїдних розчинів електролітами
- •3. Визначення величини електрокінетичного потенціалу методом електрофорезу
- •4. Вивчення ізоелектричної точки білків
- •5. Набухання гелів
- •Хід виконання роботи
- •Хі. Біогенні елементи
- •1. Аналітичні реакції на йони s-елементів
- •Визначення хлор-йонів Cl– в питних водах за методом Фольгарда
- •2. Аналітичні реакції на р-елементи та їх сполуки
- •Реакція на бор (ііі) по кольору полум’я
- •Реакція на йон з розведеними кислотами
- •Реакція на йон з реактивом Несслера
- •Реакція на йон із розчином хлориду барію
- •(Реакція л.А. Чугаєва)
- •Контрольні питання до колоквіумів іii. Агрегатний стан речовин
- •Іv. Хімічна термодинаміка та біоенергетика
- •V. Поверхневі явища (поверхнева енергія, поверхневий натяг та адсорбція на межі розділу фаз)
- •Vі. Розчини неелектролітів
- •Vіі. Розчини електролітів
- •Vііі. Гальванічні елементи та електродні потенціали
- •IX. Хімічна кінетика і каталіз
- •Х. Фізикохімія дисперсних систем
- •Хі. Біогенні елементи
- •Додатки
- •Деякі фізичні константи
- •Густина деяких речовин
- •Густина деяких газів (н.У.)
- •Співвідношення між позасистемними одиницями
- •Пояснювальна записка
- •Зміст дисципліни
- •Тема 1. Предмет фізичної хімії та її значення. Розділи фізичної хімії. Методи дослідження. Розвиток фізичної хімії в Україні.
- •Тема 7.
- •Тема 8.
- •Тема 9.
- •Тема 10.
- •Тема 11.
- •Тема 12.
- •Тема 13.
- •Тема 14.
- •Орієнтовний перелік питань до підсумкового контролю знань з дисципліни.
- •Cписок літератури
- •І. Обробка та оформлення результатів
- •Гомонай Василь Іванович
3. Визначення іонного добутку води
Для роботи необхідно: реохорд АВС; звуковий генератор ЗГ; на- вушники Т або осцилограф; посуд для визначення електропровідності і платинові електроди Б; мірна колба на 50–100 мл; піпетки мірні; магазин опору.
Для виконання цієї роботи використовується рівняння
![]() .
.
Наприклад, при 291 К питома електропровідність чистої води дорівнює 4,41.10-6см.м-1. За даними таблиці, приведеної в попередній роботі, знаходимо
![]() .
.
Одержавши концентрацію іонів Н+ та ОН-
![]() ,
,
визначаємо іонний добуток води при 291 К:
![]() .
.
Аналогічно визначається величина іонного добутку води при інших температурах. Результати експерименту та розрахунків записуються у вигляді таблиці:
|
Концен-трація |
Опір розчину, Ом |
Середній опір, Ом |
Середня електро-пров. р-ну |
Ємність опору посуди- ни |
|
|
Кw |
|
|
|
|
|
|
|
|
|
4.Визначення концентрації кислоти методом кондуктометричного титрування
Для роботи необхідно: 1н.; 0,1н. розчини NaOH; контрольний розчин кислоти; піпетка на 20–25 мл; мікропіпетка; провідники електричні – 5 шт.
В об’ємному аналізі для визначення кінця титрування застосовують кольорові індикатори. Ці індикатори можуть бути використані в тих ви- падках, коли необхідно титрувати забарвлені або мутні розчини, так як на фоні цих розчинів зміну кольору індикатора визначити неможливо.
У таких випадках особливо часто при нейтралізації слабких кислот і лугів “індикатором” служить електропровідність розчинів.
Вимірювання електропровідності розчинів знайшло широке прак- тичне застосування. Одним з них являється кондуктометричне титрування. Суть методу полягає в тому, що в процесі титрування одні йони в розчині заміняються іншими, рухливість яких інша, а відповідно змінюється і електропровідність розчину.
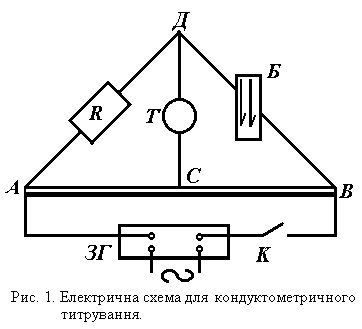
Рис. 1. Електрична схема для кондуктометричного титрування.
Визначаючи електропровідність розчину, можна розрахувати його кон-центрацію.
Оскільки електропровідність є величина обернена опорові, то для її визначення достатньо знайти опір розчину струмові, який проходить через нього. Опір визначається компенсаційним методом із застосуванням мос- тика Кольрауша, схема якого подана на рис.1, де АВС – реохорд; R – магазин опорів; Т – навушники або осцилограф; Б – посуд з розчином електроліту, електропровідність якого необхідно визначити; ЗГ – звуковий генератор; К – ключ.
При замиканні кола ключем струм від джерела струму розгалужу- ється, утворюючи 4 гілки опору: RAC ,RCB ,Rр-ну, Rмаг.
У навушниках чується звук, а на екрані осцилографа спостерігається лінія. При переміщенні контакту по реохорду в одному і другому напрямах звук то посилюється, то послаблюється, лінія на екрані змінюється за величиною.
У
момент, коли
![]() ,
струм у мостикуСД
відсутній, що вияв-
ляється повним
зникненням звуку в навушниках, на екрані
осцилографа буде точка.
,
струм у мостикуСД
відсутній, що вияв-
ляється повним
зникненням звуку в навушниках, на екрані
осцилографа буде точка.
Виходячи з поданого вище рівняння, можна визначити опір розчину
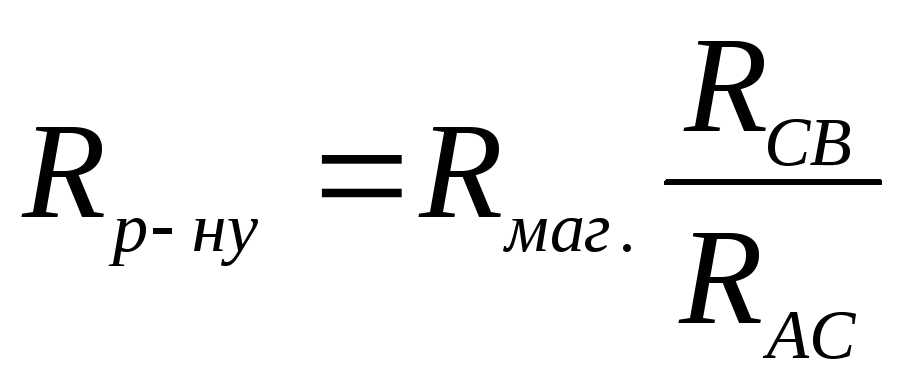 .
.
Знаючи опір розчину, розраховують електропровідність по формулі
![]() .
.
При визначенні електропровідності користуються слабими струмами високої частоти: з цією метою використовується звуковий генератор.
Посуд, в який заливається розчин (електропровідність якого треба визначити), являє собою склянку з платиновими електродами (рис. 2). Для уникнення поляризації поряд з використанням струмів високої частоти збільшують поверхню електродів. З цією метою електроди платинуються.
У склянку заливають 20–25 мл контрольного
роз-
чину кислоти і опускають електроди
в кислоту. Поста-
вивши рухомий контакт
на поділках 0,25–0,3 м на реохорді, включають
струм, користуючись ключемК.
У такому положенні підбирають за
допомогою магазину опору такий опір,
при якому струм через навушники не
проходить, тобто звук у навушниках
відсутній або стає мінімальним, або на
екрані осцилографа світиться точка.
склянку заливають 20–25 мл контрольного
роз-
чину кислоти і опускають електроди
в кислоту. Поста-
вивши рухомий контакт
на поділках 0,25–0,3 м на реохорді, включають
струм, користуючись ключемК.
У такому положенні підбирають за
допомогою магазину опору такий опір,
при якому струм через навушники не
проходить, тобто звук у навушниках
відсутній або стає мінімальним, або на
екрані осцилографа світиться точка.
Залишаючи опір магазину постійним при всіх наступних вимірюваннях, мікропіпеткою приливають порціями розчин NaOH. (Кількість розчину і концен-трація розчину NaOH вказується керівником занять).
Розчин у стаканчику помішують і рухомим контак- том знову знаходять мінімум звуку.
Мінімум звуку або точка на екрані з додаванням кожної порції лугу зміщується вліво до тих пір, поки кислота не буде повністю відтитрована. Після точки нейтралізації електропровідність розчину зростає, і тому ру- хомий контакт необхідно зміщувати вправо по лінійці.
Дослід вважається закінченим, коли одержано 5–6 вимірювань після точки нейтралізації.
Результати вимірювань записують у вигляді наступної таблиці:
|
Кіль-кість к-ти, мл |
Конц. NaOH, мольекв/л |
Кіль- кість NaOH, мл |
Опір маг., Ом |
Покази на лінійці, м |
Опір розчину, Ом |
Електро-провід. розчину, Ом–1 | |
|
АС |
СВ | ||||||
|
|
|
|
|
|
|
|
|
По
даним таблиці будують графік залежності
електропровідності розчину від кількості
лугу, яка пішла на титрування кислоти.
По графіку знаходять кількість розчину
NaOH,
необхідну для нейтралізації взятої
кількості кислоти і за формулою
![]() знаходять концентрацію контрольного
розчину кислоти
знаходять концентрацію контрольного
розчину кислоти
![]() ,
,
де N1 – невідома концентрація кислоти;
V1 – об’єм кислоти, взятий для досліду;
N2 – концентрація розчину лугу;
V2 – об’єм лугу, необхідний для відтитрування кислоти.
