
- •Затверджено радою спеціальності:
- •Приклади розв’язання задач
- •Приклад 4. Деяка кількість металу, еквівалентна маса якого дорівнює 28 г/моль, витісняє з кислоти 1,4 л водню, виміряного за нормальних умов. Визначити масу металу.
- •Розв’язання. Еквівалентна маса складної речовини, як і еквівалентна маса елемента, може мати різні значення і залежить від того, у яку реакцію вступає ця речовина.
- •Завдання для самостійної роботи
- •Завдання для самостійної роботи
- •Тема 3. Періодичний закон д.І. Менделеева Питання для самоперевірки
- •Приклади розв’язання завдань
- •Завдання для самостійної роботи
- •Тема 4. Хімічний зв’язок Питання для самоперевірки
- •Приклади розв’язання завдань
- •Завдання для самостійної роботи
- •Тема 5. Основні класи неорганічних сполук Питання для самоперевірки
- •Приклади розв'язання завдань
- •Завдання для самостійної роботи
- •Тема 7. Енергетика хімічних процесів Питання для самоперевірки
- •Приклади розв’язання задач
- •Приклад 2.Обчисліть зміну енергії Гібса у хімічній реакції
- •Стандартні зміни енергій Гібса простих речовин прийнято вважати рівними нулю. Для даної системи:
- •Завдання для самостійної роботи
- •Завдання 2. Обчисліть зміну енергії Гібса у хімічній реакції і зробіть висновки про можливість самовільного перебігу даної реакції за стандартних умов.
- •Тема 8. Хімічна кінетика та хімічна рівновага
- •Приклади розв’язання задач
- •Підставляючи дані нашої задачі, одержуємо:
- •Завдання для самостійної роботи
- •Тема 9. Розчини
- •Приклади розв’язання задач
- •Завдання для самостійної роботи
- •Тема 10.1. Електрична дисоціація Приклади розв’язання завдань
- •Завдання для самостійної роботи
- •Тема 10.2 йонні рівняння Приклади розв'язання завдань
- •Завдання для самостійної роботи
- •Тема 10.3 гідроліз. Водневий показник Приклади розв'язання завдань
- •Завдання для самостійної роботи
- •Тема 11. Комплексні сполуки Питання для самоперевірки
- •Приклади розв’язання завдань
- •Завдання для самостійної роботи
- •Тема 12. Окисно-відновні реакції Питання для самоперевірки
- •Приклади розв’язання завдань
- •Завдання для самостійної роботи
- •Тема 13. Електрохімічни процесси: гальванични єлементи, електроліз розчинів, корозія металів.
- •Тема 13.1 гальванични єлементи Питання для самоперевірки
- •Приклади розв’язання задач
- •Завдання для самостійної роботи
- •Тема 13.2електроліз розчинів Питання для самоперевірки.
- •Приклади розв’язання задач
- •Завдання для самостійної роботи
- •Тема 13. 3корозія металів Питання для самоперевірки.
- •Приклади розв`язань завдань
- •Завдання для самостійної роботи
- •Додатки
- •Продовження таблиці 1
- •Продовження таблиці 1
- •Продовження таблиці 1
- •Продовження таблиці 1
- •2. Рекомендована література
- •3. Тема 3. Періодичний закон д.І. Менделеева……………………………….. 9
Завдання для самостійної роботи
Завдання 1. Використовуючи значення ентальпільних та ентропільних факторів у стандартних умовах, визначити температуру, при якій наступає хімічна рівновага для реакції.
Завдання 2.Обчислити, в скільки разів збільшиться швидкість реакції, що перебігає в газовій фазі при підвищенні температури від Тminдо ТmaxоС, якщо температурний коефіцієнт дорівнює ɣ.
|
|
Рівняння реакцыії |
Тmin оС |
Тmax оС |
ɣ |
|
1 |
H2(г)+CO2(г)= CO(г)+ H2O(p) |
20 |
60 |
2 |
|
2 |
CaO(k)+ H2O(p)=Ca(OH)2(k) |
15 |
45 |
3 |
|
3 |
FeO(k)+ CO(г)=Fe(k)+CO2(г) |
25 |
40 |
2 |
|
4. |
4HCL(г)+ O2(г)↔2 H2O(г)+2 CL(г) |
15 |
50 |
2 |
|
5 |
С2O4+ H2O(n)= С2H5OH(г) |
25 |
65 |
3 |
|
6 |
CaC O3(k)→CaO(k)+CO2(г) |
10 |
45 |
4 |
|
7 |
N2(г)+ O2(г)=2NO(г) |
15 |
55 |
2 |
|
8 |
PCL3(г)+CL2(г)=PCL5(г) |
30 |
70 |
2 |
|
9 |
N2(г)+ 3H2(г)= 2NH3(г) |
35 |
80 |
4 |
|
10 |
Ti O2(k)+C(k)=Ti(k)+ CO2(г) |
15 |
45 |
3 |
|
11 |
CO(г)+2H2(г)↔C H2OH(p) |
25 |
65 |
2 |
|
12 |
CH4(г)+2O2(г)=CO2(г)+2H2O(p) |
10 |
75 |
2 |
|
13 |
2SO3(г)=2SO2+ O2(г) |
5 |
55 |
3 |
|
14 |
2NH3(г)→N2(г)+ H2(г) |
25 |
85 |
2 |
|
15 |
2CO2(г)+SO2(г)=S(k)+ 2CO2(г) |
10 |
50 |
4 |
|
16 |
Fe3O4(k)+CO(г)=3FeO(k)+CO2(г) |
25 |
60 |
3 |
|
17 |
СH4(г)+ CO2(г)=2 CO(г)+2H2(г) |
30 |
75 |
2 |
|
18 |
FeO(k)+ H2(г)= Fe(m)+ H2O(n) |
15 |
85 |
4 |
Тема 9. Розчини
Питання для самоперевірки
1. Дати визначення розчину.
2. Що таке концентрація розчину?
3. Способи визначення концентрації, розчинів формули, одиниці вимірювання?
4. У чому сутність правила змішування (правило христа) при приготуванні розчину проміжної концентрації з більш розведених та більш концентрованих розчинів ?
5. Яки фізичні та хімічні процеси відбуваються під час розчинення?
6. Яки існують способи приготування розчинів?
7. Що називають масовою часткою розчиненої речовини? За якою формулою її обчислюють?
8. Стандартні та стандартизовані розчини реагентів. Способи їх приготування.
Приклади розв’язання задач
Приклад 1.У 250 г води розчинено 50 г кристалогідрату FeSO47Н2О. Обчислити масову частку кристалогідрату та безводного сульфату заліза (ІІ) у розчині.
Розв’язання.Маса отриманого розчину складає 250 + 50 = 300 г. Масову частку кристалогідрату знаходимо за формулою
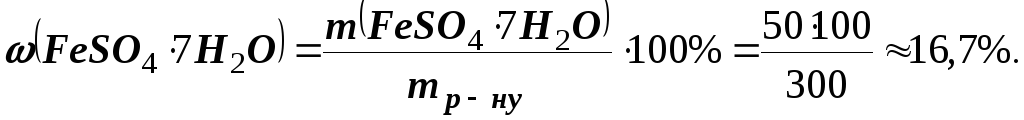
Обчислюємо масу безводної солі в 50 г кристалогідрату. Молярна маса FeSO47Н2Oдорівнює 278 г/моль, а молярна маса FeSO4складає 152 г/моль. Вміст FeSO4у 50 г FeSO47Н2О знаходимо з пропорції
у 278 г FeSO47Н2О міститься 152 г FeSO4;
а в 50 г FeSO47Н2О –Хг FeSO4;
Х= (50152) : 278 = 27,34 г.
Звідси масова частка безводної солі в 300 г розчину дорівнює:
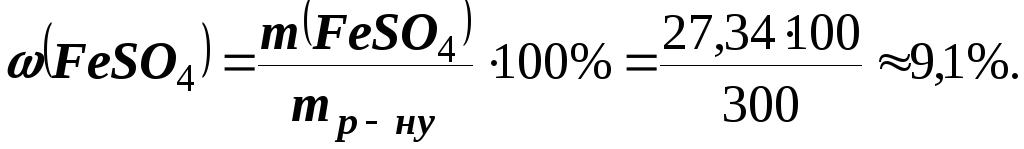
Приклад 2. З 200 г водного розчину з масовою часткою розчиненої речовини 50% при охолодженні виділилося 20 г цієї речовини. Обчислити масову частку речовини в розчині, що залишився .
Розв’язання. Визначаємо масу речовини у вихідному розчині
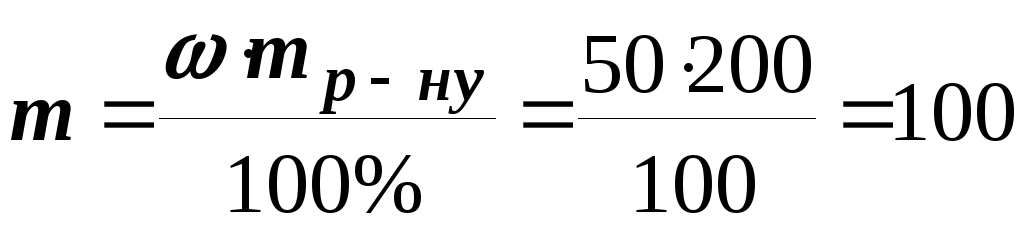 г.
г.
Маса розчину після охолодження дорівнює 200 – 20 = 180 г, а маса солі становитиме: 100 – 20 = 80 г. Таким чином, обчислюємо масову частку солі в розчині, що залишився: = (80 100) : 180 = 44,44%.
Приклад 3.Обчислити молярну концентрацію розчину ВаСl2, у 40 мл якого міститься 1,04 г розчиненої речовини. Якою є його еквівалентна молярна концентрація?
Розв’язання.Молярна маса ВаСl2становить 208 г/моль, а еквівалентна масаЕ(ВаСl2) =М(ВаСl2) : 2 = 104 г/моль. Об’єм розчину – 0,04 л. Обчислюємо молярну й еквівалентну молярну концентрації ВаСl2
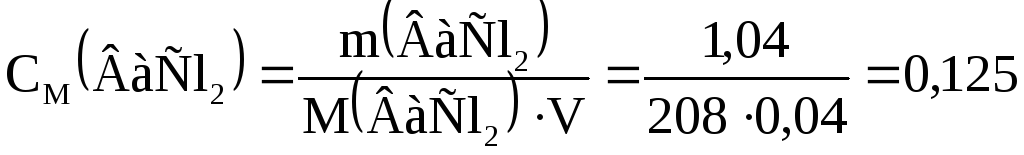 моль/л.
моль/л.
Підставивши замість М(ВаСl2)Е(ВаСl2), маємоСeq(ВаСl2) = 0,25 моль/л.
Приклад 4.Обчислити молярну концентрацію розчину з масовою часткою НСl 36,5%, густина якого= 1,18 г/см3.
Розв’язання.Обчислюємо масу 1 л (1000 см3) розчину
mр-ну = V= 1,181000 = 1180 г.
Визначаємо масу розчиненої речовини в 1180 г розчину
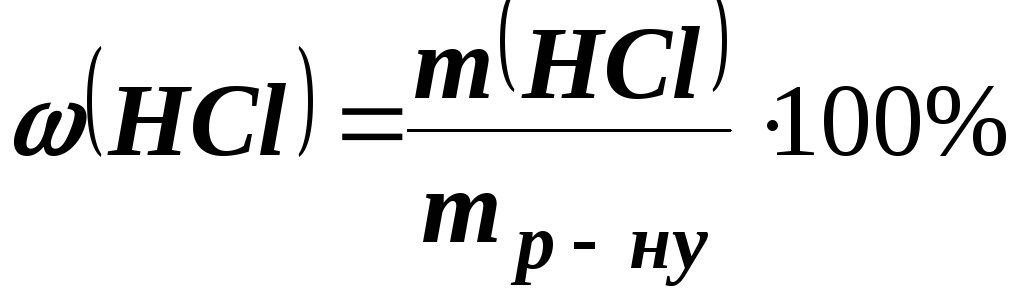 ;
;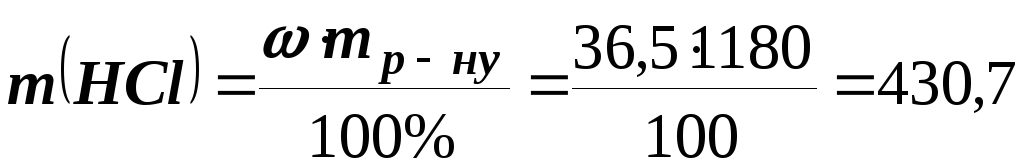 г.
г.
Визначаємо СМ(НСl) у розчині, знаючи, щоМ(НСl) = 36,5 г/моль
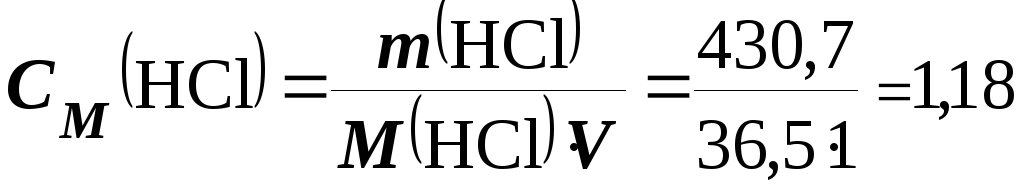 моль/л.
моль/л.
Приклад 5.Який об’єм розчину азотної кислоти з масовою часткою НNO3= 20% (= 1,115 г/см3) і який об’єм води треба взяти для приготування розчину НNO3з масовою часткою= 4% (= 1,025 г/см3)?
Розв’язання.Знаходимо масу заданого розчину (m2):m2 = 2 V2= 1,025 × × 2500 = 2562,5 г. Визначаємо масу НNO3у цьому розчині
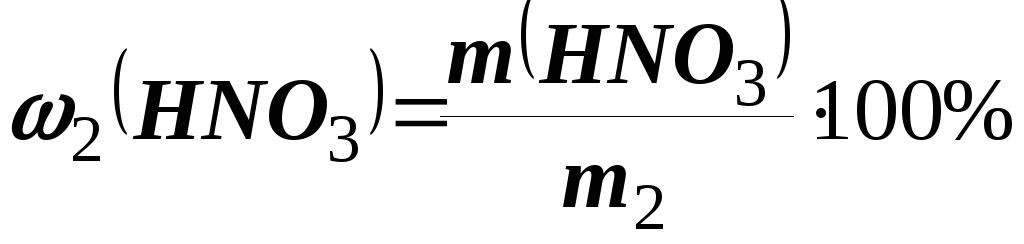 ;
;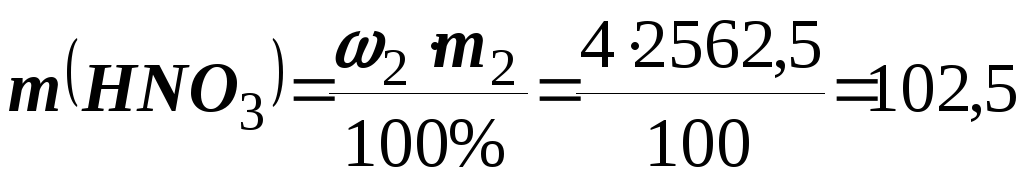 г.
г.
Знаходимо масу вихідного розчину НNO3(m1)
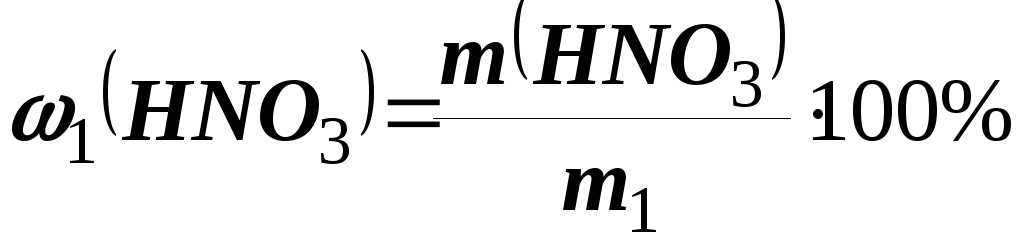 ;
;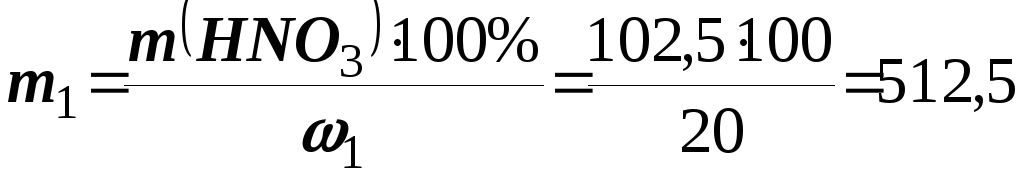 г.
г.
Далі визначаємо об’єм вихідного розчину
V1 = m1 : 1= 512,5 : 1,115 = 459,6 см3.
Нарешті знаходимо масу води: m(Н2О) =m2 – m1= 2562,5 – 512,5 = 2050 г.
Приклад 6.Який об’єм розчину з масовою часткою NaOH 36% (2= 1,39 г/см3) треба додати до 200 мл розчину з масовою часткою NaOH 11% (1= 1,12 г/см3), щоб одержати розчин із масовою часткою 20%.
Р
 озв’язання.
За правилом змішування знаходимо
співвідношення мас вихідних розчинів:
36
9
озв’язання.
За правилом змішування знаходимо
співвідношення мас вихідних розчинів:
36
9
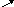
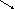 20
20
11 16
Розчину з масовою часткою NaOH 36% треба взяти 9 масових частин, а розчину з масовою часткою 11% – 16 масових частин.
Знайдемо масу розчину з масовою часткою NaOH 11%:
m1 = 1 V1 = 1,12 200 = 224 р.
Знайдемо масу розчину з масовою часткою NaOH 36%:
16:9 = 224 : m2; m2 = (224 9) : 16 = 126 р.
Визначимо об’єм розчину з масовою часткою NaOH 36%:
V2 = m2 : 2= 126 : 1,39 = 90,65 см3.
Приклад 7.До розчину КОН (1= 1,32 г/см3) об’ємом 50 мл додали воду об’ємом 150 мл. Одержався розчин КОН з масовою часткою 10%. Обчисліть масову частку (%) КОН у вихідному розчині.
Розв’язання. Знайдемо масу вихідного розчину (m1)
m1 = 1 V1 = 1,32 50 = 66 г.
Визначимо масу розведеного розчину (m2)
m2 = m1 + m(Н2О) = 66 + 150 = 216 г.
Обчислимо масу КOН в отриманому розчині
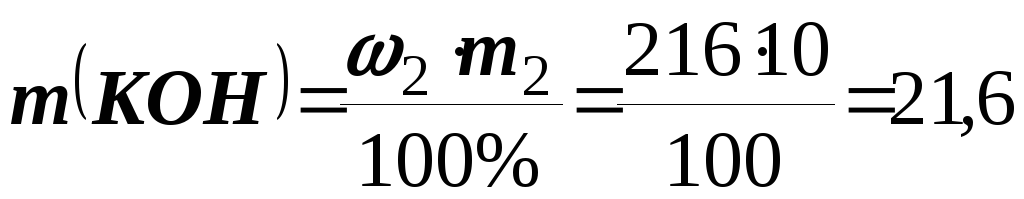 г.
г.
А масова частка КOН у вихідному розчині:
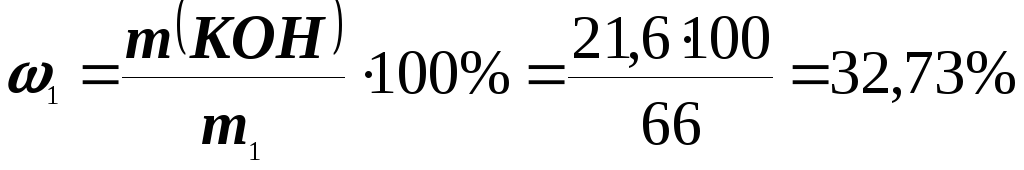 .
.
