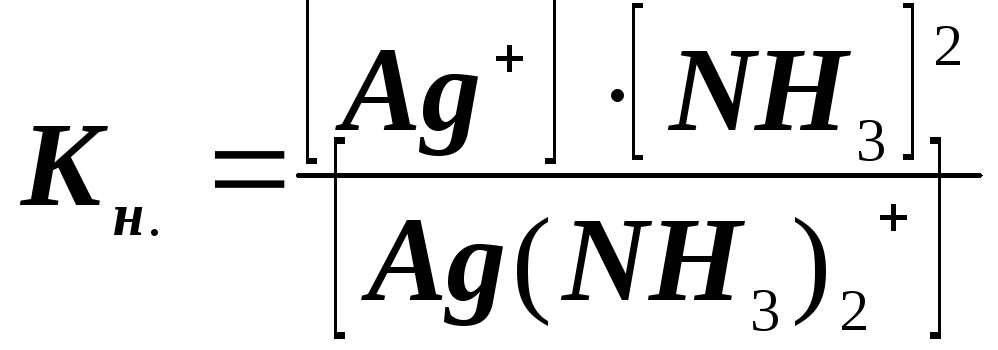- •Затверджено радою спеціальності:
- •Приклади розв’язання задач
- •Приклад 4. Деяка кількість металу, еквівалентна маса якого дорівнює 28 г/моль, витісняє з кислоти 1,4 л водню, виміряного за нормальних умов. Визначити масу металу.
- •Розв’язання. Еквівалентна маса складної речовини, як і еквівалентна маса елемента, може мати різні значення і залежить від того, у яку реакцію вступає ця речовина.
- •Завдання для самостійної роботи
- •Завдання для самостійної роботи
- •Тема 3. Періодичний закон д.І. Менделеева Питання для самоперевірки
- •Приклади розв’язання завдань
- •Завдання для самостійної роботи
- •Тема 4. Хімічний зв’язок Питання для самоперевірки
- •Приклади розв’язання завдань
- •Завдання для самостійної роботи
- •Тема 5. Основні класи неорганічних сполук Питання для самоперевірки
- •Приклади розв'язання завдань
- •Завдання для самостійної роботи
- •Тема 7. Енергетика хімічних процесів Питання для самоперевірки
- •Приклади розв’язання задач
- •Приклад 2.Обчисліть зміну енергії Гібса у хімічній реакції
- •Стандартні зміни енергій Гібса простих речовин прийнято вважати рівними нулю. Для даної системи:
- •Завдання для самостійної роботи
- •Завдання 2. Обчисліть зміну енергії Гібса у хімічній реакції і зробіть висновки про можливість самовільного перебігу даної реакції за стандартних умов.
- •Тема 8. Хімічна кінетика та хімічна рівновага
- •Приклади розв’язання задач
- •Підставляючи дані нашої задачі, одержуємо:
- •Завдання для самостійної роботи
- •Тема 9. Розчини
- •Приклади розв’язання задач
- •Завдання для самостійної роботи
- •Тема 10.1. Електрична дисоціація Приклади розв’язання завдань
- •Завдання для самостійної роботи
- •Тема 10.2 йонні рівняння Приклади розв'язання завдань
- •Завдання для самостійної роботи
- •Тема 10.3 гідроліз. Водневий показник Приклади розв'язання завдань
- •Завдання для самостійної роботи
- •Тема 11. Комплексні сполуки Питання для самоперевірки
- •Приклади розв’язання завдань
- •Завдання для самостійної роботи
- •Тема 12. Окисно-відновні реакції Питання для самоперевірки
- •Приклади розв’язання завдань
- •Завдання для самостійної роботи
- •Тема 13. Електрохімічни процесси: гальванични єлементи, електроліз розчинів, корозія металів.
- •Тема 13.1 гальванични єлементи Питання для самоперевірки
- •Приклади розв’язання задач
- •Завдання для самостійної роботи
- •Тема 13.2електроліз розчинів Питання для самоперевірки.
- •Приклади розв’язання задач
- •Завдання для самостійної роботи
- •Тема 13. 3корозія металів Питання для самоперевірки.
- •Приклади розв`язань завдань
- •Завдання для самостійної роботи
- •Додатки
- •Продовження таблиці 1
- •Продовження таблиці 1
- •Продовження таблиці 1
- •Продовження таблиці 1
- •2. Рекомендована література
- •3. Тема 3. Періодичний закон д.І. Менделеева……………………………….. 9
Завдання для самостійної роботи
Завдання 1. Скласти молекулярні, йонно-молеклярні та скорочені йонні рівняння гідролізу солей. Вказати реакцію середовища, рН.
Завдання2 . Визначити концентрацію йонів водню, гідроксид-йонів, рОН в розчині, рН якого дорівнює ……(моль/л)
Завдання3. Визначити рН, рОН розчину та гідроксид-йонів, якщо концентрація йонів водню в розчині дорівню ….. (моль/л)
|
варіант |
Завдання 1 |
Завдання 2 |
Завдання 3 |
|
1 |
KCN; ZnSO4; SbCl3 |
6.8 |
0.01 |
|
2 |
NaCN; NH4Cl; NaNO3 |
7.2 |
0.2 |
|
3 |
Na2SO3; NH4CN; BiCl3 |
4.0 |
0.003 |
|
4 |
Li2S; CaCI2; NaNO3 |
3.7 |
0.5 |
|
5 |
NaNO2; Zn(NO3)2; Cr2S3 |
3.1 |
0.06 |
|
6 |
NH4CI; NaF; NiSO3 |
2.4 |
0.007 |
|
7 |
K2S; Cr(NO3)3; K2SO4 |
2.5 |
0.004 |
|
8 |
K2SO3; NaNO3; FeCl3 |
1.2 |
0.04 |
|
9 |
(NH4)2S; KClO; Ca(CN)2 |
6.9 |
0.0016 |
|
10 |
KCN; Fe(CH3COO)3; NiSО4 |
11.3 |
0.0007 |
|
11 |
Bi(NO3)3; Na2SiO3; Cu(CH3COO)2 |
7.8 |
1.6 |
|
12 |
Al(NO3)3; K2SO3; BaS |
2.2 |
0.08 |
|
13 |
K2SO4; Mn(NO3)2; NaNO3 |
8.3 |
0.25 |
|
14 |
FeCl3; Ba(CH3COO)2; K2SO3 |
10.1 |
0.002 |
|
15 |
ZnCl2; NaClO; (NH4)2SO3 |
6.3 |
0.0016 |
|
16 |
SnCI2; Na2SO4; NaCN |
9.4 |
0.004 |
|
17 |
MnSO4; KI; CaCO3 |
8.7 |
0.0005 |
|
18 |
FeCI2; CH3COONa; K2SO4 |
2.8 |
0.06 |
|
19 |
NH4CI; K2SO3; K2S |
9.8 |
0.003 |
Тема 11. Комплексні сполуки Питання для самоперевірки
1. Основні характеристики комплексних сполук.
2. Будова комплекної сполуки.
3. Приклади різнихтипівлігандів і комплексних сполук. Сполуки комплексних аніонів,катіонів та нейтральні комплекси.
4. Реакції комплексоутворення.
5. Константи стійкості та нестійкості комплексних сполук.
6. Швидкість реакцій комплексоутворення.
7. Природа комплексонів.
Приклади розв’язання завдань
Приклад 1.Назвати комплексну сполуку: [Ag(NH3)2]Cl.
Відповідь.Згідно правилIUPAC, комплексні сполуки називаються наступним чином:хлоридіаміноаргентум (ІІ).
Приклад 2.Зазначити заряд комплексного йону, комплексоутворювач, його ступінь окиснення, координаційне число та ліганди у комплексної сполуки: [Ag(NH3)2]Cl
Відповідь.Заряд комплексного йона дорівнює зарядові зовнішньої сфери, але протилежний йому за знаком. Координаційне число комплексоутворювача дорівнює числу монодентатних лігандів, координованих навколо нього. Ступінь окиснення комплексоутворювача визначається так само, як і ступінь окиснення у будь-якій сполуці, виходячи з того, що сума ступенів окиснення усіх атомів дорівнює нулю. Заряди нейтральних молекул (Н2О; NH3;СО) також дорівнюють нулю. Заряди аніонів кислотних залишків визначають із формул відповідних кислот.
|
Варіант |
Заряд іона |
Комплексоутворювач та його ступінь окиснення. |
Координ. число |
Ліганди |
|
[Ag(NH3)2]Cl |
1+ |
Ag+2 |
2 |
2 NH3 |
Приклад 3.Написати рівняння первинної та вторинної дисоціації комплексної сполуки [Ag(NH3)2]Clта вираз для константи нестійкості комплексного йона.
Відповідь.Сіль [Ag(NH3)2]Clє сильним електролітом і у водному розчні повністю дисоціює на комплексний іон і йон зовнішньої сфери:
[Ag(NH3)2]Cl [Ag(NH3)2]+ + Cl-.
Комплексний іон також у незначній мірі дисоціює на складові частинки: [Ag(NH3)2]+Ag+ + 2NH3.
Цей процес є оборотним і характеризується константою рівноваги, яка у даному випадку називається константою нестійкості (Кн.)комплексного йона.