
- •Затверджено радою спеціальності:
- •Приклади розв’язання задач
- •Приклад 4. Деяка кількість металу, еквівалентна маса якого дорівнює 28 г/моль, витісняє з кислоти 1,4 л водню, виміряного за нормальних умов. Визначити масу металу.
- •Розв’язання. Еквівалентна маса складної речовини, як і еквівалентна маса елемента, може мати різні значення і залежить від того, у яку реакцію вступає ця речовина.
- •Завдання для самостійної роботи
- •Завдання для самостійної роботи
- •Тема 3. Періодичний закон д.І. Менделеева Питання для самоперевірки
- •Приклади розв’язання завдань
- •Завдання для самостійної роботи
- •Тема 4. Хімічний зв’язок Питання для самоперевірки
- •Приклади розв’язання завдань
- •Завдання для самостійної роботи
- •Тема 5. Основні класи неорганічних сполук Питання для самоперевірки
- •Приклади розв'язання завдань
- •Завдання для самостійної роботи
- •Тема 7. Енергетика хімічних процесів Питання для самоперевірки
- •Приклади розв’язання задач
- •Приклад 2.Обчисліть зміну енергії Гібса у хімічній реакції
- •Стандартні зміни енергій Гібса простих речовин прийнято вважати рівними нулю. Для даної системи:
- •Завдання для самостійної роботи
- •Завдання 2. Обчисліть зміну енергії Гібса у хімічній реакції і зробіть висновки про можливість самовільного перебігу даної реакції за стандартних умов.
- •Тема 8. Хімічна кінетика та хімічна рівновага
- •Приклади розв’язання задач
- •Підставляючи дані нашої задачі, одержуємо:
- •Завдання для самостійної роботи
- •Тема 9. Розчини
- •Приклади розв’язання задач
- •Завдання для самостійної роботи
- •Тема 10.1. Електрична дисоціація Приклади розв’язання завдань
- •Завдання для самостійної роботи
- •Тема 10.2 йонні рівняння Приклади розв'язання завдань
- •Завдання для самостійної роботи
- •Тема 10.3 гідроліз. Водневий показник Приклади розв'язання завдань
- •Завдання для самостійної роботи
- •Тема 11. Комплексні сполуки Питання для самоперевірки
- •Приклади розв’язання завдань
- •Завдання для самостійної роботи
- •Тема 12. Окисно-відновні реакції Питання для самоперевірки
- •Приклади розв’язання завдань
- •Завдання для самостійної роботи
- •Тема 13. Електрохімічни процесси: гальванични єлементи, електроліз розчинів, корозія металів.
- •Тема 13.1 гальванични єлементи Питання для самоперевірки
- •Приклади розв’язання задач
- •Завдання для самостійної роботи
- •Тема 13.2електроліз розчинів Питання для самоперевірки.
- •Приклади розв’язання задач
- •Завдання для самостійної роботи
- •Тема 13. 3корозія металів Питання для самоперевірки.
- •Приклади розв`язань завдань
- •Завдання для самостійної роботи
- •Додатки
- •Продовження таблиці 1
- •Продовження таблиці 1
- •Продовження таблиці 1
- •Продовження таблиці 1
- •2. Рекомендована література
- •3. Тема 3. Періодичний закон д.І. Менделеева……………………………….. 9
Завдання 2. Обчисліть зміну енергії Гібса у хімічній реакції і зробіть висновки про можливість самовільного перебігу даної реакції за стандартних умов.
|
№ варіанту |
Завдання |
|
1 |
Fe3O4(k)+CO(г)=3FeO(k)+CO2(г) |
|
2 |
CO(г)+3 H2(г)=С H4(г)+ H2O(г) |
|
3 |
Fe2O3(k)+AL(m)→ AL2O3(k)+ Fe(m) |
|
4 |
FeO(k)+ H2(г)= Fe(m)+ H2O(n) |
|
5 |
NH3(г)+HCL(г)= NH4CL(k) |
|
6 |
C2H6(г)+O2(г)→ CO2(г)+ H2O(n) |
|
7 |
CO(г)+ H2O(p)= CO2(г)+ H2(г) |
|
8 |
Fe2O3(k)+3 H2(г)=2Fe(k)+3H2O(г) |
|
9 |
СH4(г)+ CO2(г)=2 CO(г)+2H2(г) |
|
10 |
С2H2(г)+5/2O2(г)=2CO2(г)+ H2O(p) |
|
11 |
2NO(г)+ O2(г)= 2NO2(г) |
|
12 |
4NH3(г)+5O(г)=4NO(г)+6H2O(г) |
|
13 |
PbO(k)+ CO2(г)= PbCO3(k) |
|
14 |
CaO(k)+ CO2(г)= CaO3(k) |
|
15 |
Ca(NO3)2(m)+ Ca(NO2)2(m)+ O2(г) |
|
16 |
CO2(г)+4H2(г)= СH4(г)+2H2O(p) |
|
17 |
С2H4(г)+3O2(г)=2CO2(г)= 2H2O(p) |
|
18 |
2CO2(г)+SO2(г)=S(k)+ 2CO2(г) |
Тема 8. Хімічна кінетика та хімічна рівновага
Питання для самоперевірки
1. Що називається швидкістю хімічної реакції? Від чого залежить швидкість хімічної реакції?
2. Як формулюється закон діючих мас? Який фізичний зміст константи швидкості реакції?
Як впливає температура на швидкістю реакції? Що показує температурний коефіцієнт швидкості реакції?
Що таке енергія активації?
Які речовини називаються каталізаторами? Види каталізу.
Які хімічні реакції називаються оборотними, а які – необоротними?
Який стан системи називається станом хімічної рівноваги? Який фізичний зміст константи рівноваги реакції?
Як формулюється принцип Ле-Шательє? Як впливає зміна концентрацій реагуючих речовин, температури та тиску на зсув хімічної рівноваги?
Приклади розв’язання задач
Приклад 1. Використовуючи значення ентальпільних та ентропільних факторів у стандартних умовах, визначити температуру, при якій наступає хімічна рівновага для реакції:
2 NO2 ↔N2O4
Червоно-бурий прозорий
Розв’язок
Вираховуємо
∆Hx.p=![]() (N2O4)-2
(N2O4)-2![]() (NO2);
(NO2);
∆Hx.p=(9650 – 2*33820)=-57990 Дж/моль
Визначемо ∆Sx.p=(304.01 – 2*240.15)=-176.35 Дж/моль*К
∆G=∆H-T∆S
∆G=-57990+298*176.35=-5437.5 Дж/моль
Отже, ∆G<0 і реакція відбувається в прямому напрямку. Рівновага встановиться при ∆G=0, тобто ∆N=T∆S при температурі
T=![]()
Висновок: Треба збільшити температуру на 30 0С (328-298), щоб енергія Гіббіса зменшилась на 5,44 кДж/моль. Реакція за таких умов досягає рівноваги. Збільшення температури приведе до утворення значно кількості NO2(∆G>0) і реакція середовища змінить забарвлення.
Приклад 2.Обчислити, в скільки разів збільшиться швидкість реакції, що перебігає в газовій фазі при підвищенні температури від 20 до 60оС, якщо температурний коефіцієнт дорівнює 3.
Розв’язання.Залежність швидкості хімічної реакції від температури визначають емпіричним правилом Вант-Гофа за формулою:
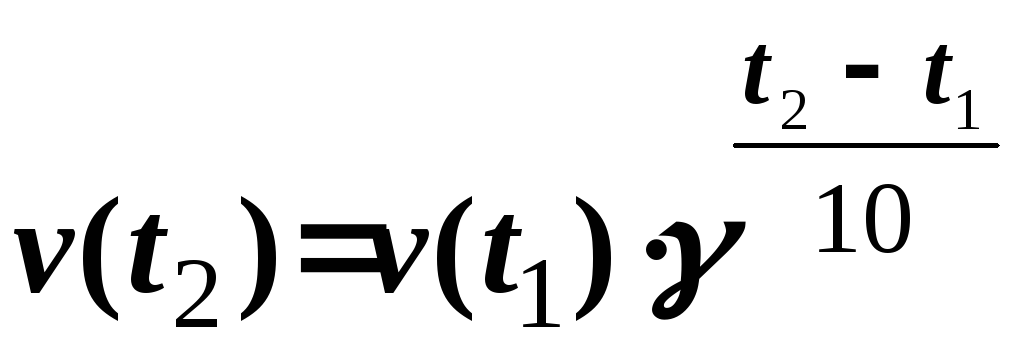 .
.
Підставляючи дані нашої задачі, одержуємо:
v(60) = v(20) 3(60-20):10 = v(20) 34 = 81v(20).
Це означає, що швидкість визначеної реакції при 60оС більше від швидкості цієї ж реакції при 20оС у 81 раз.
Приклад 3. У скільки разів збільшаться швидкості прямої та зворотної реакцій у системі: 2NO(г) + О2(г) 2NO2(г), якщо об’єм газової суміші зменшити у два рази? У який бік зсунеться рівновага реакції?
Розв’язання. Відповіднодо закону діючих мас швидкість реакції пропорційна добутку концентрацій реагуючих речовин. Швидкість прямої та зворотної реакцій до зміни об’єму становила:
vпрям. =kпрям.[NO]2[O2];vзвор. =kзвор.[NO2]2;
Після зменшення об’єму гомогенної системи в два рази концентрації кожної з реагуючих речовин збільшаться в два рази. При нових концентраціях швидкості прямої та зворотної реакцій:
vпрям.,1 = kпрям.(2[NO])22[O2] = 8kпрям.[NO]2[O2];
vзвор.,1 = kзвор.(2[NO2])2= 4kзвор.[NO2].
Звідси vпрям.,1/vпрям.= 8, аvзвор.,1/vзвор.= 4.
Отже, швидкість прямої реакції збільшилася у 8 разів, а швидкість зворотної реакції тільки в 4 рази. Таким чином, рівновага реакції зсунулася у бік утворення NO2.
