
- •Затверджено радою спеціальності:
- •Приклади розв’язання задач
- •Приклад 4. Деяка кількість металу, еквівалентна маса якого дорівнює 28 г/моль, витісняє з кислоти 1,4 л водню, виміряного за нормальних умов. Визначити масу металу.
- •Розв’язання. Еквівалентна маса складної речовини, як і еквівалентна маса елемента, може мати різні значення і залежить від того, у яку реакцію вступає ця речовина.
- •Завдання для самостійної роботи
- •Завдання для самостійної роботи
- •Тема 3. Періодичний закон д.І. Менделеева Питання для самоперевірки
- •Приклади розв’язання завдань
- •Завдання для самостійної роботи
- •Тема 4. Хімічний зв’язок Питання для самоперевірки
- •Приклади розв’язання завдань
- •Завдання для самостійної роботи
- •Тема 5. Основні класи неорганічних сполук Питання для самоперевірки
- •Приклади розв'язання завдань
- •Завдання для самостійної роботи
- •Тема 7. Енергетика хімічних процесів Питання для самоперевірки
- •Приклади розв’язання задач
- •Приклад 2.Обчисліть зміну енергії Гібса у хімічній реакції
- •Стандартні зміни енергій Гібса простих речовин прийнято вважати рівними нулю. Для даної системи:
- •Завдання для самостійної роботи
- •Завдання 2. Обчисліть зміну енергії Гібса у хімічній реакції і зробіть висновки про можливість самовільного перебігу даної реакції за стандартних умов.
- •Тема 8. Хімічна кінетика та хімічна рівновага
- •Приклади розв’язання задач
- •Підставляючи дані нашої задачі, одержуємо:
- •Завдання для самостійної роботи
- •Тема 9. Розчини
- •Приклади розв’язання задач
- •Завдання для самостійної роботи
- •Тема 10.1. Електрична дисоціація Приклади розв’язання завдань
- •Завдання для самостійної роботи
- •Тема 10.2 йонні рівняння Приклади розв'язання завдань
- •Завдання для самостійної роботи
- •Тема 10.3 гідроліз. Водневий показник Приклади розв'язання завдань
- •Завдання для самостійної роботи
- •Тема 11. Комплексні сполуки Питання для самоперевірки
- •Приклади розв’язання завдань
- •Завдання для самостійної роботи
- •Тема 12. Окисно-відновні реакції Питання для самоперевірки
- •Приклади розв’язання завдань
- •Завдання для самостійної роботи
- •Тема 13. Електрохімічни процесси: гальванични єлементи, електроліз розчинів, корозія металів.
- •Тема 13.1 гальванични єлементи Питання для самоперевірки
- •Приклади розв’язання задач
- •Завдання для самостійної роботи
- •Тема 13.2електроліз розчинів Питання для самоперевірки.
- •Приклади розв’язання задач
- •Завдання для самостійної роботи
- •Тема 13. 3корозія металів Питання для самоперевірки.
- •Приклади розв`язань завдань
- •Завдання для самостійної роботи
- •Додатки
- •Продовження таблиці 1
- •Продовження таблиці 1
- •Продовження таблиці 1
- •Продовження таблиці 1
- •2. Рекомендована література
- •3. Тема 3. Періодичний закон д.І. Менделеева……………………………….. 9
Завдання для самостійної роботи
Завдання 1
1. Обчисліть еквівалентну масу сірки, якщо 1 г її сполучається з 1,75 г заліза, еквівалентна маса якого 27,9 г/моль.
2. За 17 оС та тиску 104,99 кПа маса 624 см3 газу становила 1,56 г. Обчисліть молекулярну масу газу.
3. Обчисліть еквівалентну масу речовин: H2CO3,Zn(OH)2,CaSO3 .
Завдання 2
1. Обчисліть еквівалентну масу кобальту у його сполуці з сіркою, коли на 2 г кобальту доводиться 1,09 г сірки, валентність якої дорівнює 2.
2. Знайти молекулярну масу речовини, якщо маса 380 см3 її за 97 оС та тиску 98,66 кПа становила 1,9 г.
3. Обчисліть еквівалентну масу речовин: CH3COOH,Ca(OH)2,FeCl3.
Завдання 3
1. Визначте еквівалентну масу металу, якщо його йодид містить 5,2 % металу, а еквівалентна маса йоду дорівнює 127 г/моль.
2. Маса 760 см3 газу за 27 оС та тиску 106,66 кПа становила 0,91 г. Обчисліть молекулярну масу газу.
3. Обчисліть еквівалентну масу речовин:H2SiO3,Bi(OH)3,Al2S3.
Завдання 4
1. Обчисліть валентність міді у її оксиді, у якому на 2 г кисню доводиться 7,946 грамів міді.
2. Маса 2 л деякого газу за 27 оС та тиску 121,59 кПа становила 1,92 г. Обчисліть молекулярну масу газу.
3. Обчисліть еквівалентну масу речовин: H2S,Co(OH)3, Rb2S.
Завдання 5
1. Обчисліть валентність свинцю в оксиді, у якому на 2 г свинцю доводиться 0,3088 г кисню.
2. За 17 оС та тиску 103,99 кПа маса 128 см3 газу становила 0,312 г. Обчисліть молекулярну масу газу.
3. Обчисліть еквівалентну масу речовин: HClO,Zn(OH)2,.LiCl.
Завдання 6
1. При окисненні 4,4 г металу утворилось 7,56 г оксиду металу. Визначте еквівалентну масу металу.
2. За 42 оС та тиску 102,93 кПа маса 688 см3 газу становила 1,678 г. Обчисліть молекулярну масу газу.
3. Обчисліть еквівалентну масу речовин: H3AsO3,Al(OH)3,Cr(NO3)3.
Завдання 7
1. За тривалого нагрівання 40 г металу було одержано 53,3 г оксиду цього металу. Визначте еквівалентну масу металу.
2. Якою є молекулярна маса органічної речовини, якщо 1,86 г її за 87 оС та тиску 95,99 кПа займає об’єм 1 л?
3. Обчисліть еквівалентну масу речовин: H2CrO4, Cr(OH)3, K3AsO4.
Завдання 8
1. Визначте еквівалентну масу металу, якщо при сполученні 3,6 г металу з хлором було одержано 14,1 г солі. Еквівалентна маса хлору – 35,5 г/моль.
2. Обчисліть молекулярну масу речовини, знаючи, за температури 91 оС та тиску 97,06 кПа маса 2,68 г займає об’єм 700 см3.
3. Обчисліть еквівалентну масу речовин: HNO3,Fe(OH)2,PbCl2.
Завдання 9
1. 3. Який об’єм (н.у.) займають 3,4 кг NН3?
2. За температури 91 оС та тиску 102,39 кПа маса 171 см3 пари деревного спирту дорівнює 0,195 г. Обчисліть молекулярну масу деревного спирту.
3. Обчисліть еквівалентну масу речовин:H2Cr2O7,Cr(OH)3,BaCl2.
Завдання 10
1. При розчиненні у кислоті 23,8 г металу виділилось 0,4 г водню. Визначте еквівалентну масу металу.
2. Маса 2 л деякого газу за температури 27 оС та тиску 121,59 кПа становила 1,92 г. Обчисліть молекулярну масу газу.
3. Обчисліть еквівалентну масу речовин: HCl3,Ba(OH)2,Na2S.
Завдання 11
1. Які об’єми за нормальних умов займають 0,5 кг водню, азоту, NO?
2. 73,9 г деякої речовини у пароподібному стані за температури 127 оС та тиску 95,99 кПа займають об’єм 32,8 л. Обчисліть молекулярну масу речовини.
3. Обчисліть еквівалентну масу речовин: H2S,Mg(OH)2,CuS.
Завдання 13
1. За тривалого нагрівання 20,1 г металу було одержано 26,7 г оксиду. Визначте еквівалентну масу металу.
2. За 25оС та тиску 99,33 кПа 0,78 г деякої газоподібної речовини займають об’єм 608 см3. Обчисліть молекулярну масу газу.
3. Обчисліть еквівалентну масу речовин: HCl,Zn(OH)2,Co(NO3)3.
Завдання 13
1. Обчисліть валентність міді у її оксиді, у якому на 1 г кисню припадає 7,946 г міді?
2. За 42 оС та тиску 102,93 кПа маса 688 см3 газу становила 1,678 г. Обчисліть молекулярну масу газу.
3. Обчисліть еквівалентну масу речовин: H2Cr2O7,Fe(OH)3,Li2S.
Завдання 14
1. Визначте еквівалентну масу металу, якщо його хлорид містить 39% металу, а еквівалентна маса хлору дорівнює 35,5 г/моль.
2. За 27оС та тиску 106,66 кПа маса 0,455 г газу займала об’єм 760 см3. Обчисліть молекулярну масу газу?
3. Обчисліть еквівалентну масу речовин: HNO2,Ca(OH)2,PbCl2.
Завдання 15
1. Визначте еквівалентну масу металу, якщо його йодид містить 5,2 % металу, а еквівалентна маса йоду дорівнює 127 г/моль.
2. За 17оС та тиску 103,99 кПа маса газу 1,56 г займала об’єм 128 см3. Обчисліть молекулярну масу газу.
3. Обчисліть еквівалентну масу речовин: H2SO3,Bi(OH)3,LiCl.
Завдання 16
1. Визначте еквівалентну масу металу, якщо при окисненні 4,8 г металу утворилось 8 г оксиду.
1. Обчисліть молекулярну масу газу, якщо 7 • 10-3 кг його за 27 оС та тиску 2,53•104 Па займають об’єм 0,023 м3.
3. Обчисліть еквівалентну масу речовин: HClO4,Fe(OH)2, Al2S3.
Завдання 17
1. Який об’єм за нормальних умов займають 2 г аміаку?
2. За температури 62 оС та тиску 101,06 кПа маса 174 см3 пари становила 0,48 г. Обчисліть молекулярну масу речовини.
3. Обчисліть еквівалентну масу речовин: H2CO3,Sr(OH)2,Na3PO4 .
Тема 2. БУДОВА АТОМА
Питання для самоперевірки
1. У чому суть двоїстої природи електрона?
2. Що являють собою поняття: електронна хмара, атомна орбіталь?
3. Які квантові числа визначають стан електрона в атомі? Охарактеризуйте кожне з чотирьох квантових чисел.
Як орієнтуються у просторі s- p- і d-орбіталі?
У чому сутність приципу Паулі?
У чому полягає правило Гунда?
Що таке енерґія йонізації та енерґія спорідненості до електрона? Які властивості атома вони характеризують?
Що таке електронеґативність?
Приклади розв’язання завдань
Приклад 1. Записати електронну формули і графічну схему атома Mn.
Розв’язання. Складаємо електронну формулу атомаMn. Розподіл електронів у атоміMn. за енергетичними рівнями є наступним:
K
– 2e-;
L – 8e-;
M – 5e-;
а за підрівнями
-
1s2
2s2
2p6
3s2
3p6
4s2
3d5
де 1, 2, 3, 4, -рівні; s, p, d- підрівні.
Графічно схема заповнення електронами цих орбіталей має вигляд:
-
n=4
↑↓
n=3
↑↓
↑↓
↑↓
↑↓
↓
↓
↓
↓
↓
n=2
↑↓
↑↓
↑↓
↑↓
d
n=1
↑↓
p
s
Приклад 2. Згідно правилам Клєчковского підтвердити порядок заповнення енергетичних рівнів та підрівнів атома Mn.
Розв’язання. Порядок послідовного заповнення рівнів та підрівнів відповідає найменшому запасу енергії. Тому сума енергії на рівнях і підрівнях, які визначаються головним (n) та орбітальним (l) квантовими числами згідно з першим правилом Клечковського повинна послідовно зростати
|
|
1s2 |
2s2 |
2р6 |
3s2 |
3р6 |
4s2 |
3d5 |
|
n |
1 |
2 |
2 |
3 |
3 |
4 |
3 |
|
l |
0 |
0 |
1 |
0 |
1 |
0 |
2 |
|
n+l |
1 |
2 |
3 |
3 |
4 |
4 |
5 |
тому що s-, р-, d-, f- підрівням відповідають чисельні значення 0, 1, 2, 3.
За другим правилом Клечковського: при однакових значеннях сум (n+l) у першу чергу заповнюються орбіталі підрівня з меншим значенням головного квантового числа п. Тому при однаковому значенні сум n+l для 2р6 і 3s2 та 3р6 і 4s2 спочатку заповнюються орбіталі 2р та Зр, а потім 3s та 4s.
Приклад 3. Визначити валентні електрони елементів атома Mn.
Розв’язання. Електрони на останньому рівні та попередньому підрівні, якщо він незаповнений, - валентні.
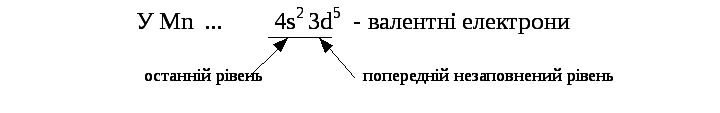
Приклад 4. Записати електронні формули атомів Mn у збудженому стані та визначити їх максимальну валентність.
Розв’язання. Валентні електрони Mn ...3d54s2 можна графічно відобразити
Mn0 + hʋ → Mn*
|
↑ |
↑ |
↑ |
↑ |
↑ |
|
|
|
|
↑ |
↑ |
↑ |
↑ |
↑ |
|
↑ |
|
|
|
|
|
3d |
|
|
↑↓ |
|
|
|
|
|
3d |
|
|
↑ |
|
4p |
|
|
|
|
|
|
|
4s |
|
|
|
|
|
|
|
|
4s |
|
|
|
Звідси бачимо, що на 4s орбіталі маємо 2 спарених електрона. Якщо додати квант енергії, то їх можна розпарувати, тобто один з електронів перевести на більш високий підрівень. На слідуючому 4р підрівні маємо вільні енергетичні комірки. Туди після одержання додаткової енергії перейде один електрон з 4s-орбіталі і отримаємо збуджений стан атому Мn*
Mn0
…3d5
4s2
+
hʋ → Mn* …3d5
![]() 14p1
14p1
У збудженому стані атома зростає валентність. Вона визначається по кількості неспарених електронів. Для Мn * валентність дорівнює 7.
Збуджених станів може бути декілька. Це залежить від кількості пар спарених електроніз
Приклад 5. Записати електронні формули йонів з характерним ступенем окиснення для їх атомів.
Розв’язання. Йони утворюються коли атом приймає чи віддає електрони. Атом Мn не може прийняти електрони, бо зовнішній підрівень 4s у нього заповнений - на ньому 2 електрони. А попередній 3d підрівень, на якому 5 електронів не може приймати електрони, бо він закритий - «екранований» зовнішніми 4s - електронами. Тому атом Мn може тільки віддавати електрони. Електрони покидають зовнішні орбіталі, завжди їх повністю звільнюють
Mn0 – 2 ͞e̶ → Mn2+
|
↑ |
↑ |
↑ |
↑ |
↑ |
|
|
|
|
↑ |
↑ |
↑ |
↑ |
↑ |
|
|
|
|
3d |
|
|
↑↓ |
|
|
|
|
|
3d |
|
|
|
|
|
|
|
|
|
4s |
|
|
|
|
|
|
|
|
4s |
Mn0 …3d5 4s2 – 2 ͞e → Mn2+…3d5 4s0
Mn0 …3d5 4s2 – 3 ͞e → Mn3+…3d4 4s0
Mn0 …3d5 4s2 – 4 ͞e → Mn3+…3d3 4s0
Mn0 …3d5 4s2 – 5 ͞e → Mn3+…3d2 4s0
Mn0 …3d5 4s2 – 6 ͞e → Mn3+…3d1 4s0
Mn0 …3d5 4s2 – 7 ͞e → Mn3+…3d04s0
Звідси зрозуміло, що у Мn можуть бути 7 ступенів окиснення: Мn0, Мп+2, Мn+3,Мn+4, Мn+5, Мn+6, Мn+7.

