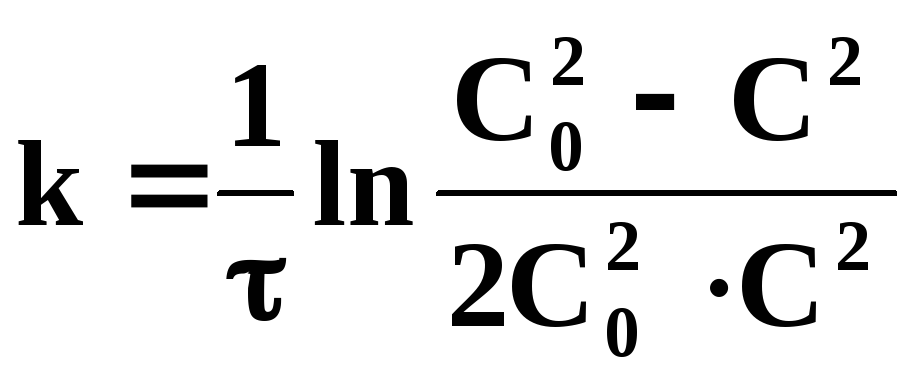- •Федеральное агентство по образованию
- •Экологическая химия
- •Введение: предмет экологической химии, задачи экологической химии
- •1Основные понятия и определения
- •1.1 Загрязнение окружающей среды. Химическое загрязнение. Вредные вещества.
- •1.2 Предельно допустимые концентрации вредных веществ
- •2.1.1. Пдк вредных веществ в атмосфере
- •1.2.2 Пдк вредных веществ в водной среде
- •1.2.3Пдк вредных веществ в почве
- •1.3.2 Распространение в ос
- •1.3.3 Время жизни (устойчивость) загрязнителя
- •1.3.4 Склонность загрязнителя к деградации (биоразложению)
- •1.4 Термодинамический и кинетический подходы к изучению поведения загрязнителей в ос
- •1) Определять возможность самопроизвольного протекания химических реакций в том или ином направлении;
- •2) Определять условия, при которых устанавливается химическое равновесие.
- •При низких давлениях газы можно считать идеальными, и Ka ≈ Kp.
- •1) Рассчитать время достижения заданной степени превращения веществ (или опре- делить степень превращения вещества в заданный момент времени),
- •2) Найти условия, при которых время достижения заданной степени превращения ве- щества будет минимальным.
- •2. Физико-химические процессы в атмосфере
- •2.1 Состав и строение атмосферы
- •Qисточник и Qсток – скорости поступления и стока веществ соответственно для произвольного резервуара, атмосферы в целом или ее части;
- •2.1.1 Основные зоны атмосферы
- •2.1.2 Атмосферное давление
- •2.1.3 Солнечная радиация и вертикальная структура атмосферы
- •2.1.4 Тепловой баланс атмосферы и подстилающей ее поверхности
- •Процессы окисления примесей в тропосфере могут протекать:
- •1.3.4. Фотохимический смог в городской атмосфере
- •1.3.6Метан
- •В присутствии no общий результат окисления метана:
- •1.3.7.1 Номенклатура и особенности тропосферного аэрозоля
- •1.3.7.2 Время жизни (устойчивость) аэрозоля
- •Водородный цикл
- •Азотный цикл
- •Хлорный цикл
- •Физико-химические процессы в гидросфере
- •3. Биогенные вещества – главным образом соединения азота и фосфора. К биогенным элементам относят также соединения кремния и железа.
- •2.2. Классификация природных вод
- •1) Физико-географические (рельеф, климат…);
- •2.3.2 Процессы растворения твердых веществ в природныхводах
- •2.4 Кислотно-основное равновесие в природных водоемах
- •2.4.2 Растворимость карбонатов и рН подземных и поверхностных природных вод
- •2.5.1 Окислительно_восстановительное равновесие
- •2.5.2 Взаимосвязь между окислительно-восстановительны-ми и кислотно-основными характеристиками природных вод
- •2.6 Процессы самоочищения водных экосистем
- •2.6.1 Виды загрязнений и каналы самоочищения водной среды
- •2.6.3 Физико-химические процессы на границе разделафаз
- •1) В качестве окислителя участвуют ионы металлов в окисленной форме;
- •2) В окислении зв участвуют свободные радикалы и другие реакционноспособные частицы.
- •1) Рекомбинация и диспропорционирование
- •3) Присоединение по кратной связи
- •3 Физико-химические процессы в почвах
- •3.1 Гипергенез и почвообразование
- •3.3 Элементный и фазовый состав почв
- •3.4 Оганические вещества почвы
- •3.4.1 Классификация органических веществ почвы
- •3.5.2 Обменные катионы почв
- •3.7 Соединения азота в почве
- •3.6 Проблемы загрязнения почвенных экосистем
- •3.6.1 Проблема применения минеральных удобрений
- •3.6.2 Проблемы применения химическх средств защиты растений
- •3.6.3 Поведение пестицидов в ос
1.4 Термодинамический и кинетический подходы к изучению поведения загрязнителей в ос
Любые превращения – абиотические (химические) или биотические (биохимические) могут быть рассмотрены с точки зрения химической термодинамики и с точки зрения химической кинетики.
Химическая термодинамикана основе сведений об изменении термодинамических функций позволяет:
1) Определять возможность самопроизвольного протекания химических реакций в том или ином направлении;
2) Определять условия, при которых устанавливается химическое равновесие.
Пример 1
Для реакции N2 + O2 = 2NOвычислите температуру, выше которой процесс протекает самопроизвольно. Определите содержаниеNOв равновесной смеси и равновесный выходNOпри температурах 298К, 2500К и равновесной температуре, если исходная смесь – воздух.
Решение
Воспользуемся уравнением изотермы Вант-Гоффа для стандартных условий с целью вычисления константы равновесия Ка.
![]() ,
отсюда
,
отсюда![]()
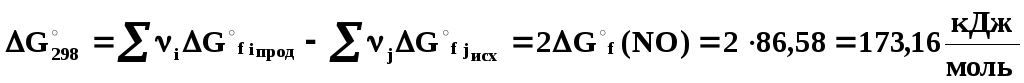
![]()
![]() ,
4,44 ·10-31
,
4,44 ·10-31
следовательно, процесс протекает самопроизвольно в обратном направлении.
В
состоянии равновесия
![]() иKa
= 1.
иKa
= 1.
![]() ,
отсюда
,
отсюда![]()
Считаем, что
![]() и
и![]() ,
тогда
,
тогда![]() .
.
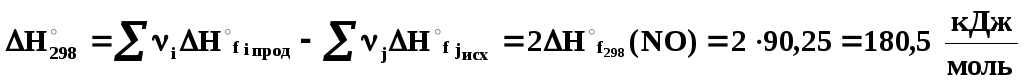
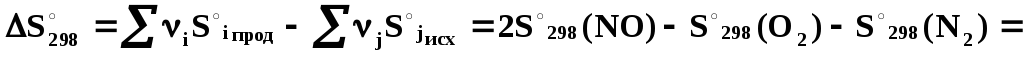
![]()
![]()
Процесс образования NOиз азота и кислорода будет протекать самопроизвольно приT> 11100K. При этой температуреKa= 1.
При низких давлениях газы можно считать идеальными, и Ka ≈ Kp.
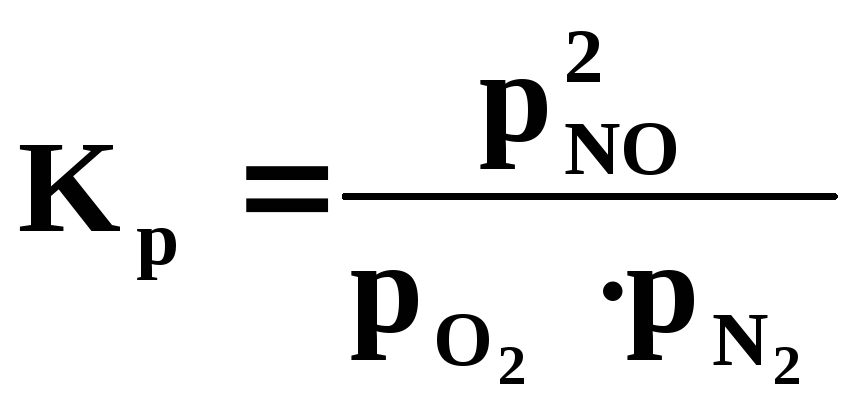
pNO = P·NNO; pO2 = P·NO2; pN2 = P·NN2;
Содержание N2,O2,NOв системе и их мольные доли равны:
N2 O2 NO
νо, моль 0,79 0,21 0
νравн, моль 0,79 – х 0,21 – х 2х
N0,79 – х 0,21 – х 2х*
*
![]() ;Σνi
= 0,79 – х + 0,21 – х + 2х = 1
;Σνi
= 0,79 – х + 0,21 – х + 2х = 1
T = 298K;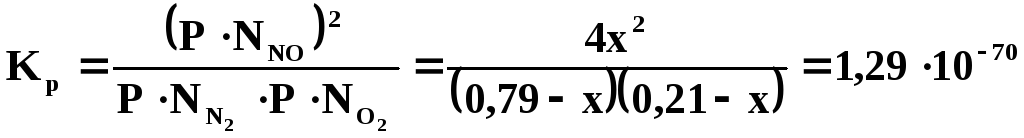
4х2= (0,79– х)(0,21 – х)·1,29·10-70
4х2≈ 0х ≈ 0ηNO ≈ 0
T = 2500K;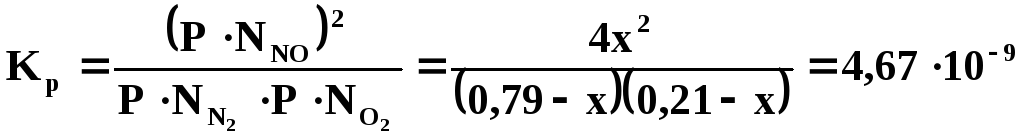
4х2= (0,79– х)(0,21 – х)·4,67·10-9
4х2= 1,659·10-10– х·4,67·10-9+ х2·4,67·10-9
4х2+ х·4,67·10-9– 1,659·10-10= 0
![]()
![]()
![]()
T = 11100K;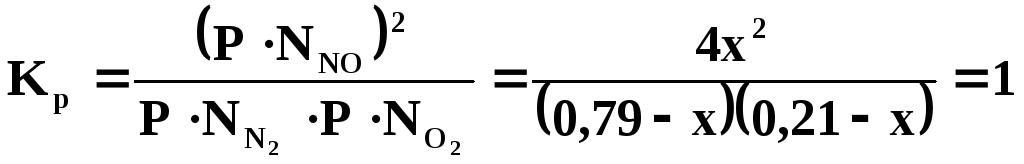
4х2= (0,79– х)(0,21 – х)
3х2+ х –0,1659 = 0
![]()
![]()
![]()
Ответ:Травн= 11100K; η298(NO) = 0; η2500(NO) = 4·10-4%; η11100(NO) = 24,3%.
Химическая кинетикапозволяет с помощью кинетических уравнений:
1) Рассчитать время достижения заданной степени превращения веществ (или опре- делить степень превращения вещества в заданный момент времени),
2) Найти условия, при которых время достижения заданной степени превращения ве- щества будет минимальным.
Кинетические уравнения реакций 0…3 порядков приведены в таблице 6.
Таблица 6 – Кинетические уравнения реакций нулевого, первого, второго и третьего порядков
|
Порядок реакции |
Кинетическое уравнение |
Период полураспада |
Примечания | |
|
вычисление константы |
С = f(τ) | |||
|
Нулевой |
|
|
|
|
|
Первый |
|
( |
|
|
|
Второй |
|
|
|
СА= СВ= С0 |
|
Третий |
|
|
|
СА= СВ= = СС= С0 |
Пример 2
Оксид азота (V) при 67ºС разлагается по уравнению: 2N2O5 (г)= 4NO2 (г)+O2 (г) Зависимость концентрации реагента от времени описывается следующими данными:
|
τ, мин |
0 |
1 |
2 |
3 |
4 |
5 |
|
С(N2O5),моль/л |
1,000 |
0,705 |
0,497 |
0,349 |
0,246 |
0,173 |
Определите порядок реакции, константу скорости и период полураспада N2O5 (г). Вычислите время, в течение которого концентрация образующегосяNO2достигнет его ПДКс.с., если начальная концентрацияN2O5равна 1ммоль/м3.ПДКс.с.(NO2) = 0,085мг/м3.
Решение
Предположим, что реакция имеет первый порядок, и определим константу скорости реакции методом подстановки.
![]() 0,350мин-1
0,350мин-1
![]() 0,350мин-1
0,350мин-1
![]() 0,351мин-1
0,351мин-1
![]() 0,351мин-1
0,351мин-1
![]() 0,351мин-1
0,351мин-1
Так как k ≈ const, то порядок реакции действительно первый.
![]() мин-1
мин-1
![]() мин
мин
С(NO2)с.с.= 0,085/46 = 1,85 · 10-3ммоль/м3
Согласно уравнению реакции
ΔС(N2O5) = 0,5 ΔС(NO2) = 0,5·1,85 ·10-3= 0,925 ·10-3ммоль/м3
Сτ(N2O5)
= С0– ΔС = 1,0 – 0,925 ·10-3=
0,999075ммоль/м3
![]()
![]()
![]() мин =0,026мин = 1,6 с
мин =0,026мин = 1,6 с
Ответ:n= 1;k= 0,351мин-1; τ0,5= 1,97мин; τ = 1,6с.