
- •Вода как химическое соединение. Классификация воды по способу взаимосвязи ее с различными веществами.
- •Химические свойства воды.
- •Водородная связь.
- •Химико-технологическая характеристика природных вод.
- •Способность воды к растворению.
- •Факторы, влияющие на формирование состава природных вод.
- •Классификация природных поверхностных вод.
- •Физические основы гидрохимических процессов.
- •Круговорот воды на Земном шаре.
- •Коллигативные свойства водных растворов.
Гидросфера – непрерывная водная оболочка, включающая в себя
Гидросфера – непрерывная водная оболочка, пронизывающая литосферу, биосферу и атмосферу.
Вода в природе и жизни человека.
Общая масса воды в гидросфере – 2∙1018 тонн.
Вода в гидросфере распределяется неравномерно:
В Мировом Океане – 1372 млн. км3, что составляет 1/800 объема Земли;
В литосфере – 600 млн. км3;
В материковом льде – 23 млн. км3;
В материковой суше – 1 млн. км3:
Водяные пары в атмосфере – 13 тыс. км3.
Ежегодно с поверхности Земли испаряется 0,5 млн. км3 воды, т.е. половина объема всех водоемов суши.
Установлено, что водяные пары в атмосфере обновляются в течение 10 суток, в реках – 12 суток, в озерах – 10 лет, воды Мирового Океана – 3000 лет, а в самой малоподвижной форме – в ледниках полный водообмен происходит за 8500 лет.
Особый интерес представляет вода в биосфере. Содержание воды в биосфере составляет 60-70%. Человек на 65% состоит из воды. Без воды он погибает в течение недели.
Вода: биохимические реакции, терморегуляция.
Все биохимические реакции, протекающие в отсутствие влаги, ведут к необратимым изменениям, с водой в организм человека поступают минеральные вещества. Вода обеспечивает движение всех энергетических и питательных потоков в теле.
Отсутствие в питьевой воде необходимых солей приводит к нарушению вводно-солевого баланса, что приводит к возникновению болезней. Оптимальный уровень содержания солей в воде: 200-500 мг/л. Суточная потребность в воде составляет 1,5-2 л, при физических нагрузках до 6 л.
Человек использует воду в питьевых, лечебных, гигиенических и хозяйственно-бытовых целях.
из диаграммы видно, что 97% содержится в океанах, 2%+1% - в литосфере, 2% - полярные ледяные шапки (наземные и подземные).
<1% - континентальные пресные воды, из которых:
0,30 – почва
0,005 – почвенная влага;
0,0001 – реки;
0,00004 – вода в биосфере.
Большая часть нашей планеты покрыта океаном (71%). Количество воды в гидросфере практически постоянно. Одним из источников попадающей воды – ювенильные воды (при извержении вулканов).
Площадь поверхности мирового океана равна 360 млн. км2 (в 2р больше площади суши). При этом в северном полушарии на сушу приходится 39% площади планеты, в южном – 19%.
Все водные объекты могут обладать водосбором (часть земной поверхности или толщи почв и горных пород, откуда вода поступает в водный объект), имеется у всех………………………………….
Граница между смежными водосборами – водораздел. Водораздел различают поверхностный и подземный.
Совокупность водотоков и водоемов гидрографическая сеть.
Водные объекты – скопление природных вод на земной поверхности или в верхнем слое земной коры, обладающее определенным гидрологическим режимом.
Все водные объекты: водотоки (поступательное движение в руслах в направлении уклона), водоемы (в понижениях земной поверхности с замедленным движением вод), особые водные объекты (ледники и подземные воды).
Науки о природных водах:Гидрохимия;Гидрология;Озероведение лимнология);Гидрология подземных вод.
Гидрохимия – наука, изучающая химический состав природных вод и закономерности его изменения под воздействием химических, физических, биологических факторов и, в последнее время, антропогенных условий окружающей среды.
Основной вопрос гидрохимии: вопрос о формировании состава природных вод, при решении этого вопроса применяются методы из следующих наук: климатология…………………..
Гидрохимия – часть гидрологии, науки о происхождении, закономерности распределения, движения, а также их физических свойств в их химико-газовом составе природных вод.
Предметом гидрологии является водный режим и процессы водных объектов с атмосферой, литосферой и биосферой.
Использование природных вод в хозяйстве
По характеру водоиспользования вод все предприятия делятся на водопотребляющие (изымают воду из источников и потребляют ее, не возвращая обратно) и водопользующие (не изымают воду из источников и используют не саму воду, а ее энергию (или ее среду, или как элемент ландшафта)).
Гидрологические характеристики
-
характеристики водного режима (уровень воды, скорость течения, расход воды, сток воды за интервал времени, уклон поверхности, характеристики теплового режима (температура снега, льда, теплосодержание водного объекта)).
-
характеристики ледового режима (сроки наступления и окончания фаз (очищения ото льда, вскрытие)).
-
характеристики режима наносов ( содержание в воде взвешенных частиц, расход наносов).
-
характеристики гидрохимического режима (минерализация (М), соленость(‰)).
-
характеристики гидрофизического режима (светопропускание, вязкость, температура)
-
характеристики гидробиологического режима (состав и численность водных организмов (экз./м3), величина биомассы, показатель по конкретному виду).
Совокупность закономерно повторяющихся изменений гидрологического состояния водного объекта – гидрологический режим этого водного объекта.
Совокупность закономерно повторяющихся изменений гидрологического состояния водного объекта – гидрологический режим этого водного объекта.
Совокупность химических, физических и биологических состояний определяет закономерности, формирующие гидрологическое состояние и режим водного объекта.
Меры, применяемые в Росси для рационального использования и охраны водных ресурсов.
Водное законодательство в России:
Государственный учет
Государственный водный кадастр.
Водные ресурсы на Земном шаре, континентах, России, все природные воды ледников, океанов, морей и т.д. В узком смысле – это природные воды, которые используются в хозяйственных нуждах в настоящее время и могут быть использованы в обозримом смысле. Наиболее ценными ресурсами являются пресные воды, которые складываются из статических (озер, ледников, подземных вод) и возобновляемых (восстанавливаемые ежегодно в процессе круговорота).
Государственный водный кадастр – систематизированный свод сведений о всех водных ресурсах страны, включающий количественные и качественные показатели, данные регистрации водопользователей и учета пользователей воды.
Введение государственного водного кадастра предусмотрено основными водными законодательствами. Основная задача: обеспечение народного хозяйства необходимыми данными о водных ресурсах, объектах, режиме работы, качестве и использовании природных вод, а также сведениями о водопользователях.
В основе водного законодательства лежит «Водный кодекс РФ», принятый в 1995 г..
Вода как объект изучения гидрохимии. Исторические сведения. Аномальные свойства воды.
Вода представляет собой прозрачную бесцветную жидкость, без вкуса, без определенного строения.
Вода состоит из 11,13% водорода и 88,87% кислорода, причем водорода по объему в 2, 00275 раза больше, чем кислорода.
Химическая формула воды – Н2О, молекулярная масса – 18,01.
Гипотеза происхождения воды на Земле (механизмы возникновения и эволюции Мирового океана).
Источник воды при образовании гидросферы – неясен. Некоторые метеориты содержат в себе до 20% воды, связанной гидроксильными группами ОН. При бомбардировке протоземли кометами, обогащенными водяными парами – представляет другой источник появления воды на Земле.
Согласно гипотезе «холодного образования планет Солнечной системы», вода в виде кристалликов льда существовала в первичном газопылевом облаке, из которого 5 млрд. лет назад возникла Земля. Как бы это не происходило, но когда поверхность Земли остыла до 100 ºС, водяные пары, дегазирующиеся из мантии, могли сконденсироваться.
Известно, что океаны образовались примерно 3,8 млрд. лет назад. Очень малое количество водяных паров проникает из атмосферы в космос, т.к. на высоте 15 км низкие температуры атмосферы вызывают их конденсацию и выпадение их на более низкие уровни. Небольшое количество воды дегазируется сейчас из мантии. Исходя из этих наблюдений, можно предположить, что после этой фазы дегазации основной объем воды мало изменялся за это время.
Мантия Земли содержит практически неисчерпаемые запасы химически связанной воды 13-15 млрд. км3, т.е. в 10 раз больше свободной воды во всем Мировом океане.
Одни считают, что в результате бурной вулканической деятельности океанические бассейны заполнились за 1-2 млрд. лет существования Земли. Впервые вода поднялась на земную поверхность из жерла вулкана в виде пара, образующего густые облака, из которых выпадали обильные дожди, которые дали начало первым водоемам.
Другие считают, что океан заполнялся постепенно на протяжении геологической истории Земли тем же способом.
В настоящее время толщина слоя океанской воды в среднем равна 1/3450 части или 0,03% Земного диаметра. В сущности, это тончайшая водяная пленка на поверхности Земли, играющая подобно озоновому слою исключительно важную роль в биосферной системе.
На поверхности остальных планет Солнечной системы нет и такого слоя воды. На Марсе и Венере (более нагретых) вода может существовать длительно лишь в виде пара, а на остальных «заземных» планетах (холодных) – в виде льда (в неограниченном количестве), и лишь на поверхности Земли вода распространена в жидком состоянии.
Из истории исследования воды.
До середины 18 века воду считали простым и неделимым веществом. В 1783 А. Я. Лавуазье установил, что вода имеет сложное строение, и в ее состав входят кислород и водород. Наверное, он был первым, кто сознательно синтезировал воду (2,5 г.) из кислорода и водорода………………………….
Аристотель связывал основные элементы стихии с их свойствами: вода при повышении температуры превращается в пар, а при понижении – в лед, в землю. Такой взгляд на воду, как на элемент, содержащий два качества: холодное и влажное – просуществовал почти до середины 17 века. И даже создатель паровой машины Дж. Уатт считал, что вода и воздух одно и тоже. Бойль, основываясь на собственных опытах, пришел к выводу о сложном строении воды и о ее образовании при сгорании многих веществ, но разгадки ее состава не последовало.
Английский ученый Генрих Кавендишль, открывший водород, доказал, что вода образуется при его сгорании. Он подошел вплотную к ее составу, но лишь Лавуазье смог синтезировать, описать и определить химическую формулу воды.
В 19 веке продолжаются исследования воды и определение ее свойств. Так в 1931 году Г. Юрий теоретически обосновал и практически получил тяжелую воду – окись дейтерия (1934 – Нобелевская премия). В 20 веке ведется изучение и применение свойств тяжелой воды. В военной области открытие тяжелой воды привело к созданию водородной бомбы.
Аномальные свойства воды.
В течение долгого времени изучения воды было установлено, что вода несмотря на ее простую химическую формулу является одним из самых сложных веществ и с химической и с физической стороны.
Вода как физическое тело имеет ряд особенностей, резко отличающих ее от всех других жидкостей. Это отличие проявляется в ее аномальных свойствах:
-
наибольшая плотность воды наблюдается при 4ºС, и с дальнейшим понижением температуры до замерзания или с повышением температуры до кипения плотность уменьшается.
-
при замерзании воды объем ее скачкообразно увеличивается примерно на 10%, при этом твердая фаза воды становится легче жидкой (только не многие вещества, такие как Вi, Ga, Ge имеют такую аномалию). Это обеспечивает жизнь биоты в поверхностном водоеме в зимнее время (тепловое расширение).
-
удельная теплоемкость воды больше, чем у большинства веществ, кроме водорода и аммиака, именно поэтому плавление льда сопровождается увеличением теплоемкости почти вдвое. С ростом температуры теплоемкость воды уменьшается, и только после достижения 40ºС начинает расти вновь.
-
вода обладает исключительно большой теплотой плавления льда – 79,7 кал./г. Т.е. вода и лед при температуре 0ºС отличаются по величине скрытой энергии почти на 80 кал.
-
температура замерзания воды уменьшается при увеличении давлении приблизительно на 1С на каждые 130 атмосфер, и достигает минимума при-22С при р=2115 атмосфер, при дальнейшем увеличении температура замерзания увеличивается.
-
температура кипения воды равна 100ºС, но учитывая, что водород кипит при температуре, равной -253 ºС, а кислород – при -182ºС, вода должна была бы кипеть в пределах от -100 до -150 ºС.
Наиболее важными свойствами воды, связанными с наличием жизни на Земле, связаны с температурами кипения и замерзания. Температура кипения воды на 180 градусов больше той, которую определили при сопоставлении точек кипения ближайших аналогов воды ( H2S= -60,75 ºС; H2Se= -41,5 ºС; H2Te= -1,8 ºС). Таким образом, если бы не особое строение воды, она кипела бы при температуре, равной -80 ºС, т.е. в земных условиях не существовало бы жидкой воды.
-
теплота испарения воды наибольшая и составляет 539 кал./г при 100 ºС.
-
диэлектрическая проницаемость (Е) воды равна 81,0 при 20 ºС, у большинства других тел она находится в пределах 2-3, за исключением ряда кислот: НСООН = 58, НСN = 107, ацетон = 21.
-
коэффициент преломления равен 1,3, в то время как по волновой теории света он должен быть равен 9.
-
вода, испытавшая действие магнитного поля не образует накипи в котлах, улучшает извлечение из руд меди, свинца, ускоряет затвердевание цемента и упрочняет бетон. .
-
в дистиллированной воде после 200-500 и увеличением р, появляются новые физические и химические свойства: 1) повышение растворяющей способности (активизированная вода), 2) увеличивается ее кислотность, 3) при уменьшении температуры до 25 ºС ее свойства сохраняются некоторое время.
-
вода, полученная в результате соединения большого числа молекул воды, «поливод», имеет целый ряд иных физико-химических свойств. Например, она кипит при температуре в 4-5 раз более высокой той, при которой кипит обычная.
-
талая вода – вода, образованная таянием твердого льда(сверхтекучая)способна стимулировать рост растений.
-
поверхностное натяжение воды наиболее высокое, по сравнению с другими жидкостями.
-
растворяющая способность очень высокая
-
Прозрачность: коэффициент прозрачности очень высокий.
-
Высокая теплопроводность
Влияние аномалий воды на физико-биологическую характеристику среды:
-
теплоемкость препятствует чрезмерным перепадам температуры. Обеспечивает увеличение переноса тепла при движении воды. Позволяет поддерживать приблизительно одинаковую температуру тела живого существа.
-
температура плавления. Обеспечивает эффект термостатирования в точке замерзания за счет поглощения или выделения теплоты.
-
теплота испарения чрезвычайно важна в процессах теплопереноса и в круговороте воды.
-
теплота расширения. Это свойство играет важную роль в регулировании распределения температур и вертикальной циркуляции воды в статичных водоемах.
-
поверхностное натяжение важно для физиологии клетки, регулирует некоторые поверхностные процессы (образование капель и их свойства).
-
растворяющая способность влияет на физические и биологические явления. Например, на метаболизм.
-
диэлектрическая проницаемость способствует сильной диссоциации неорганических веществ.
-
прозрачность. В инфракрасной и ультрафиолетовой областях спектра велико поглощение энергии спектра, в видимой области – мало (селективность поглощения), отсюда прозрачность воды. Характерное поглощение водой в разных частях спектра важно в биологических процессах.
Особенности строения молекулы воды.
Наличие аномалий у воды обусловлено несимметричным расположением атомов и перегруппировкой молекул воды при изменении температуры.
Вода состоит из двух атомов водорода и одного кислорода, связанных между собой полярной ковалентной связью.
На рис.1 представлено изображение молекулы воды в соответствие с ее валентной структурой. Это изображение теоретическое, на самом деле молекула образуется стяжением атомов кислорода и водорода путем взаимодействия между электронами, находящимися на их внешних орбитах и является сложной системой, несущей одновременно положительный и отрицательный заряд.
В молекуле воды ядра атомов располагаются по вершинам равнобедренного треугольника, у которого две стороны равны, а угол при вершине, в которой находится ядро атома кислорода, составляет 104º24’ (пар, вода) или 109º30’ у льда. Такое строение молекулы воды показано в виде распределения электронов и гибритизированных электронных облаков на рис. 2 и 4, из которых видно наличие положительных и отрицательных полюсов (заряды не компенсируются, т.к. катион водорода соединяется с атомом кислорода, образуя угол, не равный 180º).
На рис. 3 приведены размеры составляющих характеристик молекулы воды в ее графическом пространственном представлении, т. е. величины граней равнобедренного треугольника, где показано равенство длины связи каждого атома водорода с кислородом (0,9584 Аº), а также расстояние между атомами водорода, равное 1,515 Аº. такое расположение атомов в молекуле воды (рис.2-4) создает наибольшую устойчивость. Электронные связи, удерживающие составные части молекулы, очень велики, и необходима большая энергия, чтобы нарушить связь между атомами. Действительно, разложение воды на атом кислорода и два атома водорода начинается только после температуры, большей 1000 ºС, но даже при температуре, равной 2000 ºС, разрушается всего 1,8%, при температуре 3092 ºС – 13%, при нормальной температуре из 10 млн. молекул воды только одна распадается на атомы.
Константа равновесия (Кр) реакции разложения воды:
Н2О↔Н2 +1/2 О2
Кр составляет 8,88∙10-41 , константа стремиться к 1 лишь при температуре больше 4000 ºС.
С современных позиций электронное облако молекулы воды имеет вид, изображенный на рис. 2. это вид усеченного четырехлопастного винта, который может быть размещен в неправильном кубе (рис.6). это электронное облако, которое может наблюдаться при очень высоком разрешении оптической техники. Более точно, чем с помощью электронного облака, можно изобразить с помощью групп электронных орбиталей (рис.5)
В свободном атоме кислорода электронная конфигурация l-слоя (2s2 2p4) такова, как показано на рис.5. при этом плотность заряда 2s2 пары электронов распределена по сфере около внутренней электронной оболочки, а плотность заряда 2pz, 2py и 2px, составляющих 2р4, распределена симметрично около взаимно перпендикулярных осей x, y,z. При связывании двух атомов водорода 2ру и 2рх орбиталями угол между осями (90°) увеличивается вследствие электростатического отталкивания, и это возмущение приводит к увеличению гибридизации. Валентный угол, соответствующий минимуму...... молекулы при участии s-электронов в валентном электронном состоянии, как и угол между осями, проходящими через максимальную плотность заряда, увеличивается.
Гибридизация между p и s состояниями также благоприятствует перераспределению заряда на двух неподеленных парах электронов атома кислорода, способствуя их несимметричному удалению от ядра кислорода в сторону от протонов. Такое распределение заряда обуславливает большой дипольный момент молекулы (рис.7) 1,88·10-18 единиц СТСЭ. Этот важный параметр, а также угол и длина связи, обуславливает возможность образования водородных связей между отдельными молекулами воды.
Теория строения воды.
Еще совсем недавно предполагали, что вода представляет собой аморфное тело, в котором мoлекулы движутся беспорядочно. Но 1933г. Бернал и Фаулер предложили структурную формулу воды, которая легла в основу всех современных теорий строения молекул воды. Согласно этим теориям, молекулы воды, благодаря своим высоким дипольным моментам, способны ассоциироваться, создавая кристаллическую решетку в виде тетраэдра и перекрещивающихся цепочек молекул воды (за счет водородных связей). (рис.8, 8-а, 9)
Структура льда (рис.10), она характерна правильным расположением молекул, где каждая молекула связана с четырьмя соседними молекулами воды и находится на пересечении двух цепочек. Если бы молекулы воды не могли взаимодействовать между собой и структурироваться, океаны Земли были бы газообразными, и не было бы жизни. С другой стороны, расположение молекул в кристаллической решетке льда особое, оно отличается от плотной упаковки молекул так, что в решетке много свободных мест, поэтому лед имеет относительно невысокую плотность, меньшую, чем у жидкой воды. В результате твердый лед поднимается на поверхность, объем его увеличивается, закрывая водоем от атмосферы, предотвращая замерзание водоема до дна.
Искусственно, при высоком давлении, были получены разные модификации льда: одни – тяжелее воды, другие – плавятся и замерзают при более низких температурах («горячий лед»). Нам повезло с особым строением молекул воды, количеством солнечной радиации, атмосферным давлением, иначе вся Земля была бы покрыта льдом.
С изменением температуры воды происходит перестройка ее структуры. При увеличении температуры от 0 до 4°С часть водородных связей, объединяющих соседние молекулы, приобретает большую свободу, располагаясь в полостях, которыми так богата ажурная структура льда. Наибольшего уплотнения структура достигает при 4°С, и только при дальнейшем нагревании усиливающегося теплового движения взаимное отклонение молекул берет верх над уплотнением.
Разрыв водородных связей увеличивается, вода начинает расширяться. Согласно двухструктурной теории воды, разработанной Самойловым, Гуриковым и Вдовенко: вода представляет собой смесь участков двух родов: одни участки являются обломками структуры льда, другие – это разрушенная структура льда, в которой большинство связей порвано. Наряду с такими высокомолекулярными группами в воде находятся беспорядочные молекулы воды (Н2О)1, (Н2О)2, (Н2О)3 и др., но уже не структурированы.
Количество таких субмолекул зависит от температуры воды (рис.11) и определяет изменение плотности ассоциации молекул и структурным изменениям решетки можно объяснить не только уменьшение плотности от 4°С до 0°С, но и многие другие аномалии воды, а именно: большая теплоемкость, теплота плавления и испарения, связанные с затратой энергии на ассоциацию или диссоциацию молекул и преодоление электрических моментов при перестройке их в соответствующую структуру.
Из рис.11 видно, что при температуре, примерно равной 0°С, в воде присутствуют, в основном, ди- и тримеры (и тетрамеры), при температуре, равной 40°С в воде присутствуют, в основном, димеры, а в газообразном состоянии – мономеры.
Некоторые ученые, Фрэнк и Винн, считают, что жидкая вода представляется конгломератом «мерцающих» кластеров, состоящих из соединенных водородными связями молекул, ………в более или менее свободных молекул (рис.13). Время полужизни кластеров в 10-10 – 10-11 с, таким образом кластеры непрерывно образуются и разрушаются в соответствии со стромными флуктуациями на микроучастке жидкости.
Ни одна из приведенных теорий не является вполне удовлетворительной, но ни одна из них не лишена истины. На рис.12 показаны основные структурные формы воды в соответствии с различными теориями. На рис.12.1 представлена кристаллическая решетка льда, под 12.2 представлены кристаллические фазы воды, отличные от кристаллической решетки льда, 12.3 – беспорядочно связанные молекулы воды, мономерные молекулы (теория Фрэнка и Вина).
Влияние давления и температуры на структуру чистой воды. Кластеры Фрэнка и Вина имеют меньшую плотность, чем плотность……….в которую они погружены. Принцип Ле-шателье гласит, что если система, выведена из равновесия, происходящие в ней изменения направлены так, чтобы скомпенсировать внешнее воздействие и свести к минимуму внешнее воздействие. Можно ожидать, что наложение внешнего давления вызовет появление состояния с меньшим удельным объемом и, более мелкие частицы будут растворяться или плавиться.
Под растущим давлением объем морской воды уменьшается. Вода менее сжимаема, чем другие жидкости (рис.14). Пи температуре, равной 50ºС, наблюдается минимум изотермичной сжимаемости воды, который может быть объяснен структурными перестройками. Подвижность молекул в воде должна очень сильно зависеть от степени их связываемости и, следовательно, от прочности структуры жидкости.
Зависимость вязкости воды от давления проявляет сильную аномальность. Если вязкость нормальных жидкостей с ростом давления увеличивается, т.к. молекулы сближаются одна с другой, и их движение затрудняется, то вязкость жидкой воды (30% соленость), по сравнению со значением вязкости этих жидкостей при одной атмосфере, с ростом давления уменьшается, затем проходит через минимум и только потом увеличивается, как в нормальном случае (рис.15). Существование минимума объясняется одновременным действием: уменьшением доли кластеров и сжатием пустот.
Наиболее очевидным аномальным явлением является наибольшая плотность (минимум удельного объема) при 4ºС. Ряд авторов теории структуры воды считают, что это явление возникает вследствие наложения двух процессов: 1) увеличение плотности из-за разрушения кластеров, частично обусловлено структурой воды, 2)уменьшение из-за обычного термического расширения.
Другие ученые, Фрэнк и Винн, считают, что это явление связано с существованием строго определенных размеров кластеров, которые зависят от температуры. Другими словами, вода имеет различную структуру при различной температуре. Соотношением определенного числа кластеров определенного размера и обусловлена особенность плотности (вязкости и электрической проводимости) при 4ºС. В таблице 1 приведены некоторые сведения о температурной зависимости параметров жидкой воды.
|
Т, ºС |
Среднее число молекул в кластере |
Мольная доля кластеров |
Мольная доля несвязанной воды |
Доля неразорвавшихся водородных связей |
|
0 |
64,96 |
0,0084 |
0,2485 |
0,528 |
|
30 |
30,34 |
0,0147 |
0,3180 |
0,434 |
|
70 |
14,54 |
0,0243 |
0,3940 |
0,356 |
|
100 |
11,70 |
0,0268 |
0,4375 |
0,325 |
Изотопный состав воды.
Используя теорию структуры воды, можно объяснить ряд особенностей и свойств воды. Однако, невозможно объяснить все аномалии воды, не учитывая наличие в воде изотопов кислорода и водорода.
Массовое число обозначается верхним индексом, характеризует число протонов и нейтронов в ядре.
1Н – протий, 2Н – дейтерий (D), 3Н – тритий (Т).
в природной воде отношение 1Н:D=6800:1. Трития очень мало. Известны и другие изотопы водорода.
Известны 14О, 15О, 16О, 17О и др. В настоящее время известно пять изотопов водорода и шесть – кислорода, комбинации которых создают 36 изотопных разновидностей воды, из которых только девять содержатся в природных водах.
Наличие изотопов водорода и кислорода приводит к тому, что природная вода представляет собой смесь всех изотопов воды. В противоположность легкой воде смесь основных типов воды называется тяжелой, т.к. она отличается от обычной более высоким удельным весом. На практике под тяжелой водой подразумевается окись дейтерия. Тяжелая вода по своим свойствам сильно отличается от обычной.
Воды различного происхождения имеют неодинаковый изотопный состав. Наибольшей плотностью обладает кристаллизационная вода, содержащаяся в тканях растений и животных. Одной из главных причин, создающих такую дифференциацию изотопов в природной среде, является процесс испарения. Нелетучесть тяжелой воды несколько ниже обычной, а так называемый процесс испарения является основным фактором в круговороте, от обогащение природных вод изотопами в местах испарения и обеднение их в местах конденсации может вызвать заметную разницу в плотности воды. В тяжелой воде замедлены некоторые реакции и биологические процессы, она используется как замедлитель нейтронов, а также для получения соединений с меченым водородом.
Вода как химическое соединение. Классификация воды по способу взаимосвязи ее с различными веществами.
Вода – самое распространенное и одно из наиболее важных веществ в природе. Она является главной составной частью живой материи и окружающей среды. В зависимости от способа взаимосвязи с различными веществами воду в природе можно подразделить по следующим видам:
Конституционная вода – вода, входящая в состав вещества как неотъемлемая часть молекулы. Ее молекулы входят в анионные или катионные комплексы (Са(ОН)2, Аl(ОН)3). Эта вода не содержится в виде молекул воды, а образуется из атомов водорода и кислорода при разложении вещества под влиянием нагрева.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Кристаллизационная вода (вода в кристаллогидрате) – определенное число молекул входит в состав некоторых безводных веществ. Эта вода может выделяться при нагревании и вновь присоединяться к безводному веществу, если на него подействовать водой.
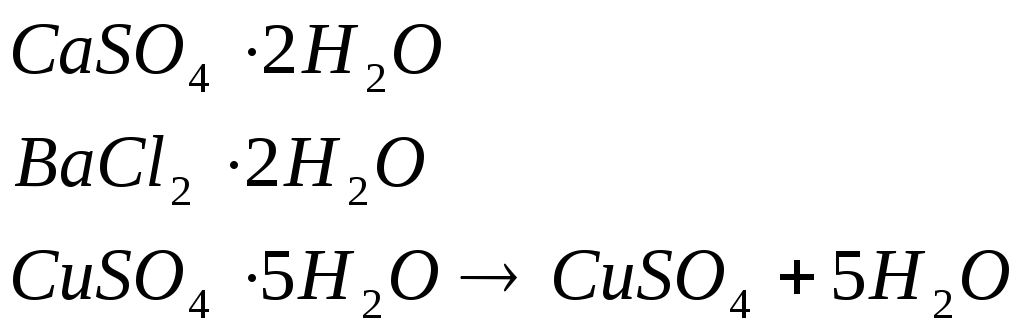
Кристаллизационную и конституционную воду называют стехиометричной водой, т.к. количество ее в молекуле определено коэффициентом при кислороде и водороде.
Структурно свободная вода – вода, которая располагается в структурных пустотах не входя в их состав (алюмосиликаты, цеолиты (твердые коллоидные растворы)).
![]() , где
, где
m – любой металл
э – AlSi
![]()
![]() - опал (гель)
- опал (гель)![]()
![]() - красный барит (золь)
- красный барит (золь)
Адсорбционная вода (гигроскопическая) – физически связанная вода, поглощенная твердыми веществами, имеющими большое количество пор и развитую поверхность. На поверхность ртути, кварца, в полостях пемзы в силу большой силы сцепления и прилипания молекулы воды адсорбируются и составляют так называемую гигроскопическую влагу.
Биологически связанная вода – вода, содержащаяся в связанном состоянии в тканях животных и растений (например, в теле медузы содержится 99% воды). Эту воду, синтезированную в организме человека, животных, растений, называют ювенильной – эта вода наряду с остальными видами входит в состав биосферы.
Вода может входить в состав различных органических соединений. Часто эту воду определяют как конституционную воду, однако, если вода входит в состав органических биологических структур, то эта вода в большей мере может рассматриваться как элемент ювенильной воды.
Химические свойства воды.
Вода частично диссоциирует:
![]()
В такой форме вода практически не существует:
![]() (ион гидроксония, является самой сильной
кислотой)
(ион гидроксония, является самой сильной
кислотой)
![]()
![]()
![]()
Вода – аморфное соединение:
![]()
Вода может быть как окислителем, так и восстановителем.
Сильные окислители (рис., обл.3) окисляют воду с выделением кислорода:
![]()
![]()
Рис.. зависимость потенциалов водородного и кислородного электродов от рН среды, парциальное давление равно 100 кПа.
Сильные восстановители (рис., обл.1) восстанавливают воду с выделением водорода:
![]()
При повышенной температуре водяной пар взаимодействует с оксидом углерода (на железном катализаторе), а также с метаном (на никелевом катализаторе), при этом протекают реакции:
![]()
![]()
Вода реагирует с оксидами многих металлов и неметаллов с образованием гидроксидов:
![]()
![]()
Вода является лигандом и координируется как катионами, так и анионами.
![]()
![]()
![]()
На один ион водорода и гидроксильную
группу соответственно образуется
протон, гидроксильная группа и
![]() .
Эта диссоциация достаточно сильная,
Кд=10-5 (приблизительно равна
Кд(СН3СООН)).
.
Эта диссоциация достаточно сильная,
Кд=10-5 (приблизительно равна
Кд(СН3СООН)).
Вода взаимодействует с анионами слабых кислот и катионами слабых оснований, т.е. вступает в реакцию гидролиза с их солями:
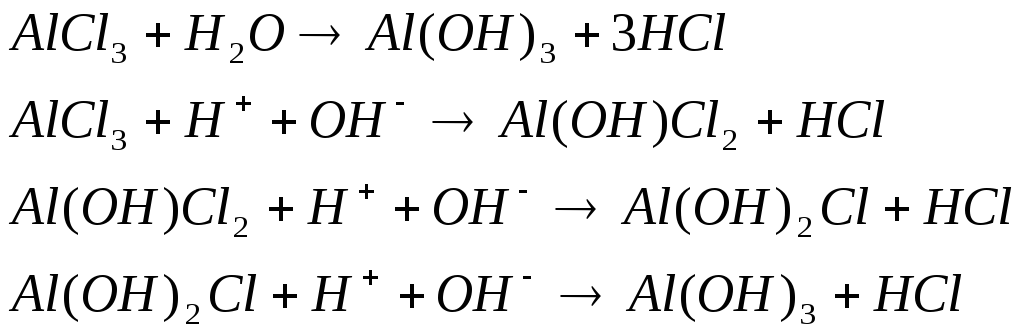
Вода образует кристаллогидраты с некоторыми солями:
![]()
Вода при взаимодействии с различными ионами образует гидратированные формы ионов. В водном растворе не существует иона натрия, в воде образуется гидратированный ион натрия, количество молекул воды зависит от заряда: однозарядные гидраты связываются не менее, чем с четырьмя молекулами воды, двухзарядные – с шестью.
Вода катализирует протекание многих реакций (например, щелочные металлы взаимодействуют с каким-либо веществом при комнатной температуре только в присутствии следов воды).
Вода – участник и среда для протекания множества биохимических реакций в живых организмах. Жизнь человека, растений, животных и микроорганизмов связана с водными растворами. Одним из биологических катализаторов является энзимгидрагиназа, с помощью которой вода включается в биохимический процесс.
Т.к. молекулы воды полярны, они хорошо растворяют многие полярные и хорошо диссоциирующие соединения. В воде у таких веществ образуются водородные связи с ней (водой). Результатом этого может стать образование нового химического соединения.
