
- •Вода как химическое соединение. Классификация воды по способу взаимосвязи ее с различными веществами.
- •Химические свойства воды.
- •Водородная связь.
- •Химико-технологическая характеристика природных вод.
- •Способность воды к растворению.
- •Факторы, влияющие на формирование состава природных вод.
- •Классификация природных поверхностных вод.
- •Физические основы гидрохимических процессов.
- •Круговорот воды на Земном шаре.
- •Коллигативные свойства водных растворов.
Классификация природных поверхностных вод.
Существует много различных классификаций, но одной из важных является классификация по степени минерализации, т.е. по сумме растворенных в воде солей в граммах на килограмм воды (для природных морских и озерных вод) или в миллиграммах на литр воды для речной.
По степени минерализации природные воды подразделяются на:
< 0,2 г/кг – ультрапресные;
0,5 – 1 г/кг – пресные;
1 – 25 г/кг – солоноватые;
25 – 50 г/кг – соленые;
> 50 г/кг – рассолы.
Предел пресных вод основан на восприятии человеком вкуса солености при минерализации свыше 1 г/кг.
Граница между солоноватыми и солеными водами установлена на том, что при минерализации 25 г/кг температура замерзания и температура наибольшей плотности морской воды совпадают и меняются многие свойства воды, влияющие на гидрологический режим.
Граница 50 г/кг между солеными водами и рассолами принята потому, что солености, выше этой в морях не наблюдается, а характерна она только для соленых озер и высокоминерализованных подземных вод.
Речные воды подразделяются на:
Ультрапресные (малой минерализации), до 200 мг/л;
Средней минерализации, 200 – 5 мг/л;
Повышенной минерализации, 500 – 1000 мг/л;
Высокой минерализации, > 1000 мг/л.
Большинство рек имеют воды малой и средней минерализации. Воды высокой минерализации встречаются чрезвычайно редко.
Озерные воды подразделяются на:
Пресные, < 1 г/кг;
Солоноватые, 1 – 25 г/кг;
Соленые, >25 г/кг.
Классификация вод по их минерализации осуществляет систематизацию вод лишь в общих чертах, не учитывая содержание отдельных ионов и газов.
Классификация по химическому составу.
В подавляющем большинстве случаев
солевой состав вод определяется следующим
набором катионов и анионов:
![]() Эти ионы, как главные ионы воды
(макрокомпоненты), определяют химический
тип воды.
Эти ионы, как главные ионы воды
(макрокомпоненты), определяют химический
тип воды.
Классификация природных вод по химическому составу, предложенная О. А. Олейкиным, изображена на рисунке и является наиболее приемлемой для вод, используемых в питьевых и хозяйственно-бытовых целях.

В ее основу положены два принципа: 1. преобладания ионов, 2. соотношение между ними. По первому, все анионы воды делятся на три класса (гидрокарбонатный, сульфатный и хлоридный), иногда выделяют четвертый карбонатный класс. Символика этих классов: С, S, Cl и СО3 соответственно. Воды каждого класса делятся по преобладающему катиону на три группы: кальциевая (Са), магниевая (Мg), хлоридная (Cl). Каждая группа делится на четыре типа. Тип обозначается римской цифрой от I до IV. В соответствии с классом, группой и типом выводят формулу воды: записывается…. К символу класса добавляется нижний индекс, соответствующий степени минерализации с точностью до 0,1 г/л; рядом записывается символ группы с верхним индексом, соответствующим общему катионному составу до целых единиц вещества в ммоль/л.
Например,
![]() это гидрокарбонатно-натриевая вода с
общей минерализацией 1,2 г/л, с преобладанием
гидрокарбонат иона и иона натрия, где
общее содержание катионов составляет
0,5.
это гидрокарбонатно-натриевая вода с
общей минерализацией 1,2 г/л, с преобладанием
гидрокарбонат иона и иона натрия, где
общее содержание катионов составляет
0,5.
Тип воды определяется соответствием между содержанием ионов в процентах в пересчете на количество вещества эквивалентов:

![]()
Воды I типа образуются в результате химического выщелачивания изверженных пород или при процессах обмена кальция и магния на натрий. Чаще всего они мало минерализованы и составляют воды бессточных озер.
Воды II типа – смешанные воды, их состав может быть связан генетически как с осадочными породами, так и с продуктами выветривания изверженных пород. К этому типу относятся воды большинства рек, озер, подземные вод с малой и умеренной минерализацией.
Воды III типа – метаморфизованные воды, они включают в себя какую-то часть сильноминерализованных вод или вод, подвергшихся катионному обмену ионов натрия на ионы кальция и магния. Это вода океанов, морей, лиман, реликтовых водоемов.
К IV типу относятся воды, характеризующиеся отсутствием гидрокарбонат ионов. Это кислые воды: болотные, шахтные, вулканические воды или воды, сильно загрязненные промышленными сточными водами самого различного состава. Воды этого типа принадлежат к сульфатному или хлоридному классам, где не может быть вод I типа.
Не всегда приведенная формула состава воды (1) дает достаточную информацию для составления характеристики этой воды, более полная информация, учитывающая содержание растворенного газа, температуру и дебет воды (расход), предложена Курловым Е. И. и получила название по имени автора.
Оформляется в виде дроби: в числителе – элементы класса, в знаменателе – элементы группы с соответствующими индексами: нижний – содержание в г/кг, верхний – содержание в процентах ммоль эквивалентов. Справа от дроби – температура и дебет в м3/сутки, слева – содержание газа и общая минерализация воды.
Например, воды Александровско-Ермолинского источника в г. Пятигорске имеют следующий вид:
 ,
где
,
где
Д – дебет, [м3/сутки]
![]() [г/дм3]
[г/дм3]
М – минерализация, [г/кг]
Нижний индекс – [г/кг]
Верхний индекс – процент от 50% катионов или анионов в ммоль/л. Если количество процентное содержание от суммы эквивалентов общего количества (по 50% на анионы и катионы) будет не меньше 25%, то это будет соответствовать определяющему классу или группе, если меньше 25% - смешанного класса и группы.
Физико-химические показатели воды.
1. плотность. Максимальная плотность дистиллированной воды равна 1 г/см3 и наблюдается при температуре 3, 982 ºС и при нормальном давлении. Плотность воды зависит от солености воды, от температуры и несколько от давления (см. аномальные свойства воды).
2. поверхностное натяжение. Силы взаимодействия молекул, составляющих воду, притягивают друг друга, и разорвать эту связь непросто (опыт с иголкой на поверхности воды). Все эти явления и легенды связаны с большим поверхностным натяжением воды. Благодаря ему вода поднимается как по каналам в грунте на поверхность земли, поступает в клетки растений и животных. Только у ртути поверхностное натяжение больше, чем у воды (из всех известных элементов).
Жидкости в свободном состоянии стремятся принять такую форму, которая соответствовала минимальной площади их поверхности. Это условие выполняется в том случае, когда жидкость принимает сферическую форму. Состоянию с минимальной площадью соответствует минимальная энергия жидкости, следовательно, увеличение поверхности жидкости требует затраты энергии. Например, если вылить воду на воск, она растечется в виде неправильных капелек, чтобы их собрать воедино, нужно затратить энергию.

Энергия, необходимая для увеличения поверхности жидкости на единицу площади – поверхностное натяжение жидкости. Возникновение поверхностного натяжения объясняется неуравношением межмолекулярных сил, действующих у поверхности жидкости, по сравнению с тем состоянием межмолекулярного взаимодействия, которое имеет место внутри жидкости.
На поверхности жидкости результирующая сила направлена внутрь. Под действие этой силы жидкость сжимается. Силы взаимодействия между одинаковыми молекулами, от которых зависит давление насыщенного пара жидкости, ее температура, вязкость, поверхностное натяжение называются силами когезии. Силы взаимодействия между молекулами разных веществ (вода – стекло) называются силами адгезии. В зависимости от того, что больше, мениск как в (1) И (2) будет вогнутым или выгнутым. Если жидкость смачивает стенки трубки (вода со стеклом) уровень жидкости повышается – эффект капиллярного действия. Смачивание стенок трубки должно приводить к увеличению площади поверхности жидкости, а поверхностное натяжение должно эту площадь уменьшать, и, следовательно, жидкость втягивается в трубку. Этим эффектом объясняется подъем жидкости по капиллярам ткани растений и в пустотах породы и почвы.
Поверхностное натяжение зависит от температуры:
![]()
![]() - поверхностное натяжение, [Дж/м²];
- поверхностное натяжение, [Дж/м²];
![]() константы, зависящие от свойств жидкости;
константы, зависящие от свойств жидкости;
Т – температура, [К].
Модно сравнить зависимость поверхностного натяжения от температуры нескольких жидкостей
|
Температура, ºС
|
Поверхностное натяжение γ, Дж/м² |
|||||
|
Вода |
Этиловый спирт |
Эфир серный |
бензол |
Ртуть |
||
|
20 |
7,29 |
2,23 |
1,70 |
2,89 |
46 |
|
|
40
|
6,99 |
2,20 |
1,61 |
2,58 |
39 |
|
|
60 |
6,70 |
|
||||
|
80 |
6,40
|
|
||||
Если поверхностное натяжение воды равно 7,29∙10-² Дж/ м², то это означает, что для увеличения площади поверхности заданного количества воды на 1 м² необходимо затратить энергию, равную 7,29 Дж. Эта энергия невелика, и с уменьшением температуры, следует из таблицы, поверхностное натяжение увеличивается.
3. вязкость. Жидкости могут легко или с трудом перетекать из одного сосуда в другой. Быстрота течения жидкости определяется ее вязкостью. Чем больше вязкость, тем медленнее перетекает жидкость. Измерить вязкость можно по времени вытекания определенного объема жидкости через капилляр (тонкая трубочка) под действием силы тяжести или по скорости падения шарика в исследуемой жидкости. Вязкость – внутреннее трение, можно охарактеризовать как свойство жидкости ( в том числе газов или твердых среды) оказывать сопротивление их течению: перемещению одного слоя среды относительно другого под действием внешних сил. Вязкость – величина, обратная текучести.
Вязкость по Ньютону определяется как коэффициент пропорциональности ……………..с градиентом скорости, определяется по выражению:

Р – направление сдвига;
G – разность скоростей двух параллельных слоев жидкости друг относительно друга, если расстояние между ними равняется одному метру.
Вода характеризуется аномальной зависимостью вязкости от давления, уменьшаясь с ростом давления при температуре от 0 до 30 ºС. Т.к. вязкость определяется тем, насколько легко перемещаются друг относительно друга молекулы жидкости, то, следовательно, она зависит от сил притяжения между молекулами жидкости, а также от структурных особенностей молекул, определяющих легкость их перемещения в жидкости. Вязкость уменьшается с ростом температуры, т.к. увеличивается средняя кинетическая энергия молекул, что позволяет им легче преодолевать силы притяжения между молекулами. Исключение составляет вязкость воды (см. аномальные свойства воды).
Вязкость измеряется в пуазах, [см-¹∙г∙с-¹] или [Н·с/м2].
4. температура кипения воды. Кипеть жидкость начинает тогда, когда давление насыщенных паров ее становится равным атмосыерному давлению. Температура кипения жидкости зависит от внешнего давления. Температура кипения воды при 760 мм рт ст равна 100 ºС. Температура кипения при внешнем давлении, равным одной атмосфере, называется нормальной температурой кипения. При увеличении давления температура кипения увеличивается, при уменьшении – уменьшается.
5. температура застывания воды. Температура застывания воды зависит от солености воды и уменьшается при росте давления примерно на 1ºС на каждые 130 атм. Температура замерзания воды при дальнейшем увеличении давления достигает минимума, -22 ºС, а давления при этом равно 2115 атм., при еще большем увеличении давления, температура застывания тоже увеличивается и может стать больше 0 ºС. При нормальных условиях температура замерзания равна 0 ºС.
Термодинамические константы воды.
Как было показано выше, вода имеет аномальные свойства в отношении термодинамических свойств. В первую очередь это относится к теплоте парообразования.
Удельная теплоемкость воды (с) равна
4,19
![]() .
Это приблизительно в два раза больше
удельной теплоемкости растительного
масла,…….Это означает, что при нагревании
на одинаковое количество градусов вода
способна воспринимать почти вдвое
больше тепла, чем перечисленные жидкости,
но при остывании вода также отдает
больше тепла. Следовательно, при
нагревании вод Мирового океана солнечными
лучами их остывании в случае отсутствия
энергии солнечной радиации, удельная
теплоемкость воды выступает как свойство,
обеспечивающее минимальные колебания
температуры воды днем и ночью, летом и
зимой.
.
Это приблизительно в два раза больше
удельной теплоемкости растительного
масла,…….Это означает, что при нагревании
на одинаковое количество градусов вода
способна воспринимать почти вдвое
больше тепла, чем перечисленные жидкости,
но при остывании вода также отдает
больше тепла. Следовательно, при
нагревании вод Мирового океана солнечными
лучами их остывании в случае отсутствия
энергии солнечной радиации, удельная
теплоемкость воды выступает как свойство,
обеспечивающее минимальные колебания
температуры воды днем и ночью, летом и
зимой.
Аномально высокое значение имеет теплота парообразования воды. Эта величина больше, чем в два раза величины парообразования у этанола, ацетона, анилина, следовательно, даже в самое жаркое время вода испаряется крайне медленно, что способствует ее сохранению.
Высокое значение скрытой теплоты плавления льда также обеспечивает стабильность температурного режима на планете.
Одно из интересных свойств воды заключается в том, что ее наименьшая энергия приходится на 37 ºС, это означает, что при данной температуре необходимы минимальные энергетические затраты для ее изменения. Поэтому температура тела теплокровных существ близка к этому значению.
Если бы вода не обладала аномальными значениями температуры кипения и температуры замерзания, то процессы застывания и кипения происходили бы при более низких температурах, и вода в жидком виде стала бы невозможной для планеты Земля.
Оптические свойства воды.
Свет от поверхности воды частично отражается, на границе раздела «воздух – вода» преломляется, а в толще воды рассеивается и поглощается, следовательно, в результате – ослабляется.
Коэффициент отражения (…) зависит от степени освещенности и состояния водной поверхности (…..) и составляет от 1 до 14 % от величины падающего света.
Коэффициент преломления на границе раздела воздух – вода равен 1,33 – 1,34. Он несколько уменьшается с ростом температуры и увеличивается с увеличением солености.
Закономерности распределения света в воде.
Вода пропускает видимую часть
электромагнитного спектра с длиной
волны
![]() от 0,38 до 0,77 мкм лучше, чем более
коротковолновое или длинноволновое
излучение.
от 0,38 до 0,77 мкм лучше, чем более
коротковолновое или длинноволновое
излучение.
Свет распространяется в воде на небольшое расстояние. Интенсивность света быстро затухает в воде по экспоненциальному закону:
![]() ,
где
,
где
![]() - интенсивность света соответственно
на глубине h и на поверхности;
- интенсивность света соответственно
на глубине h и на поверхности;
k – коэффициент рассеяния света;
m – коэффициент поглощения света;
(k + m) – коэффициент ослабления света.
В чистой воде на глубине 1м интенсивность
составляет 90%, на глубине 2м – 81%, 3м –
73%, 100м – 1%. Главную роль в ослаблении
света в воде принадлежит поглощению,
доля рассеяния значительно меньше и
имеет максимальное значение при
![]() =0,42
– 0,44мкм.
=0,42
– 0,44мкм.
Рассеяние очень быстро уменьшается с ростом или уменьшением длины волны. Установлено, что в чистой пресной воде рассеяние равно 16%, в морской воде – 21%. Наличие растворенных и, особенно, взвешенных частиц в воде резко увеличивает коэффициент поглощения и коэффициент рассеяния света в воде. Наибольшее проникновение света в воду и, соответственно, минимум коэффициента ослабления света сдвигается в сторону больших значений длин волн. Солнечный свет, таким образом, проникает на небольшую глубину, где и происходят процессы фотосинтеза.
Акустические свойства.
Вода хорошо проводит звук. В толще воды звук может при некоторых условиях распространятся на большие расстояния и с большой скоростью. Скорость распространения звука в воде равна 1400 – 1600 м/с, т.е. в 4 – 5 раз больше скорости распространения звука в воздухе. С ростом температуры скорость распространения звука увеличивается на 3 – 3,5 м/с на каждый градус. С ростом солености скорость распространения звука растет на 1,0 – 1,3 м/с на одну промилле. С ростом давления скорость распространения звука увеличивается. Последнее означает, что с ростом глубины при прочих равных условиях скорость распространения звука увеличивается почти на 1,5 – 1,8 м/с на каждые 100 метров. Скорость распространения звука в воде зависит от определенных факторов согласно формуле Вильсона:
![]() (1), где
(1), где
![]() - скорость распространения звука при
температуре, равной 0ºС, солености - 0‰,
давлении – 1 атм., равная 1449,14 м/с;
- скорость распространения звука при
температуре, равной 0ºС, солености - 0‰,
давлении – 1 атм., равная 1449,14 м/с;
![]() - положительные по знаку приращения
скорости звука, вызванные увеличением
соответственно температуры, солености
и давления;
- положительные по знаку приращения
скорости звука, вызванные увеличением
соответственно температуры, солености
и давления;
![]() - суммарная поправка, учитывающая
особенности внешних факторов воздействия,
исключающих температуру, соленость и
давление.
- суммарная поправка, учитывающая
особенности внешних факторов воздействия,
исключающих температуру, соленость и
давление.
Электропроводность воды.
Химически чистая вода – диэлектрик. Удельная электропроводность такой воды равна 3,8·10 -6 Ом/м при 18 ºС. Электропроводность не сильно увеличивается с ростом температуры и очень сильно с ростом минерализации. У морской воды электропроводность равна 4 – 6 Ом/м, больше, чем у речной. Электропроводность несколько увеличивается с увеличение давления, поэтому на глубине больше 10 км электропроводность воды примерно на 12% больше, чем в поверхностном слое. Изменения солевого состава воды влечет изменение ее электропроводности даже при неизменной общей минерализации (присутствие в растворе ионов хлора и калия влияет на электропроводность значительно больше, чем присутствие таких ионов, как сульфат ионы, ионы кальция и магния).
Зависимость плотности воды от температуры, минерализации и давления.
С ростом солености (или минерализации) плотность воды увеличивается. Увеличение солености приводит к уменьшению температуры наибольшей плотности.
Некоторое влияние на плотность оказывает давление, но т.к. сжимаемость воды мала, но на большой глубине все же сказывается. На каждые 100 м глубины плотность, вследствие влияния давления, возрастает на 4,5 – 4,9 кг/м3, поэтому на глубине приблизительно 11 км плотность почти на 48 кг/м3 больше, чем на поверхности. И при солености, равной 35‰ составляет 1,076 г/см3. Если бы вода была абсолютно несжимаема, уровень Мирового океана был бы на 30 м выше. Малая сжимаемость воды позволяет существенно упрощать гидродинамические характеристики движения природных вод.
Зависимость температуры застывания и температуры наивысшей плотности воды от солености.
Совместное влияние температуры и солености на плотность воды при атмосферном давлении выражают с помощью уравнения состояния морской воды:
![]()
Т – температура, [ºС],
S – соленость, ‰,
![]() - плотность воды при температуре 0 ºС и
солености 0‰,
- плотность воды при температуре 0 ºС и
солености 0‰,
![]() - параметры, зависящие от особенностей
внешних условий какого-либо объекта
гидросферы.
- параметры, зависящие от особенностей
внешних условий какого-либо объекта
гидросферы.
Увеличение солености приводит к понижению температуры наибольшей плотности воды согласно формуле:
![]() (3),где
(3),где
s – соленость, ‰.
Увеличение солености воды на каждые 10‰ уменьшает температуру наибольшей плотности почти на 2 градуса исходя из формулы (3). Зависимость температуры наибольшей плотности и температуры застывания от солености воды хорошо иллюстрируется графиком Хасанда-Хансена (на рис.1 кривая 1 – кривая зависимости температуры замерзания от солености, кривая 2 – кривая зависимости температуры наибольшей плотности воды от солености).
Соотношение между температурой наибольшей плотности и температурой замерзания воды влияет на характер процесса охлаждения воды и вертикальной конвекции. Охлаждение воды в результате теплообмена с водоемом в зимнее или ночное время приводит к повышению ее плотности и, соответственно, опусканию более плотной воды вниз, и на ее место поднимаются более теплые (менее плотные) воды. Происходит процесс плотностной конвекции, однако, только для пресных и солоноватых вод, имеющих соленость, равную 24,7‰. Процесс плотностной конвекции в таких водах продолжается до момента остужения воды до температуры наибольшей плотности. На кривой 2 в точке пересечения кривых (А) соответствует температура наибольшей плотности, равная -1,3 ºС при солености 24,7‰. Дальнейшее охлаждение воды ведет к уменьшению ее плотности и вертикальная конвекция прекращается. Соленые воды с соленостью s = 24,7‰ подвергаются вертикальной конвекции вплоть до кривой замерзания 1, точке А соответствует значение температуры, равное -1,3 ºС, то в пресных или солоноватых водах зимой в придонных горизонтах температура воды выше температуры замерзания. Это обстоятельство имеет большое значение для сохранения жизни на больших глубинах.
Фазовая диаграмма воды. Диаграмма состояний воды в области низких давлнений.
Как известно, вода существует на Земле в жидкой состоянии в океанах, реках, морях, в газообразном состоянии – в атмосфере и в твердом состоянии в виде ледников и снежных покровов. В природе постоянно происходит переход….
Фазовые переходы….
Кривая, описывающая фазовые превращения воды в зависимости от давления и температуры называется фазовой диаграммой воды.
Фазовые превращения показаны на рис.1., из которого видно, что величина энтальпии испарения и плавления больше нуля, т.е. процесс идет с поглощением энергии (эндотермический процесс), а энтальпия конденсации и затвердевания меньше нуля (экзотермический процесс)
Согласно закону Гесса, полная энтальпия
![]() любого циклического процесса равна
нулю, следует, что теплоты конденсации
и затвердевания имеют такую же величину
как теплоты испарения и плавления, но
противоположные по знаку.
любого циклического процесса равна
нулю, следует, что теплоты конденсации
и затвердевания имеют такую же величину
как теплоты испарения и плавления, но
противоположные по знаку.
Как можно описать равновесие между различными фазами в зависимости от температуры и давления? Для этого изучается состав вещества, переход его из одного состояния в другое при длительном нагревании. При этом (нагревании) температура его увеличивается до тех пор, пока не происходит фазовое превращение (твердое – жидкое), все то время, пока вещество плавится или кипит температура этого вещества остается постоянной.
На рис.1. показана кривая нагревания воды при постоянной скорости нагревания. Углы наклона прямых АВ, CD, EF к горизонтальной прямой зависят от теплоемкости соответственно льда (2,092 Дж/ºС∙г), жидкой воды (4,184 Дж/ºС∙г) и водяного пара (1,841 Дж/ºС∙г). Длина участков ВС и DЕ определяется теплотой плавления (6,02 кДж/моль) и теплотой испарения (40,67 кДж/моль). Кривую АВСDЕF называют кривой нагревания, если при нагревании вещества его температура увеличивается, следовательно, поступающая в него энергия преобразуется в средне кинетическую энергию частиц. В процессе плавления или кипения она постоянна, т.к. поступающая в него энергия преобразуется на преодаление сил притяжения между частицами, т.е. она затрачивается на увеличение потенциальной энергии системы.
На рис.2. представлена фазовая диаграмма воды, на которой представлены условия равновесия между различными фазами вещества. Диаграмма (рис.2.) – фазовая диаграмма воды, на ней указаны нормальные температуры плавления, кипения и тройная точка (D). Масштаб по осям координат выдержан недостаточно точно, в действительности тройная точка должна почти совпадать с горизонтальной осью, т.к. она соответствует температуре, незначительно превышающей 0 ºС. Условия равновесия между фазами достигаются только вдоль линий, разграничивающих соответственно площади твердой, жидкой и газообразной фаз воды.
Жидкая и паровая фаза воды находятся в равновесии в точке А (р = 0,57 атм., t = 85 ºС).
Линия СD соответствует давлению паров воды над поверхность жидкой воды, а линия DE – над поверхностью льда. Линия ВD соответствует таким сочетаниям температуры и давления паров воды при которых жидкая вода находится в равновесии со льдом.
Температура плавления льда аномально понижается с ростом давления, т.е. это значит, что линия ВD, поднимаясь вверх, отклоняется (одновременно с ростом давления) влево. У большинства других веществ естественный наклон вправо.
Точка D соответствует единственной на диаграмме совокупности условий температура – давление, при которых все три фазы воды находятся в равновесии друг с другом. Тройной точке воды соответствует температура t = 0,0098 ºС и р = 0,006 атм. (4,58 мм рт ст.).
Площади, ограниченные линиями равновесия определяют твердое, жидкое и газообразное состояния воды и соответствуют условиям, при которых существует какая-то одна из фаз (при р = 0,5 атм. и t = 60 ºС вода жидкая).
Точка В соответствует температуре плавления льда при внешнем давлении, равном 1 атм. (0 ºС).
Точка С соответствует нормальной температуре кипения (р = 1 атм.).
Условие t = 85 ºС и давлении больше 0,5 атм. – по диаграмме вода существует в газообразной фазе, и когда давление равняется 0,50 атм. (в точке А), водяные пары конденсируются и между жидкой и газообразной фазами устанавливается равновесие. Давление паров при данной температуре не больше 0, 57 атм., если мы будем повышать давление на равновесную смесь паров и жидкости, вся паровая фаза превратится в жидкую. При дальнейшем росте давления, оно будет действовать на жидкую фазу, если давление постоянно и равняется 0,50 атм., а температура повышается от -10 до 70 ºС, при -10 ºС вода твердая, при t = 0,005 ºС лед начинает плавиться и между твердой и жидкой фазами установится равновесие. При более высокой температуре вода будет существовать в жидкой фазе, до t = 85 ºС, при температуре, большей 85 ºС – пар.
Таким образом, если давление составляет 1 атм. в соответствие с фазовой диаграммой температура кипения воды 100 ºС. При увеличении давления в 2 раза вода закипает при 120 ºС, а при уменьшении в 2 раза – при 81 ºС. Как видно зависимость нелинейная. Однако, при уменьшении давления температура плавления льда аномально возрастает. Удивительная зависимость значения давления и температуры атмосферы сложилась на Земле, т.к. именно при этих значениях вода присутствует на планете во все трех фазах, обеспечивая развитие всех существующих форм жизни. При этих параметрах происходит растворение в воде кислорода, необходимого для жизни водных организмов, а также для протекания процессов самоочищения воды. На протяжении многих тысячелетий наличие атмосферы, гидросферы и солнечного излучения на Земле создавало условия незначительного перепада температур летом и зимой, днем и ночью, обеспечивая условия для существования жизни.
Кислотно-основное равновесие в природных водоемах.
В соответствие с соблюдением …..растворов поверхностных вод выполняется следующее равенство:
![]() с – эквивалентные концентрации ионов.
с – эквивалентные концентрации ионов.
При отсутствии процессов растворения
и образования новых фаз ионы натрия,
калия, кальция, хлорид и сульфат ионы
не будут оказывать влияние на рН
образовавшихся растворов. Кислотно-основное
растворение будет определяться
присутствием ионов
![]() поэтому для большинства природных вод
концентрация ионов водорода определяется
содержанием
поэтому для большинства природных вод
концентрация ионов водорода определяется
содержанием
![]() В этих растворах при рН = 7 будет соблюдаться
следующее равенство:
В этих растворах при рН = 7 будет соблюдаться
следующее равенство:
![]()
Карбонатная система и рН атмосферных осадков.
В контакте с водой углекислый газ растворяется до образования угольной кислоты, и эта реакция обратима:

последний процесс описывается константой
диссоциации по первой ступени
![]() ,
т.к. концентрация растворенного
углекислого газа в воде мала и составляет
0,036 моль/л, то следует использовать при
расчете
,
т.к. концентрация растворенного
углекислого газа в воде мала и составляет
0,036 моль/л, то следует использовать при
расчете![]() ,
активные концентрации исходных
компонентов и продуктов реакции
диссоциации.
,
активные концентрации исходных
компонентов и продуктов реакции
диссоциации.
 (5)
(5)

если известна сумма активностей карбонатов и рН раствора, всегда можно вычислить активность каждого из компонентов карбонатной системы.
Карбонатная система описана уравнением (2). Для определения этих активностей удобно использовать распределительную диаграмму, которая представляет собой зависимость содержания в мольных долях компонентов карбонатной системы от величины рН раствора.
Метод построения распределительной
диаграммы. Для построения диаграммы
необходимо вывести выражение для расчета
долей каждого из компонентов карбонатной
системы (![]() )
при указанном значении концентрации
ионов водорода, при этом основной расчет
связан с определением долей в следующих
ключевых точках распределительной
диаграммы:
)
при указанном значении концентрации
ионов водорода, при этом основной расчет
связан с определением долей в следующих
ключевых точках распределительной
диаграммы:
1.
![]()
2.
![]()
3.
![]()
4.
![]()
5.
![]()
Решение. Для каждого компонента карбонатной системы есть отношение концентрации компонента к сумме концентраций всех компонентов в системе.
![]()
![]()
![]() .
.
Для упрощения системы примем величины
активностей а = 1, тогда из соответствующих
![]() и
и
![]() получим:
получим:




Подставим (4) в (3):

Воспользуемся формулами 3 – 5 для выражения суммарной концентрации всех компонентов системы:


Объединив (4) и (6), определим доли каждого компонента, подставив в формулы определения долей:
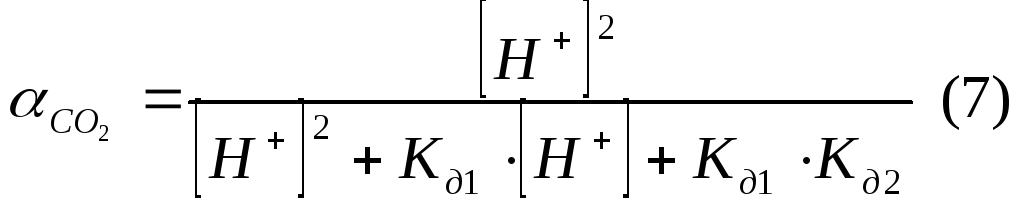
![]()

![]()

![]()
![]()
|
|
рН |
|
|
|
|
|
<< 6,35 |
1,0 |
0 |
0 |
|
|
6,35 |
0,50 |
0,50 |
0 |
|
|
8,34 |
0,01 |
0,98 |
0,01 |
|
|
10,33 |
0 |
0,50 |
0,50 |
|
|
>>10,33 |
0 |
0 |
1,0 |
В зависимости от значения рН в системе (воды поверхностного водоема) определяется стадия закисления водоема:
Первая стадия закисления определяется для системы, в которой общая уменьшается примерно в 10 раз, до величины 0,1 ммоль/л. При этом процесс снижения щелочности является кратковременным, и система возвращается к естественным условиям с рН = 6,5 – 8,5.
Вторая стадия характеризуется понижением значения рН до уровней меньше 5,5, и это значение сохраняется в течение всего года.
Третья стадия характеризуется значением рН< 5,5 (обычно рН = 4,5), и это значение сохраняется длительное время.
Если система доводится до первой стадии, а также частично до второй, то такая система может стабилизироваться за счет гумусовых веществ и соединений алюминия, и тогда процесс закисления полностью оформляется и переходит четко во вторую стадию.
