
- •Вода как химическое соединение. Классификация воды по способу взаимосвязи ее с различными веществами.
- •Химические свойства воды.
- •Водородная связь.
- •Химико-технологическая характеристика природных вод.
- •Способность воды к растворению.
- •Факторы, влияющие на формирование состава природных вод.
- •Классификация природных поверхностных вод.
- •Физические основы гидрохимических процессов.
- •Круговорот воды на Земном шаре.
- •Коллигативные свойства водных растворов.
Химико-технологическая характеристика природных вод.
Понятие стабильной и агрессивной воды.
По химическому составу примеси в природной воде подразделяются на органические и неорганические.
Органические имеют очень сложный состав и находятся в коллоидном или истинном состоянии.
Неорганические примеси находятся, в
основном, в виде ионов:
![]() .
.
В воде, кроме того, растворены различные
газы:![]() и т.д.
и т.д.
В воде содержатся карбонаты, при этом
часть карбонатов гидролизуется, в
результате образуется сложная система,
включающая такие анионы как,
![]() а также молекулу воды и
а также молекулу воды и![]() .
Если рассмотреть систему, включающую
все эти ионы, то выглядеть она будет в
виде ряда равновесных процессов:
.
Если рассмотреть систему, включающую
все эти ионы, то выглядеть она будет в
виде ряда равновесных процессов:
![]()
Обе эти ступени обеспечивают систему
![]() и
т.д.
и
т.д.
При повышении рН равновесие сдвигается
в сторону образования![]() ,
и наоборот, при уменьшении рН равновесие
смещается в строну образования угольной
кислоты. Последний процесс имеет место
при рН<6.
,
и наоборот, при уменьшении рН равновесие
смещается в строну образования угольной
кислоты. Последний процесс имеет место
при рН<6.
Вода, в которой
![]() находятся в равновесии, называется
стабильной водой.
находятся в равновесии, называется
стабильной водой.
При сдвиге равновесия в сторону
образования
![]() ,
вода становится агрессивной, при этом
увеличивается ее коррозионная способность.
Повышение рН, влияющее на сдвиг равновесия
в сторону образования карбонат ионов,
приводит к тому, что из воды начинают
выделяться карбонаты различных металлов,
в первую очередь
,
вода становится агрессивной, при этом
увеличивается ее коррозионная способность.
Повышение рН, влияющее на сдвиг равновесия
в сторону образования карбонат ионов,
приводит к тому, что из воды начинают
выделяться карбонаты различных металлов,
в первую очередь
![]() .
Нестабильная вода может быть либо
агрессивной, либо превращаться из
гомогенной в гетерогенную систему.
.
Нестабильная вода может быть либо
агрессивной, либо превращаться из
гомогенной в гетерогенную систему.
Жесткость воды.
Жесткость воды отражает содержание в ней ионов кальция и магния, она выражается в ммоль экв./л и определяется как сумма эквивалентов ионов кальция и магния. Из всех солей относящихся к солям жесткости, выделяют гидрокарбонаты, сульфаты и хлориды. Содержание других растворимых солей кальция и магния в природных водах очень мало. Жесткость, придаваемая воде гидрокарбонатами, называется гидрокарбонатной или временной, т.к. гидрокарбонаты при кипячении воды(точнее при температуре более 60С)разлагаются с образованием малорастворимых карбонатов:
СаНСО3-СаСО3+Н2О+СО2
В природных условиях эта реакция обратима, однако при выходе на поверхность подземных вод, обладающих значительной временной жесткость, равновесие сдвигается в сторону образования СО2, который удаляется в атмосферу. Этот процесс приводит к разложению гидрокарбонатов и выпадению в осадок СаСО3 и MgCO3. Таким путем образуется разновидности карбонатных пород, называемые известняковыми туфами. В присутствии в воде растворенного СО2 протекает и обратная реакция. Так происходит растворение карбонатных пород в природных условиях.
Жесткость, обусловленная хлоридами или сульфатами, называется постоянной, поскольку эти соли устойчивы при нагревании и кипячении воды. Суммарная жесткость воды, т.е. общее содержание растворимых солей кальция и магния , получила название общей жесткости.
Т.к.солями жесткости являются соли разных катионов, имеющие разную молекулярную массу, жесткость воды измеряют в единицах эквивалентной концентрации, моль*экв/л или моль*экв/л. При жесткости до 4 моль*экв/л вода считается мягкой, Ж от 4-8 моль*экв/л средней жесткости ; Ж 8 – 12 моль*экв/л жесткая; Ж >12 моль*экв/л-очень жесткой.
В среднем, жесткость речной воды равна
1 – 6, ПДК (питьевая вода)![]() .
.
Щелочность воды.
Щелочность обусловлена присутствием в воде веществ, содержащих гидроксо-анион, а также веществ, реагирующих с сильными кислотами (соляной, серной). К таким соединениям относятся:
• сильные щелочи (КОН, NаОН) и летучие основания (NН4ОН). а также анионы, обуславливающие высокую щелочность в результате гидролиза в водном растворе при рН > 8,4 (СО32-, S2-, РО42-)
* слабые основания и анионы летучих и нелетучих слабых кислот (НСО3, Н2РО4 , НРО42-, СНзСОО, анионы гуминовых кислот ) .
Щелочность пробы воды измеряется в моль-экв/л или ммоль-экв/л и определяется количеством сильной кислоты (обычно используют соляную кислоту с концентрацией 0,01 или 0,1 моль-экв/л), израсходованной на нейтрализацию раствора.
При нейтрализации до значения рН 8,0-8,2 в качестве индикатора используют фенолфталеин. Определяемая таким образом ве-личина называется свободной щелочностью. При нейтрализации до «качений рН 4,2-4,5 в качестве индикатора применяют метиловый оранжевый. Установленная по этому индикатору величина называется общей щелочностью. При рН = 4,5 проба воды имеет нулевую щелочность.
Щелочность природных вод в силу их контакта с атмосферным воздухом и известняками обусловлена, главным образом, содержанием в них гидрокарбонатов и карбонатов, которые вносят значительный вклад в минерализацию воды. Соединения первой группы могут содержаться также в сточных и поверхностных загрязненных водах.
Щ=[HCO3-]+[ CO3-]+[OH-]
Солесодержание.
Солесодержание – характеристика воды, которая определяется общей концентрацией солей.
Состав природных вод зависит от их вида и расположения водоема (источника воды). Воды рек имеют невысокое содержание (0,5 – 0,6 г/л), более высокое содержание имеют подземные воды. Содержание в морях и океанах примерно одинаково и составляет 35 г/л. Главными компонентами, обеспечивающими солевой состав, являются натрий и хлор. Содержание солей во внутренних морях меньше, чем в океанах и открытых морях (в Каспийском: 3 – 13 г/л, в Черном: 7 -18 г/л).
Кислотность
Кислотность воды обусловлена содержанием в воде веществ. реагирующих с гидроксо-анионами. К таким соединениям относятся:
1) сильные кислоты - НС1, НNО3, Н2SО4;
2) слабые кислоты -СНзСООН, Н2SО3, Н2СО3, Н2S и т.п.;
3) катионы слабых оснований - МН/, катионы органических аммонийных соединений.
Кислотность пробы воды измеряется в моль-экв/л или в ммоль-экв/л и определяется количеством сильной щелочи (обычно используют растворы КОН или NаОН с концентрацией 0.05 или 0.1 моль-экв/л/
Кислотность (перманганатную и бихроматную) определяет содержание примесей, способных взаимодействовать с окислителями, т.е. определяет восстановительный потенциал.
Биохимическое потребление кислорода (БПК).
Определяет расход кислорода на разложение органических веществ путем окисления бактериями, использующими эти вещества в метаболизме. Определяется БПК по изменению концентрации кислорода в воде до и после ее выдержки в темноте в течение пяти суток при 20ºС – БПК5. Определяют также БПК полное.
По БПК судят о степени загрязнении воды.
Вода с БПК до 30 мг/л – практически чистая;
С БПК=30 – 80 мг/л – слабозагрязненная;
С БПК>80 – сильнозагрязненная.
Хлорность воды.
В воде открытого океана независимо от абсолютной концентрации количественное соотношение между главными компонентами основного солевого состава постоянно (закон Дигмера). Эта зависимость……
Среди катионов:
Na+ >Mg2+ >Ca 2+ ≥ другие катионы
Среди анионов:
C l->
![]() >
Br-≥ другие анионы.
>
Br-≥ другие анионы.
Благодаря закону Дигмера можно определить
экспериментально концентрацию одного
«рейперного» компонента, рассчитать
содержание остальных. В качестве такого
рейперного компонента выбрана достаточно
легкоопределяемая величина – хлорность,
т.е. число граммов ионов хлора, эквивалентное
сумме ионов галогенов, осаждаемых
нитратом серебра (![]() ),
содержащееся в одном килограмме воды.
Единицей измерения хлорности является
промилле (‰).
),
содержащееся в одном килограмме воды.
Единицей измерения хлорности является
промилле (‰).
Агрессивность воды.
Показатель агрессивности природных вод отражает способность природной воды перевести вещество в раствор:
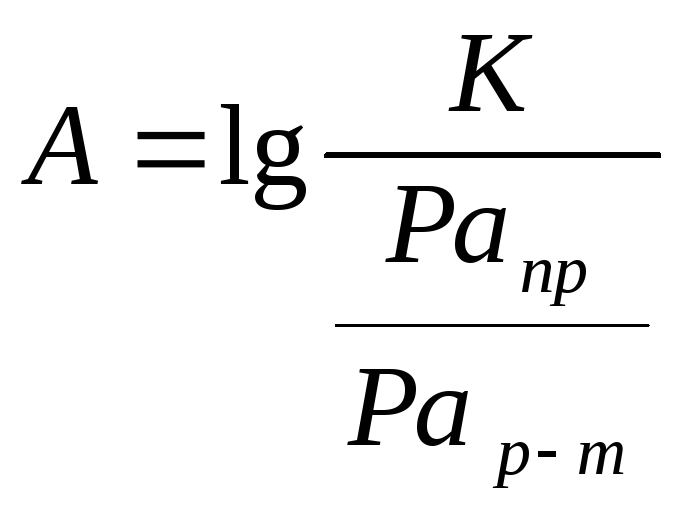
![]() ,
где
,
где
А – показатель агрессивности воды;
К – константа растворения данного вещества;
Ра – произведение активностей продуктов реакции, содержащихся в воде, и реагентов, содержащихся в растворяемом веществе, соответственно.
Показатель агрессивности часто используют для сравнения растворяющей способности природных вод. Чем больше показатель, тем в большей степени система неравновесна и тем более интенсивно протекает процесс растворения данного вещества.
Показатель неустойчивости.
Степень удаленности системы от состояния равновесия характеризуется показателем неустойчивости. Этот показатель удобно использовать при сравнении устойчивости различных твердых веществ по отношению к одной и той же природной воде. Чем больше показатель, тем данное вещество менее устойчиво. Показатель неустойчивости обратно пропорционален показателю агрессивности (I=1/A).
