
- •Федеральное агентство по образованию
- •Экологическая химия
- •Введение: предмет экологической химии, задачи экологической химии
- •1Основные понятия и определения
- •1.1 Загрязнение окружающей среды. Химическое загрязнение. Вредные вещества.
- •1.2 Предельно допустимые концентрации вредных веществ
- •2.1.1. Пдк вредных веществ в атмосфере
- •1.2.2 Пдк вредных веществ в водной среде
- •1.2.3Пдк вредных веществ в почве
- •1.3.2 Распространение в ос
- •1.3.3 Время жизни (устойчивость) загрязнителя
- •1.3.4 Склонность загрязнителя к деградации (биоразложению)
- •1.4 Термодинамический и кинетический подходы к изучению поведения загрязнителей в ос
- •1) Определять возможность самопроизвольного протекания химических реакций в том или ином направлении;
- •2) Определять условия, при которых устанавливается химическое равновесие.
- •При низких давлениях газы можно считать идеальными, и Ka ≈ Kp.
- •1) Рассчитать время достижения заданной степени превращения веществ (или опре- делить степень превращения вещества в заданный момент времени),
- •2) Найти условия, при которых время достижения заданной степени превращения ве- щества будет минимальным.
- •2. Физико-химические процессы в атмосфере
- •2.1 Состав и строение атмосферы
- •Qисточник и Qсток – скорости поступления и стока веществ соответственно для произвольного резервуара, атмосферы в целом или ее части;
- •2.1.1 Основные зоны атмосферы
- •2.1.2 Атмосферное давление
- •2.1.3 Солнечная радиация и вертикальная структура атмосферы
- •2.1.4 Тепловой баланс атмосферы и подстилающей ее поверхности
- •Процессы окисления примесей в тропосфере могут протекать:
- •1.3.4. Фотохимический смог в городской атмосфере
- •1.3.6Метан
- •В присутствии no общий результат окисления метана:
- •1.3.7.1 Номенклатура и особенности тропосферного аэрозоля
- •1.3.7.2 Время жизни (устойчивость) аэрозоля
- •Водородный цикл
- •Азотный цикл
- •Хлорный цикл
- •Физико-химические процессы в гидросфере
- •3. Биогенные вещества – главным образом соединения азота и фосфора. К биогенным элементам относят также соединения кремния и железа.
- •2.2. Классификация природных вод
- •1) Физико-географические (рельеф, климат…);
- •2.3.2 Процессы растворения твердых веществ в природныхводах
- •2.4 Кислотно-основное равновесие в природных водоемах
- •2.4.2 Растворимость карбонатов и рН подземных и поверхностных природных вод
- •2.5.1 Окислительно_восстановительное равновесие
- •2.5.2 Взаимосвязь между окислительно-восстановительны-ми и кислотно-основными характеристиками природных вод
- •2.6 Процессы самоочищения водных экосистем
- •2.6.1 Виды загрязнений и каналы самоочищения водной среды
- •2.6.3 Физико-химические процессы на границе разделафаз
- •1) В качестве окислителя участвуют ионы металлов в окисленной форме;
- •2) В окислении зв участвуют свободные радикалы и другие реакционноспособные частицы.
- •1) Рекомбинация и диспропорционирование
- •3) Присоединение по кратной связи
- •3 Физико-химические процессы в почвах
- •3.1 Гипергенез и почвообразование
- •3.3 Элементный и фазовый состав почв
- •3.4 Оганические вещества почвы
- •3.4.1 Классификация органических веществ почвы
- •3.5.2 Обменные катионы почв
- •3.7 Соединения азота в почве
- •3.6 Проблемы загрязнения почвенных экосистем
- •3.6.1 Проблема применения минеральных удобрений
- •3.6.2 Проблемы применения химическх средств защиты растений
- •3.6.3 Поведение пестицидов в ос
2.4 Кислотно-основное равновесие в природных водоемах
В соответствии с необходимостью соблюдения электронейтральности растворов в природных поверхностных водах выполняется равенство:
[Na+] + [K+] + 2[Ca2+] + 2[Mg2+] + [H+] = [Cl-] + [HCO3-] + 2[CO32-] + 2[SO32-] (98)
при отсутствии процессов растворения и образования новых фаз ионы Na+,K+,Ca2+,Cl-, SO42-не будут оказывать влияние на рН образующихся растворов. Кислотно-основное равновесие будет определяться присутствием ионов НСО3-и СО32-. Поэтому для большинства природных вод концентрация ионов водорода определяется содержанием гидрокарбонат- и карбонат- ионов. В этих растворах при рН=7 будет соблюдаться равенство:
[H+]![]() [HCO3-] + 2[CO32-]
+ [OH-]. (99)
[HCO3-] + 2[CO32-]
+ [OH-]. (99)
В этой связи изучению равновесий, возникающих в так называемой карбонатной системе следует уделять особое внимание.
КАРБОНАТНАЯ СИСТЕМА И рН АТМОСФЕРНЫХ ОСАДКОВ
Неорганические соединения углерода, находящиеся в природных водах в виде производных угольной кислоты, взаимосвязаны друг с другом и образуют карбонатную систему.
В контакте с водой диоксид углерода растворяется до наступления равновесия:
СО2 (г)![]() СО2 (р-р)+ Н2О
СО2 (р-р)+ Н2О![]() Н2СО3(83)
Н2СО3(83)
Угольная кислота диссоциирует по первой ступени с образованием ионов водорода и НСО3-- ионов:
Н2СО3
![]() Н+
+ НСО3-
(100)
Н+
+ НСО3-
(100)
Константа равновесия этого процесса равна:
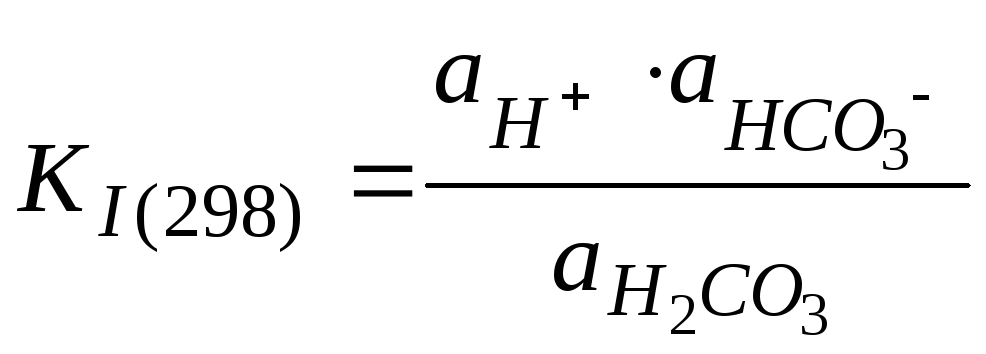 = 4,45·10-7.
(101)
= 4,45·10-7.
(101)
Диссоциация угольной кислоты во второй ступени протекает значительно слабее и приводит к появлению СО32-- ионов:
НСО3-![]() СО32-+ Н+.
(102)
СО32-+ Н+.
(102)
Константа диссоциации угольной кислоты по второй ступени имеет вид:
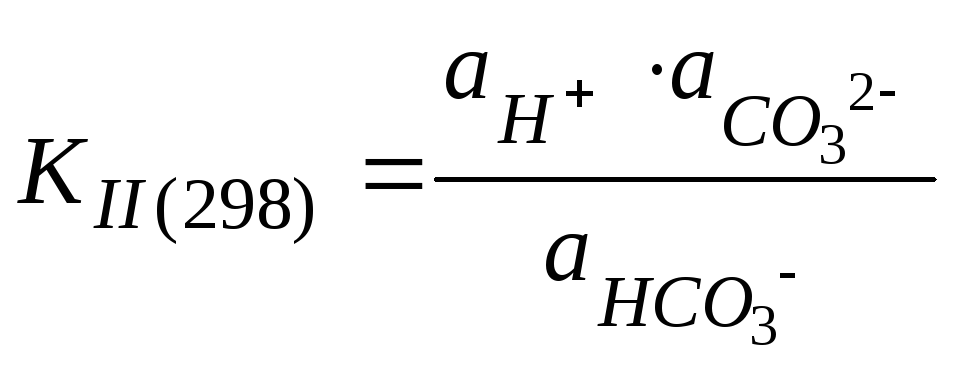 = 4,69·10-11.
(103)
= 4,69·10-11.
(103)
Если известна суммарная активность карбонатов и рН раствора, всегда можно вычислить активность каждого из компонентов карбонатной системы. Для ориентировочных расчетов удобно использовать распределительную диаграмму, которая представляет собой зависимость содержания в мольных долях компонентов карбонатной системы от величины рН раствора (рис.16).
Долей соответствующего компонента в карбонатной системе является отношение концентрации компонента к суммарной концентрации компонентов данной системы в растворе:
![]() ,
,
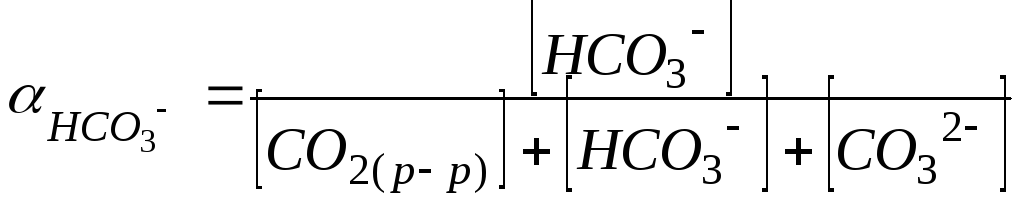 ,
,
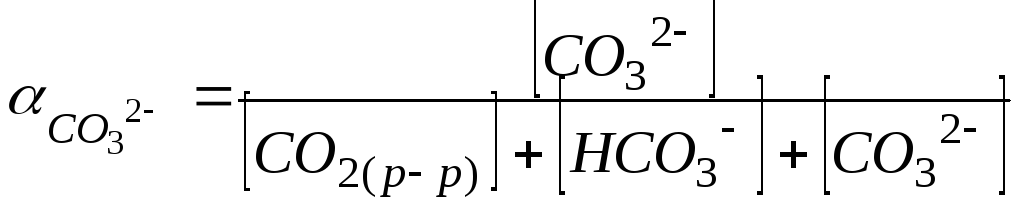 .
.
Для получения уравнений, связывающих долю соответствующего компонента карбонатной системы и величину рН раствора, воспользуемся уравнениями (99), (100) и (102).
При диссоциации Н2СО3по первой ступени (100) [H+]=[HCO3-]. Поскольку рассматриваемый раствор имеет низкую концентрацию ионов, можно принять, что коэффициенты активности ионов Н+и НСО3-равны единице. Поэтому и активности ионов будут равны между собой, а выражение (101) можно представить в виде:
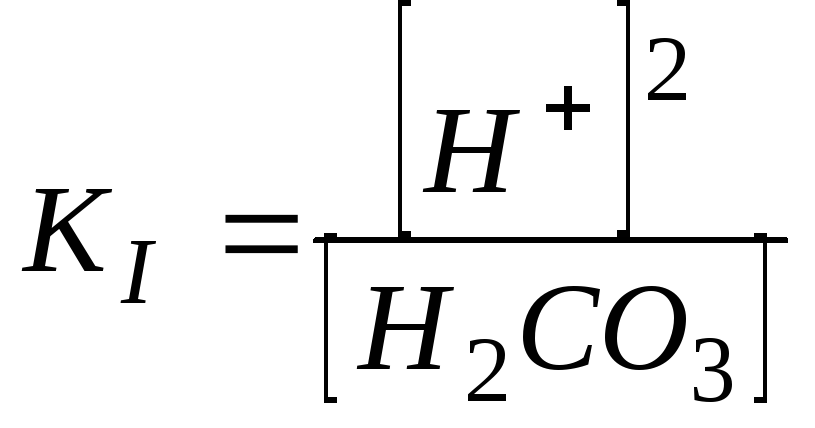 .
(104)
.
(104)
Учитывая малую долю недиссоциированной угольной кислоты в растворе (не более 1% суммы концентраций СО2+Н2СО3) и значительные трудности разделения этих двух составляющих при экспериментальном определении их концентраций в растворе, под концентрацией Н2СО3обычно подразумевают концентрацию растворенного диоксида углерода, которая в соответствии с законом Генри равна:
![]() .
.
Учитывая это, уравнение (104) можно представить в виде:
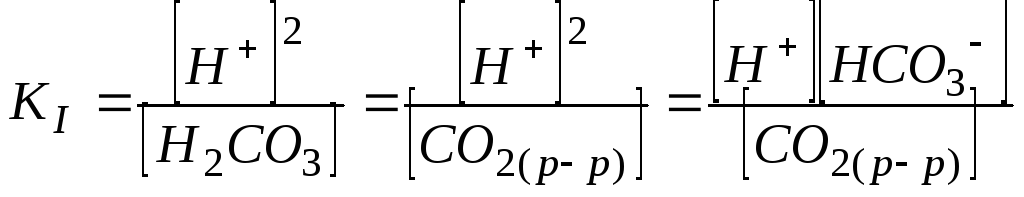 ,
(105)
,
(105)
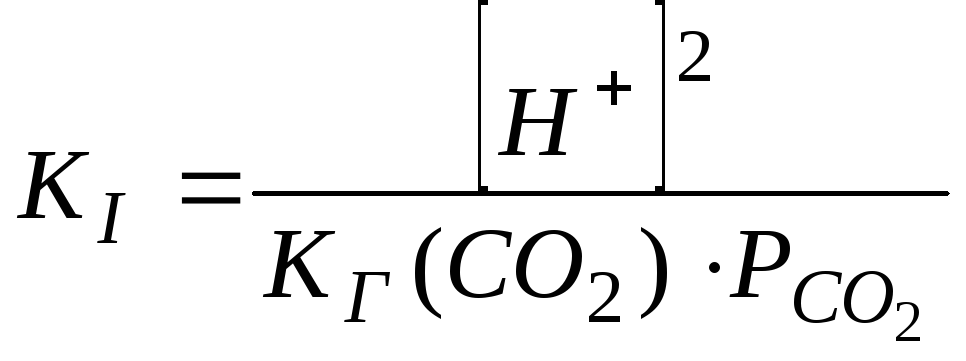 .
(106)
.
(106)
Из уравнения (106) можно легко вывести зависимость концентрации ионов водорода в растворе от парциального давления СО2в атмосферном воздухе (см.далее). Выразим из (105) концентрацию СО2в растворе.
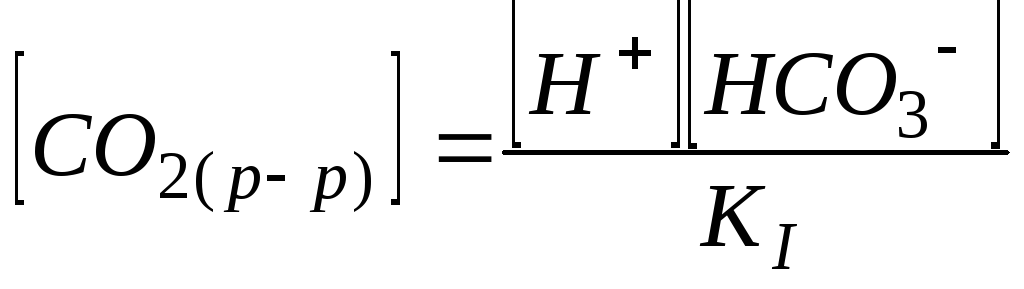 .
(107)
.
(107)
Поскольку в рассматриваемых условиях (аi=[ci])
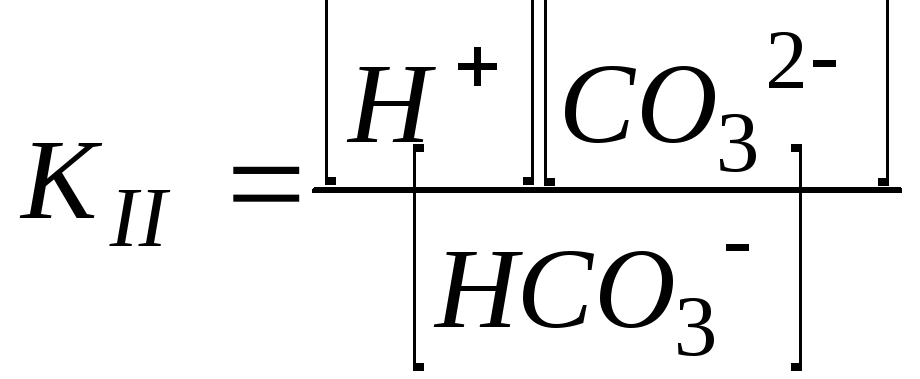 ,
то
,
то
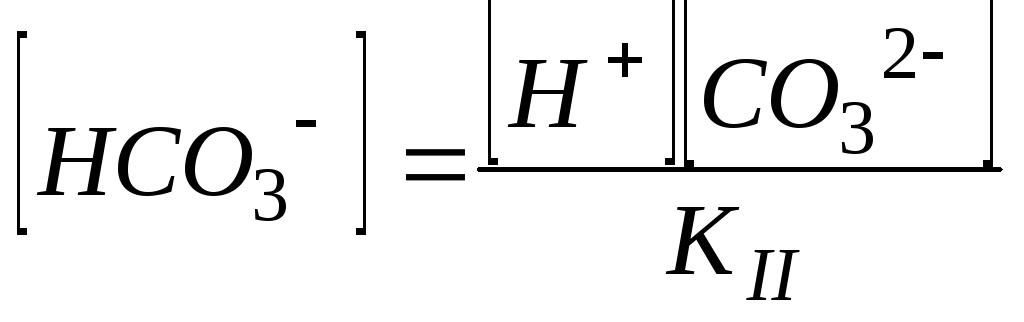 .
(108)
.
(108)
Подставим выражение (108) в уравнение (107), получим:
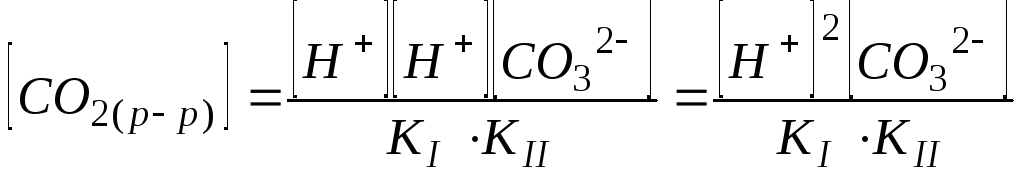 .
(109)
.
(109)
Воспользуемся уравнениями (108) и (109) для выражения суммы концентраций всех компонентов системы:
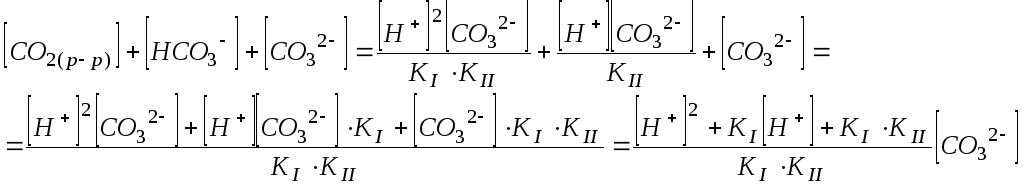 (110)
(110)
Подставив уравнения (108)-(110) в выражения, определяющие доли соответствующих компонентов в системе, получим зависимости, связывающие доли компонентов со значениями констант диссоциации и концентрацией ионов Н+в растворе.
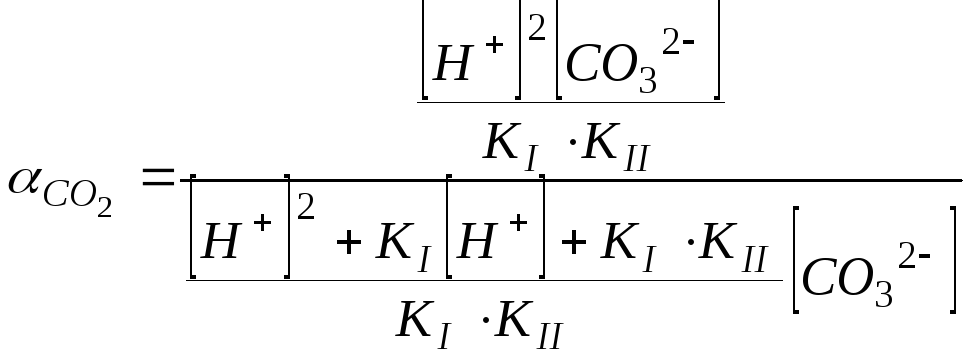 ,
,
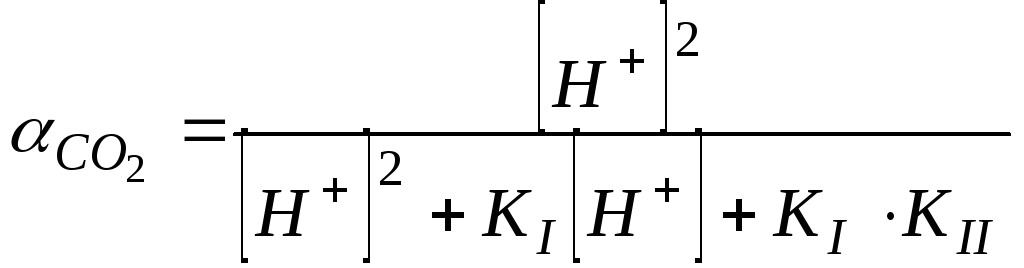 .
(111)
.
(111)
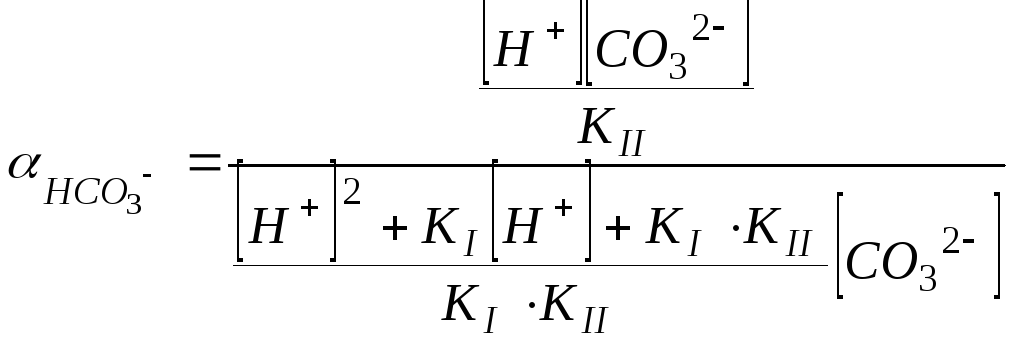 ,
,
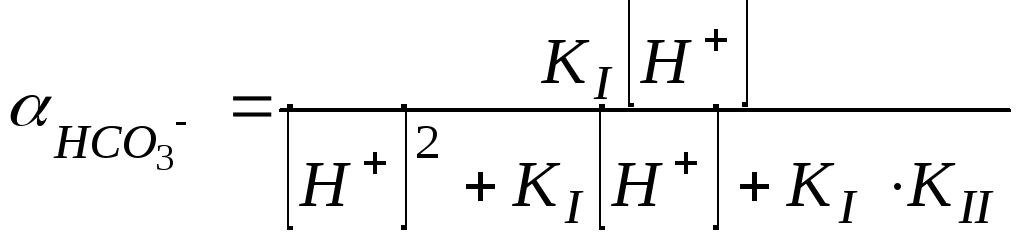 .
(112)
.
(112)
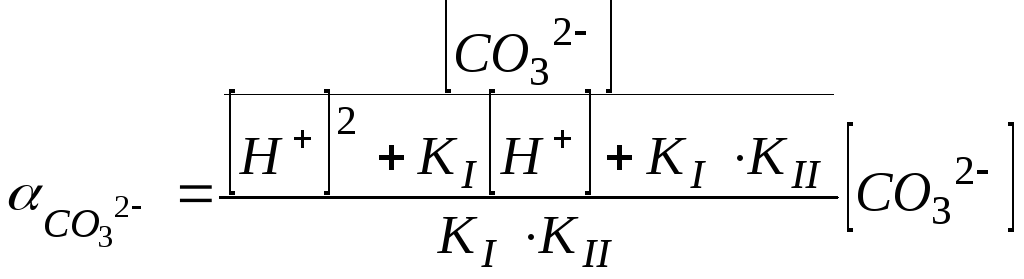 ,
,
![]() .
(113)
.
(113)
Уравнения (111) и (112) позволяют, подставляя
соответствующие значения [H+] (или
рН), вычислить или, учитывая, что КI>>KII,
оценить значения![]() при рН, соответствующих «ключевым»
точкам распределительной диаграммы.
Полученные значения долей компонентов
карбонатной системы представлены ниже
(табл.12).
при рН, соответствующих «ключевым»
точкам распределительной диаграммы.
Полученные значения долей компонентов
карбонатной системы представлены ниже
(табл.12).
Таблица 12 – Значения долей компонентов карбонатной системы в ключевых точках распределительной диаграммы
|
[H+] |
рН |
|
|
|
|
>>KI KI (KI·KII)1/2 KII <<KII |
<<6,35 6,35 8,34 10,33 >>10,33 |
1,00 0,50 0,01 0 0 |
0 0,50 0,98 0,50 0 |
0 0 0,01 0,50 1,00 |
Данные таблицы интерпретированы в виде графиков на распределительной диаграмме.
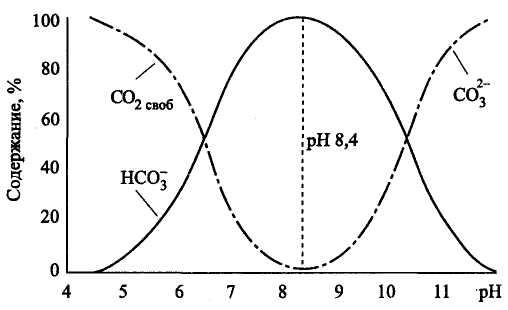
Рис. 16 – Зависимость содержания отдельных компонентов карбонатной системы от рН раствора (распределительная диаграмма)
Анализ уравнений (99)-(103), описывающих процесс растворения СО2в воде, позволяет вывести уравнение зависимости концентрации ионов водорода в растворе от парциального давления СО2в воздухе.
Константа диссоциации угольной кислоты по второй ступени на 4 порядка меньше, чем константа диссоциации по первой ступени, поэтому при оценке влияния Н2СО3на значение рН атмосферных осадков процесс диссоциации по второй ступени можно не принимать во внимание.
Из уравнения (106):
![]() ,
,
![]() ,
(114)
,
(114)
![]() .
(115)
.
(115)
Оценки, проведенные для растворов, образующихся при контакте с водой воздуха, содержащего 0,035%(об.) СО2и не содержащего других кислых газов, показывают, что рН образующегося раствора будет равен ~5,7.
![]() .
.
Поскольку такое содержание диоксида углерода отвечает средним значениям, характерным в последнее время для атмосферного воздуха, следует ожидать значение рН = 5,7 атмосферных осадков в случае отсутствия других кислых газов и NH3. В реальных условиях рН атмосферных осадков зависит от степени загрязнения атмосферы и изменяется как в большую, так и в меньшую сторону.
В некоторых районах Земли в настоящее время выпадают преимущественно осадки с рН<5,7. Такие осадки называют кислотными, часто употребляя термин «кислотные дожди».Основной вклад в кислотность таких осадков вносят соединения серы (до 80%), около 15% приходится на соединения азота и до 5% кислотности атмосферных осадков связывают с соединениями хлора.
