
- •Федеральное агентство по образованию
- •Экологическая химия
- •Введение: предмет экологической химии, задачи экологической химии
- •1Основные понятия и определения
- •1.1 Загрязнение окружающей среды. Химическое загрязнение. Вредные вещества.
- •1.2 Предельно допустимые концентрации вредных веществ
- •2.1.1. Пдк вредных веществ в атмосфере
- •1.2.2 Пдк вредных веществ в водной среде
- •1.2.3Пдк вредных веществ в почве
- •1.3.2 Распространение в ос
- •1.3.3 Время жизни (устойчивость) загрязнителя
- •1.3.4 Склонность загрязнителя к деградации (биоразложению)
- •1.4 Термодинамический и кинетический подходы к изучению поведения загрязнителей в ос
- •1) Определять возможность самопроизвольного протекания химических реакций в том или ином направлении;
- •2) Определять условия, при которых устанавливается химическое равновесие.
- •При низких давлениях газы можно считать идеальными, и Ka ≈ Kp.
- •1) Рассчитать время достижения заданной степени превращения веществ (или опре- делить степень превращения вещества в заданный момент времени),
- •2) Найти условия, при которых время достижения заданной степени превращения ве- щества будет минимальным.
- •2. Физико-химические процессы в атмосфере
- •2.1 Состав и строение атмосферы
- •Qисточник и Qсток – скорости поступления и стока веществ соответственно для произвольного резервуара, атмосферы в целом или ее части;
- •2.1.1 Основные зоны атмосферы
- •2.1.2 Атмосферное давление
- •2.1.3 Солнечная радиация и вертикальная структура атмосферы
- •2.1.4 Тепловой баланс атмосферы и подстилающей ее поверхности
- •Процессы окисления примесей в тропосфере могут протекать:
- •1.3.4. Фотохимический смог в городской атмосфере
- •1.3.6Метан
- •В присутствии no общий результат окисления метана:
- •1.3.7.1 Номенклатура и особенности тропосферного аэрозоля
- •1.3.7.2 Время жизни (устойчивость) аэрозоля
- •Водородный цикл
- •Азотный цикл
- •Хлорный цикл
- •Физико-химические процессы в гидросфере
- •3. Биогенные вещества – главным образом соединения азота и фосфора. К биогенным элементам относят также соединения кремния и железа.
- •2.2. Классификация природных вод
- •1) Физико-географические (рельеф, климат…);
- •2.3.2 Процессы растворения твердых веществ в природныхводах
- •2.4 Кислотно-основное равновесие в природных водоемах
- •2.4.2 Растворимость карбонатов и рН подземных и поверхностных природных вод
- •2.5.1 Окислительно_восстановительное равновесие
- •2.5.2 Взаимосвязь между окислительно-восстановительны-ми и кислотно-основными характеристиками природных вод
- •2.6 Процессы самоочищения водных экосистем
- •2.6.1 Виды загрязнений и каналы самоочищения водной среды
- •2.6.3 Физико-химические процессы на границе разделафаз
- •1) В качестве окислителя участвуют ионы металлов в окисленной форме;
- •2) В окислении зв участвуют свободные радикалы и другие реакционноспособные частицы.
- •1) Рекомбинация и диспропорционирование
- •3) Присоединение по кратной связи
- •3 Физико-химические процессы в почвах
- •3.1 Гипергенез и почвообразование
- •3.3 Элементный и фазовый состав почв
- •3.4 Оганические вещества почвы
- •3.4.1 Классификация органических веществ почвы
- •3.5.2 Обменные катионы почв
- •3.7 Соединения азота в почве
- •3.6 Проблемы загрязнения почвенных экосистем
- •3.6.1 Проблема применения минеральных удобрений
- •3.6.2 Проблемы применения химическх средств защиты растений
- •3.6.3 Поведение пестицидов в ос
2.3.2 Процессы растворения твердых веществ в природныхводах
Для описания процессов взаимодействия между твердыми веществами и природными водами в настоящее время широко используются методы равновесной термодинамики. В общем виде такое взаимодействие можно представить уравнением:
аА + вВ
![]() сС + dD.
сС + dD.
Термодинамическая константа этого процесса определяется выражением:
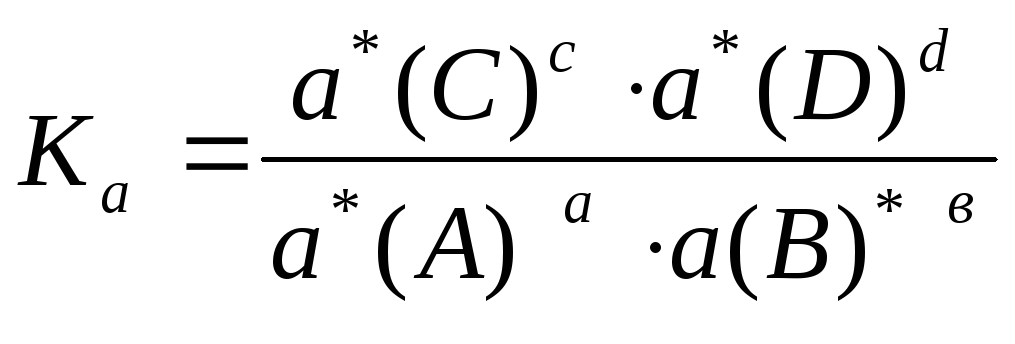 ,
,
где а*i– равновесные активности реагентов.
Численное значение Каопределяют по термодинамическим данным (85).
Значение константы равновесия при температуре, отличающейся от 298 К можно вычислить по уравнению изобары химической реакции в интегральной форме:
![]() (86).
(86).
При этом допускаем, что тепловой эффект
процесса растворения
![]() Н
не зависит от температуры.
Н
не зависит от температуры.
Важными характеристиками природных вод и твердых веществ при рассмотрении процессов растворимости являются часто используемые в зарубежной литературе показатели агрессивности и неустойчивости.
Показатель агрессивностиприродных вод характеризует способность данной воды перевести твердое вещество в раствор.
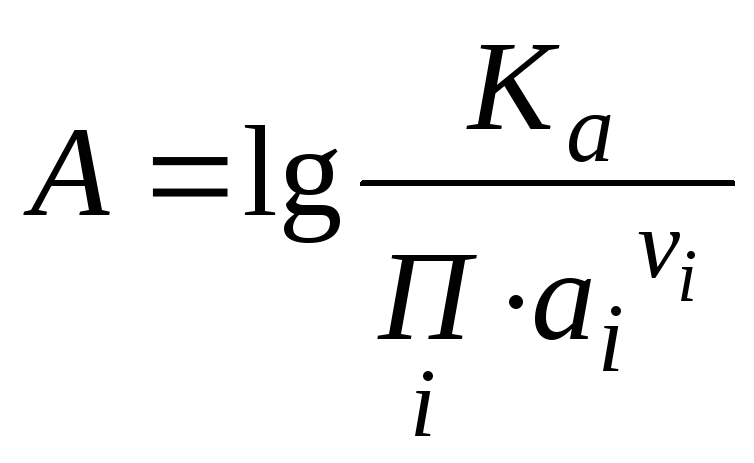 ,где
,где![]() (87)
(87)
В значение Кавходят равновесное
активности, в значение![]() - активности реагентов, содержащихся в
данной воде.
- активности реагентов, содержащихся в
данной воде.
Показатель агрессивности часто используют для сравнения растворяющей способности природных вод. Чем больше А, тем в большей степени система неравновесна и тем более интенсивно протекает процесс растворения данного вещества.
Показатель неустойчивостихарактеризует степень удаленности системы от состояния равновесия. Этот показатель удобно использовать при сравнении устойчивости различных твердых веществ по отношению к одной и той же природной воде. Чем больше значение показателя неустойчивости, тем менее устойчиво данное вещество.
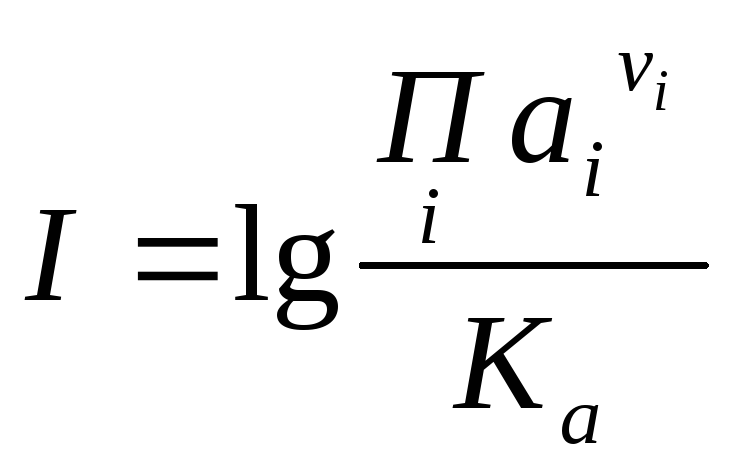 (88)
(88)
Т.е. показатель неустойчивости численно равен показателю агрессивности, взятому с обратным знаком
I = -А
Достаточно часто в природных условиях растворяется чистое твердое вещество (а = 1). В этом случае в водном растворе содержатся только ионы, на которые оно диссоциирует, и молекулы Н2О, и описание процесса упрощается. Уравнение процесса растворения в этом случае:
АаВв→аАв+ + вВа-
Ка =
![]() (89)
(89)
Для определения процесса растворения или осаждения в этом случае удобно использовать показатель степени неравновесности:
![]() ,
(90)
,
(90)
где Θ – степень неравновесности,
![]() - произведение активности ионов в
растворе (ПА)прод.
- произведение активности ионов в
растворе (ПА)прод.
Степень неравновесности характеризует ненасыщенность (Θ<1, идет процесс растворения) или пересыщенность (Θ>1, идет процесс осаждения) раствора. В случае, если Θ=1, в системе наблюдается равновесие между твердой и жидкой фазами.
Активности реагентов связаны с их концентрациями:
аi = γi ∙ сi, (91)
где γi– коэффициент активностиi-го компонента раствора.
В бесконечно разбавленных растворах
γi→1 и аi![]() сi.
Поэтому для оценки концентрации примесей
в растворах часто используют произведение
растворимости, которое для процесса
(89) будет иметь вид:
сi.
Поэтому для оценки концентрации примесей
в растворах часто используют произведение
растворимости, которое для процесса
(89) будет иметь вид:
ПР = ![]() ,
(92)
,
(92)
где САи СВ– концентрации ионов в растворе, моль/л.
Произведение растворимости и Касвязаны между собой:
ПР=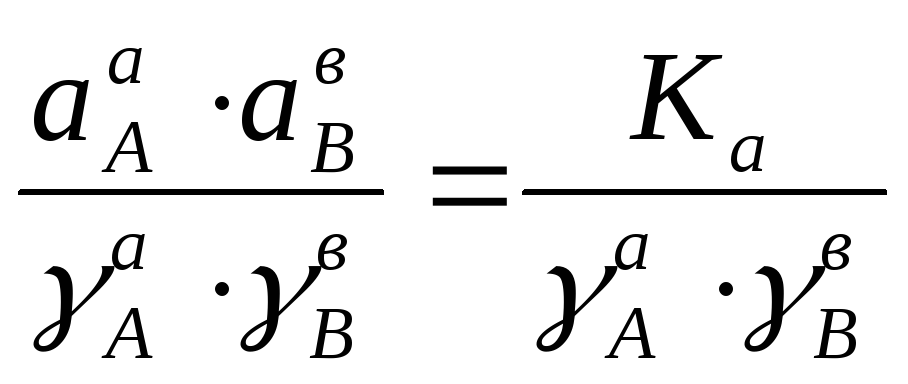 ,
(93)
,
(93)
где γАиγВ– коэффициенты активности соответствующих ионов.
Значения коэффициентов активности ионов можно рассчитать по уравнению Дебая-Хюккеля:
![]()
![]() ,
еслиI<0,01 (94) или
,
еслиI<0,01 (94) или
 ,
если 0,01<I<0,1 (95)
,
если 0,01<I<0,1 (95)
I– ионная сила раствора, которая равна
![]() ,
(96)
,
(96)
где сi– концентрации ионов, присутствующих в растворе;Zi– заряды соответствующих ионов.
Уравнения (94) и (95) приведены для водных растворов при Т=298 К.
ЖЕСТКОСТЬ ПРИРОДНЫХ ВОД
Одной из важных характеристик природных вод во многом определяющих возможности их использования человеком, является жесткость воды. Жесткостью воды называется свойство воды, обусловленное содержанием в ней ионов Са2+ и Mg2+.Единицей жесткости в нашей стране является моль (жесткости) на 1 м3– моль/м3или мэкв/л.
1 мэкв/л соответствует содержанию в воде 20,04 мг/л ионов Са2+или 12,16 мг/лMg2+. Величину жесткости определяют по уравнению:
Ж
= ![]() ,
(97)
,
(97)
где Ж – жесткость воды, мэкв/л;
![]() и
и![]() - концентрации ионов кальция и магния
в мг/г; 20,04 мг/экв – миллиэквивалент
Са2+; 12,16 мг/экв – миллиэквивалентMg2+.
- концентрации ионов кальция и магния
в мг/г; 20,04 мг/экв – миллиэквивалент
Са2+; 12,16 мг/экв – миллиэквивалентMg2+.
Определяемую по уравнению (96) жесткость называют общей жесткостью воды.
Различают карбонатную, некарбонатную, устраняемую (временную) и неустраняемую (постоянную) жесткость воды.
Под карбонатной жесткостью понимают концентрацию ионов Са2+ и Mg2+, связанных с карбонат- и гидрокарбонат-ионами.Поэтому численное значение карбонатной жесткости равно сумме концентраций СО32-и НСО3-, выраженных в мэкв/л. Если эта величина больше общей жесткости, т. е. СО32-и НСО3-связаны с другими катионами, то значение карбонатной жесткости принимается равным значению общей жесткости воды.
Некарбонатная жесткость воды определяется как разность значений общей и карбонатной жесткости.
Устраняемая (временная) жесткость представляет собой часть карбонатной жесткости, которая удаляется при кипячении воды.Устраняемую жесткость определяют экспериментально.
Неустраняемая жесткость определяется как разность общей и устраняемой жесткости.
По величине общей жесткости природные воды принято делить на ряд групп (табл. 11). Среди природных вод наиболее мягкими являются дождевые, Ж=0,07-0,1 мэкв/л. Жесткость подземных вод меняется в широких пределах от 0,7 мэкв/л (грунтовые воды Карелии) до 18-20 мэкв/л (грунтовые воды Донбасса) – и зависит от состава контактирующих с ними пород.
Таблица 11 – Классификация природных вод по величине жесткости
-
Жесткость, мэкв/л
Группа воды
<1,5
1,5-3,0
3,0-5,4
5,4-10,7
>10,7
Очень мягкая
Мягкая
Средней жесткости
Жесткая
Очень жесткая
