
- •I. Численные методы интегрирования
- •1.1. Интегрирование методом левых прямоугольников
- •1.2. Интегрирование методом правых прямоугольников
- •1.3. Интегрирование методом средних прямоугольников
- •1.4. Интегрирование методом Эйлера
- •1.5. Интегрирование методом Симпсона
- •1.6. Интегрирование методом Монте-Карло
- •II. Численное решение нелинейных уравнений
- •2.1. Метод последовательных приближений (Метод простых итераций)
- •2.2. Метод деления отрезка пополам (Метод дихотомии)
- •2.3. Метод Секущих
- •2.4. Метод касательных (Ньютона-Рафсона)
- •III. Решение системы линейных алгебраических уравнений
- •3.1. Решение слау методом Гаусса
- •3.2. Решение слау методом Гаусса-Жордана
- •3.3. Решение слау методом Крамера
- •3.4. Итерационный метод решения системы линейных
- •3.5. Решение системы нелинейных уравнений
- •IV. Приближение нелинейной функции
- •4.1. Приближение линейной функции
- •4.2. Линейная регрессия общего вида
- •4.3. Интерполяция полиномом Лагранжа
- •4.4. Интерполяция с помощью сплайн-функции
- •V. Обыкновенные дифференциальные уравнения
- •5.1. Метод Эйлера решения обыкновенного
- •5.2. Метод Рунге-Кутта четвертого порядка
- •5.3. Методы прогноза и коррекции
- •5.4. Решение систем дифференциальных уравнений
3.3. Решение слау методом Крамера
Метод Крамера, как правило, используется только в теоретических исследованиях для доказательства принципиальной разрешимости исследуемых задач. На практике его не используют из-за низкой скорости работы.
Метод Крамера позволяет решать неоднородную систему n линейных алгебраических уравнений с n неизвестными (3.1).
Процедура поиска корней позволяет найти решение, если определитель основной матрицы коэффициентов A=(aij) не равен нулю. Для нахождения i-го корня ищут определитель, получаемый заменой i-того столбца матрицы А=(aij) на столбец значений правых частей уравнений:
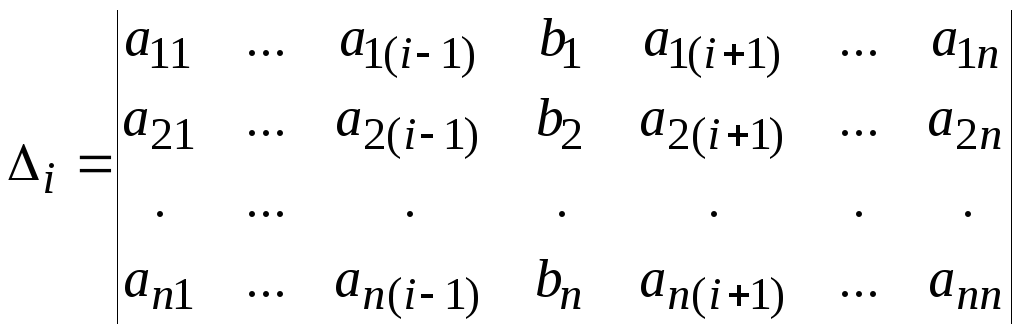 для
всех i
= 1..n.
для
всех i
= 1..n.
Тогда i-тый корень уравнения находят как
![]() и
и 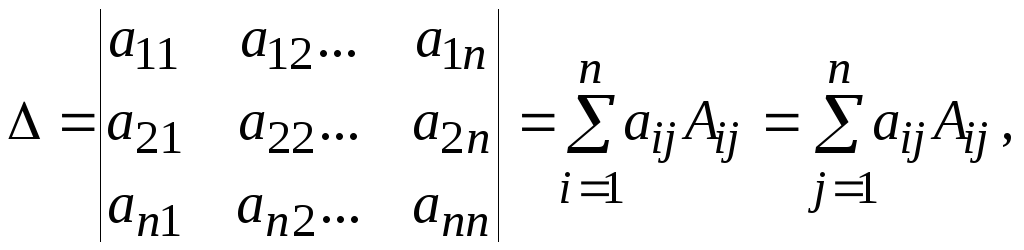
где
![]() ‑ алгебраическое дополнение
aij.
‑ алгебраическое дополнение
aij.
Например, для матрицы размером 33 дополнение элемента a12:
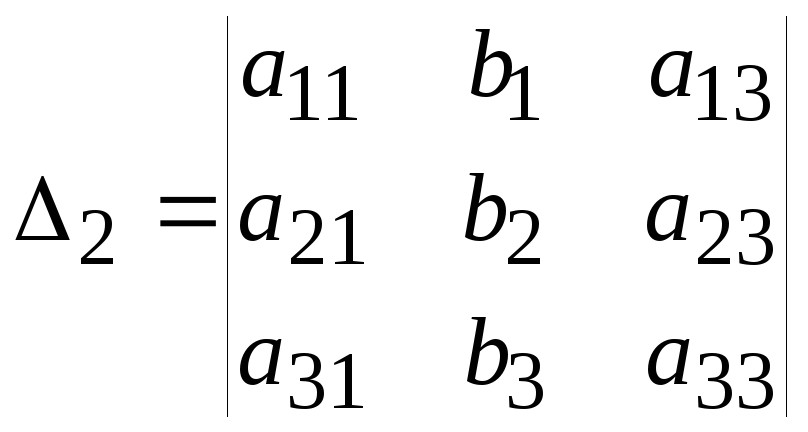 ,
,
а определитель матрицы:
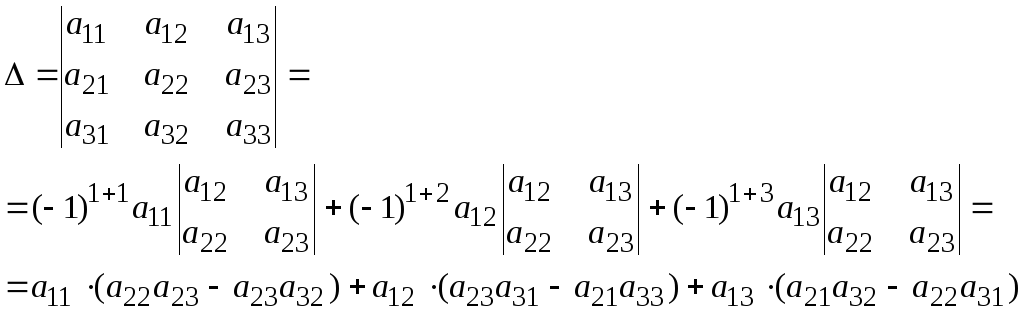 .
.
3.4. Итерационный метод решения системы линейных
алгебраических уравнений (метод Гаусса-Зейделя)
Приведенные выше методы решения СЛАУ носят конечный характер, что является их преимуществом. Однако во многих практических случаях системы уравнений предпочтительно решать итерационными методами, задав необходимую точность решения. Эти методы более удобны в их реализации с помощью вычислительных машин.
Рассмотрим систему из n уравнений c n неизвестными (3.1). По-прежнему полагают, что диагональные коэффициенты не равны нулю.
Задают
начальное приближение решения системы
уравнений:
![]() .
Подставляют эти значения в первое
уравнение и вычисляют первое приближение
первого корня
.
Подставляют эти значения в первое
уравнение и вычисляют первое приближение
первого корня![]() ,
используя нулевые приближения всех
остальных корней. Затем находят первое
приближение всех последующих корней,
используя уже вычисленные первые
приближения предыдущих и нулевые
приближения последующих. Тогдаk-тое
приближение к решению задается формулой
,
используя нулевые приближения всех
остальных корней. Затем находят первое
приближение всех последующих корней,
используя уже вычисленные первые
приближения предыдущих и нулевые
приближения последующих. Тогдаk-тое
приближение к решению задается формулой
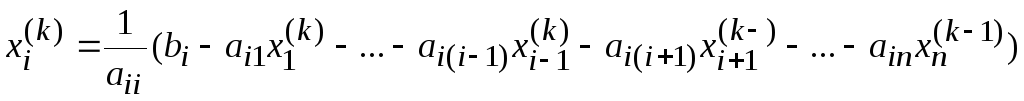 .
.
Итерационный
процесс продолжается до тех пор, пока
все
![]() не станут достаточно близки к
не станут достаточно близки к![]() .
Критерием близости можно, например,
задать условие
.
Критерием близости можно, например,
задать условие![]() или
или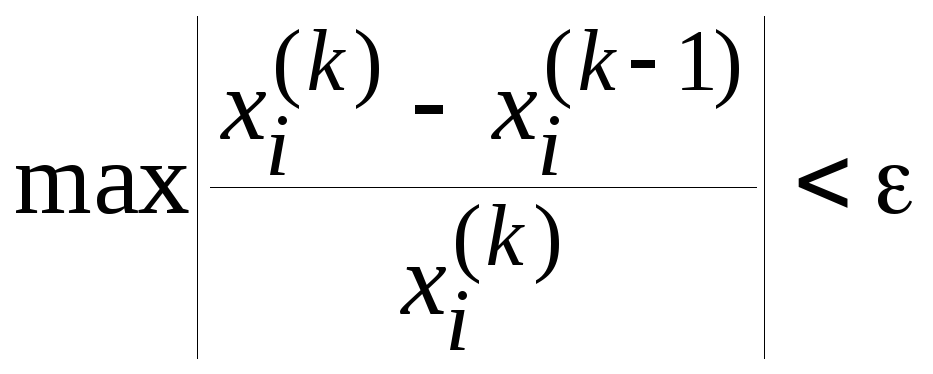 ,
где определяют максимальное значение
разности для всехi.
,
где определяют максимальное значение
разности для всехi.
3.5. Решение системы нелинейных уравнений
При решении ряда задач и описания многих процессов нередко используют системы нелинейных уравнений. Линейные задачи являются частным случаем более сложных нелинейных задач и ее можно разрешить методами, предназначенными для нелинейных задач. Однако в большинстве случаев удобнее использовать методы описанные выше.
Для
решения систем нелинейных уравнений
можно применить метод Ньютона, используемый
для решения к группе итерационных
методов решения нелинейного уравнения
с одним неизвестным. Чтобы найти
приближенное решение уравнения вида
![]() ,
выбирается начальное приближение
,
выбирается начальное приближение![]() ,
которое потом уточняется по следующей
итерационной формуле:
,
которое потом уточняется по следующей
итерационной формуле:![]() .
.
Предполагается, что для системы уравнений вид итерационной формулы сохраняется:
![]() ,
где
,
где 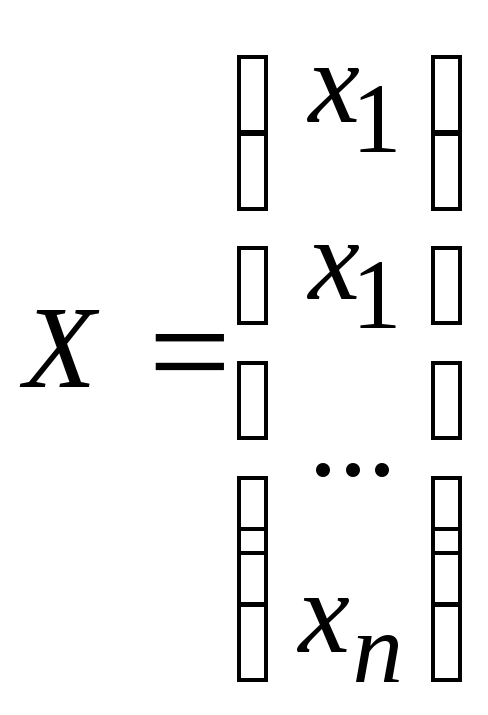 ‑ вектор переменных,
‑ вектор переменных,
 ‑
вектор значений функций,
‑
вектор значений функций,
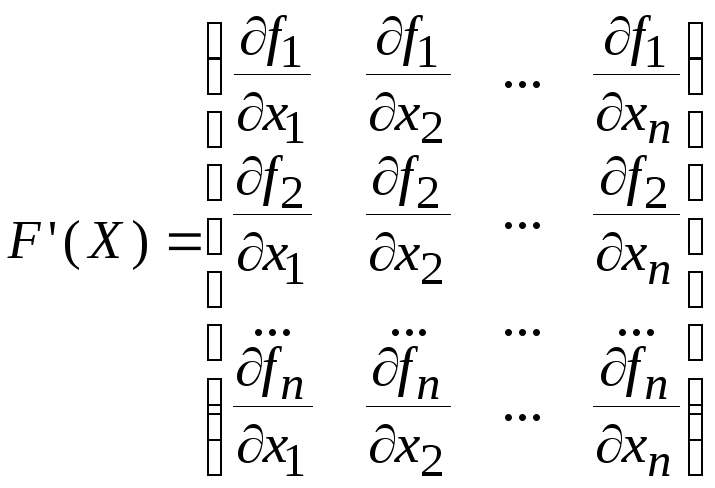 ‑
матрица Якоби,
‑
матрица Якоби,
![]() ‑обращенная
матрица Якоби, которую можно получить
описанным ранее методом Гаусса-Жордана.
В
свою очередь, произведение
‑обращенная
матрица Якоби, которую можно получить
описанным ранее методом Гаусса-Жордана.
В
свою очередь, произведение
![]() находят как произведение двух матрицС = AB
у которых число строк первой равно числу
столбцов второй:
находят как произведение двух матрицС = AB
у которых число строк первой равно числу
столбцов второй:
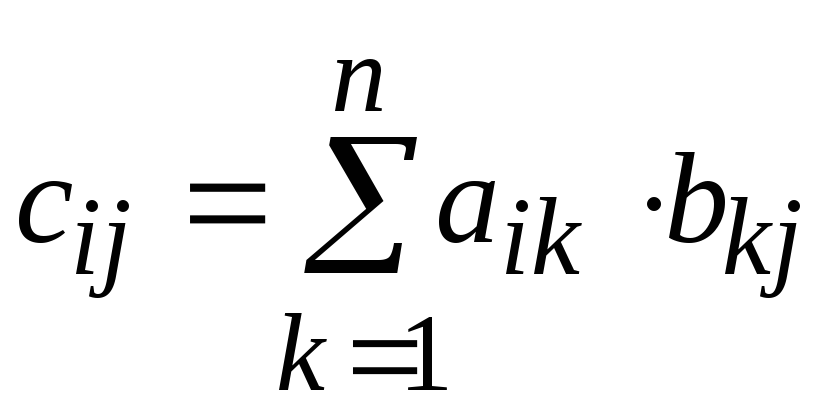 (n
‑ число строк матрицы A
и число столбцов матрицы B).
(n
‑ число строк матрицы A
и число столбцов матрицы B).
ЗАДАНИЯ
Даны нормированные масс-спектры (фиктивные) четырех углеводородов.
|
|
12 |
13 |
14 |
15 |
16 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
|
CH4 |
1 |
3 |
12 |
100 |
25 |
|
|
|
|
|
|
|
|
C2H6 |
|
|
2 |
80 |
|
3 |
4 |
13 |
37 |
24 |
100 |
70 |
|
C2H4 |
4 |
7 |
48 |
13 |
|
2 |
7 |
21 |
18 |
100 |
|
|
|
C2H2 |
5 |
23 |
57 |
2 |
|
40 |
45 |
100 |
|
|
|
|
Даны интенсивности четырех различных смесей этих четырех углеводородов:
|
Высота пика |
Смесь 1 |
Смесь 2 |
Смесь 3 |
Смесь 4 |
|
Масса 14 |
119 |
169 |
326 |
60 |
|
Масса 15 |
195 |
284 |
501 |
113 |
|
Масса 26 |
134 |
168 |
433 |
21 |
|
Масса 28 |
124 |
148 |
124 |
100 |
Исходя из приведенных данных, рассчитайте состав каждой смеси. (В этом задании калибровочные коэффициенты, связывающие интенсивности пиков с концентрациями соответствующих компонентов, также равны 1).
Определить концентрации четырех компонентов смеси помощью закона Бера. Толщину поглощающего слоя принять равной 1,0 см.
|
Длина волны |
Молярный коэффициент поглощения, л/(мольсм) | ||||
|
n-ксилол |
м-ксилол |
о-ксилол |
этил-бензол |
общее поглощение | |
|
12,5 |
1,5020 |
0,0514 |
0 |
0,0408 |
0,10130 |
|
13,0 |
0,0261 |
1,1516 |
0 |
0,0820 |
0,09943 |
|
13,4 |
0,0342 |
0,0355 |
2,5320 |
0,2933 |
0,21940 |
|
14,3 |
0,0340 |
0,0684 |
0 |
0,3470 |
0,03396 |
Для определения концентрации компонентов газовой смеси можно использовать масс-спектроскопию, если наблюдаемая высота пика является линейной функцией парциального давления:
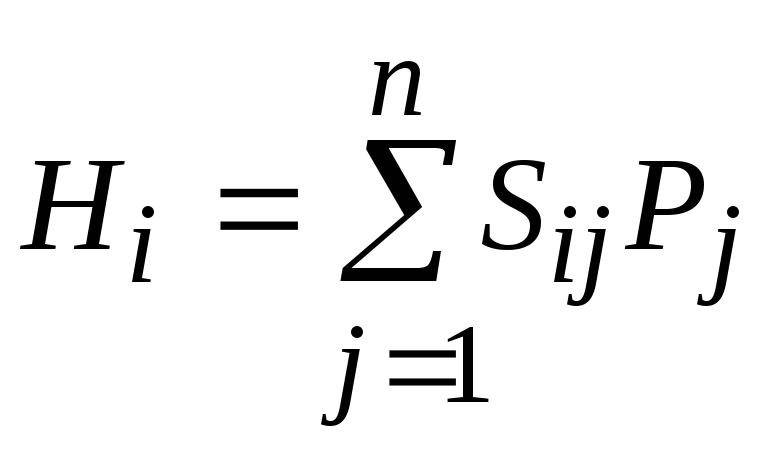 ,
где Hi – наблюдаемая
высота пика, n – число
компонентов, Sij –
чувствительность прибора к j – тому
газу при определенном значении m/e,
измеренная для чистого газа, Pj –
парциальное давление j – того
газа. Рассчитать мольную долю каждого
газа в следующих смесях.
,
где Hi – наблюдаемая
высота пика, n – число
компонентов, Sij –
чувствительность прибора к j – тому
газу при определенном значении m/e,
измеренная для чистого газа, Pj –
парциальное давление j – того
газа. Рассчитать мольную долю каждого
газа в следующих смесях.
а) Смесь углеводородов:
|
m/e |
Чувствительность |
Общая высота пика | |||
|
этилцикло- пентан |
цикло- гексан |
цикло- гептан |
метил- цикло- гексан | ||
|
69 |
121,00 |
22,40 |
27,10 |
23,00 |
87,60 |
|
83 |
9,35 |
4,61 |
20,70 |
100,00 |
58,80 |
|
84 |
1,38 |
74,90 |
1,30 |
6,57 |
47,20 |
|
98 |
20,20 |
0,00 |
32,80 |
43,80 |
100,00 |
б) Смесь водорода и углеводородов:
|
m/e |
Чувствительность |
Общая высота пика | ||||||
|
H2 |
CH4 |
C2H4 |
C2H6 |
C3H6 |
C3H8 |
n-C5H12 | ||
|
2 |
16,87 |
0,165 |
0,202 |
0,317 |
0,234 |
0,182 |
0,110 |
17,1 |
|
16 |
0 |
27,70 |
0,962 |
0,062 |
0,730 |
0,131 |
0,120 |
65,1 |
|
26 |
0 |
0 |
22,35 |
13,05 |
4,420 |
6,001 |
3,043 |
186,0 |
|
30 |
0 |
0 |
0 |
11,28 |
0 |
1,110 |
0,371 |
82,7 |
|
40 |
0 |
0 |
0 |
0 |
9,850 |
1,684 |
2,108 |
84,2 |
|
44 |
0 |
0 |
0 |
0 |
0,299 |
15,98 |
2,107 |
63,7 |
|
72 |
0 |
0 |
0 |
0 |
0 |
0 |
4,670 |
119,7 |
Полное давление в системе равно 3,9910‑2 мм.рт.ст.
Даны четыре емкости с растворами кислоты различной концентрации. Если смешать растворы в определенном соотношении, то получится кислота заданной процентной концентрации:
|
Концентрация конечного раствора, % |
Доля кислоты в общей смеси | |||
|
1, % |
2, % |
3, % |
4, % | |
|
25 |
1 |
1 |
1 |
1 |
|
20 |
4 |
3 |
2 |
1 |
|
25 |
4 |
1 |
1 |
4 |
|
22 |
4 |
1 |
4 |
1 |
Найдите концентрации кислот в каждом сосуде: 1, 2, 3 и 4.
Пусть в некоторой системе одновременно протекают две химические реакции. Они характеризуются выходами U1 и U2. Зависимость выхода, выраженного в %, в достаточно узкой области описывается двумя линейными относительно четырех параметров уравнениями:
U1 = 10 + 1∙C1 ‑ 2∙C2 + 2.0∙pH + 0.5∙(T -300);
U2 = 15 ‑ 1∙C1 ‑ 1∙C2 + 1.2∙pH + 0.9∙(T -300);
T – температура в градусах Кельвина; C1 – концентрация вещества 1, моль/л; C2 ‑ концентрация вещества 2, моль/л.
Найти pH 4 и температуру в градусах Кельвина при C1 = C2 = 2 моль/л, если выходы в этих условиях составляют U1 = 36% и U2 = 51,8%.
Найти мольные доли компонентов раствора (H2SO4, HSO4-, SO42-) для заданного pH и исходной концентрации кислоты, решив систему уравнений. Например, для С0=0,1 и H=2.76.
Диссоциация кислоты по первой ступени H2SO4 H+ + HSO4-
описывается
константой диссоциации: 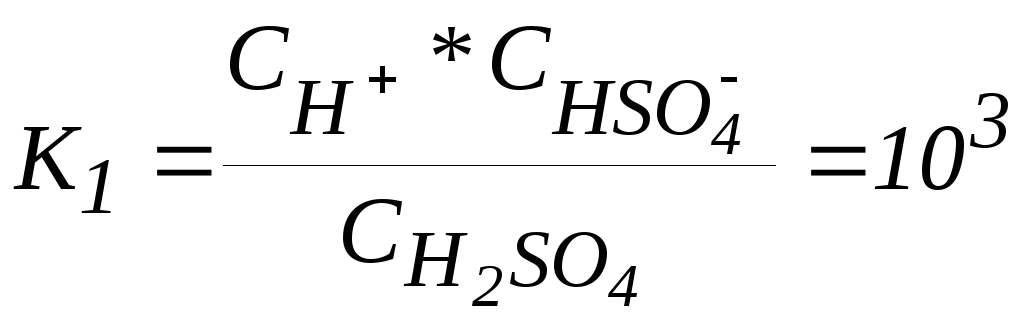 .
.
Диссоциация кислоты по второй ступени HSO4- H+ + SO42-
описывается
константой диссоциации: 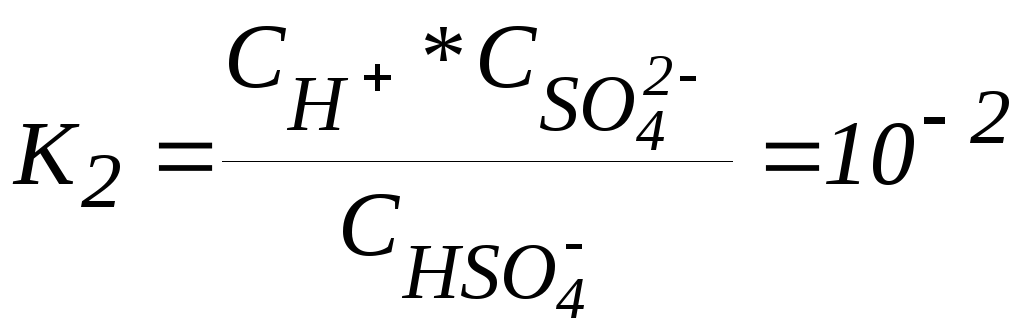 .
.
Уравнение
материального баланса: ![]() .
.
Зависимость температуры плавления бинарной металлической системы от ее состава описывается соотношениями.
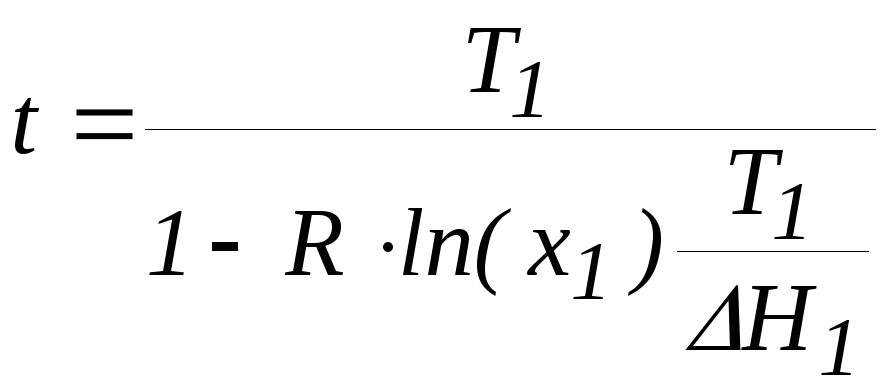
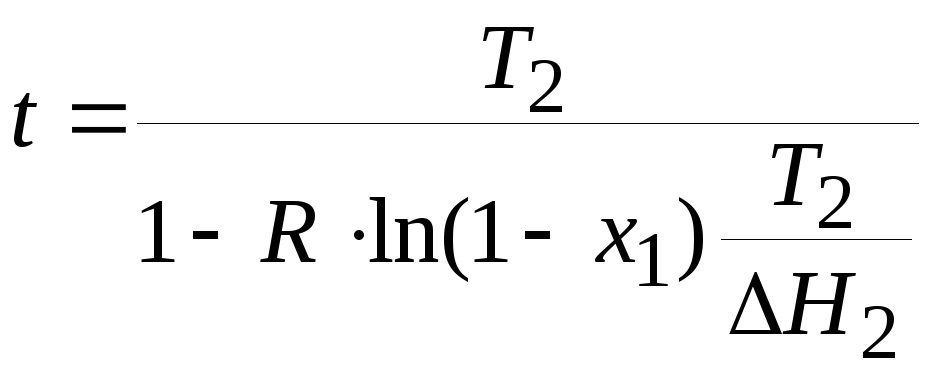
Найти состав эвтектической смеси и температуру плавления эвтектического сплава, если температуры плавления чистых компонентов T1 = 316.15 К, Т2 = 235,45 К, а энтальпии их плавления H1 = 17200 Дж , H2 = 18800 Дж.
Дана следующая схема химических реакций:
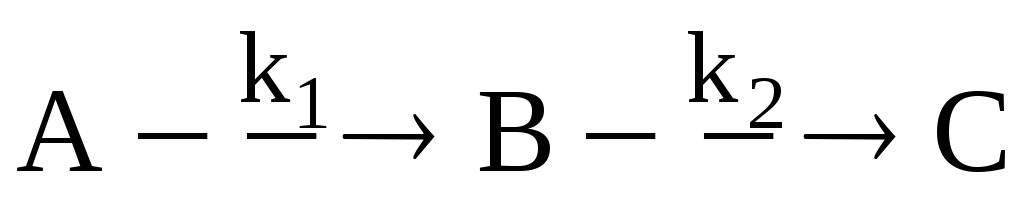 .
.
Скорость расходования и накопления вещества описывается формулой:
![]() .
.
Скорость реакции измерена при четырех различных концентрациях и температурах (см. табл.). Рассчитать четыре параметра уравнения Аррениуса k01, E1, k02, E2.
|
[A] |
[B] |
T |
w |
|
1 |
1 |
300 |
1.96610‑3 |
|
1 |
2 |
310 |
-0.0975 |
|
2 |
1 |
320 |
0.2435 |
|
1 |
1 |
330 |
-0.06219 |
