
- •Оглавление
- •Список сокращений
- •Аминокислоты, входящие в состав белков
- •Предисловие
- •Введение
- •Глава 1. Биохимия соединительной ткани
- •1.1. Клеточные элементы соединительной ткани
- •1.2. Коллаген
- •1.3. Эластин
- •1.4. Протеогликаны
- •1.5. Адгезивные и антиадгезивные белки
- •1.6. Контрольные вопросы и задания
- •1.7. Задания в тестовой форме
- •1.8. Ситуационные задачи
- •Глава 2. Биохимия костной ткани
- •2.1. Клетки костной ткани
- •2.2. Межклеточный матрикс костной ткани
- •2.3. Неколлагеновые белки костной ткани
- •2.4. Вещества небелковой природы органического матрикса костной ткани
- •2.5. Ремоделирование костной ткани
- •2.6. Факторы, регулирующие ремоделирование костной ткани
- •2.7. Контрольные вопросы и задания
- •2.8. Задания в тестовой форме
- •2.9. Ситуационные задачи
- •Глава 3. Биохимия мышечной ткани
- •3.1. Структура поперечнополосатой скелетной мышечной ткани
- •3.2. Химический состав поперечнополосатой скелетной мышечной ткани
- •3.3. Механизмы сокращения и расслабления скелетной мышцы
- •3.4. Источники энергии для мышечного сокращения
- •3.5. Особенности биохимии гладкой мышечной ткани
- •3.6. Особенности структуры и химического состава мышечной ткани сердца (миокарда)
- •3.7. Контрольные вопросы и задания
- •3.8. Задания в тестовой форме
- •3.9. Ситуационные задачи
- •Глава 4. Биохимические особенности нервной ткани
- •4.1. Химический состав нервной ткани
- •4. 2. Энергетические субстраты головного мозга
- •4.3. Гематоэнцефалический барьер
- •4.4. Особенности метаболизма в нервной ткани
- •4.5. Сигнальные молекулы: нейромедиаторы и их рецепторы
- •4.6. Контрольные вопросы и задания
- •4.7. Задания в тестовой форме
- •4.8. Ситуационные задачи
- •Глава 5. Обмен веществ в печени
- •5.1. Роль печени в белковом обмене
- •5.2. Особенности углеводного обмена в печени
- •5. 3. Метаболизм липидов в печени
- •5. 4. Внешнесекреторная и экскреторная функции печени
- •5. 5. Гомеостатическая функция печени
- •5. 6. Роль печени в обезвреживании токсинов и ксенобиотиков
- •5.7. Контрольные вопросы и задания
- •5.8. Задания в тестовой форме
- •5.9. Ситуационные задачи
- •Глава 6. Метаболизм лекарственных соединений
- •6.1. Всасывание, транспорт по крови и распределение лекарственных соединений в тканях
- •6. 2. Реализация фармакологических эффектов лекарственных веществ
- •6.3. Химические механизмы первой фазы биотрансформации лекарственных соединений
- •6.4. Реакции второй фазы инактивации лекарственных веществ
- •6.5. Удаление лекарственных веществ из организма
- •6.6. Факторы, влияющие на скорость биотрансформации лекарственных соединений
- •6.7. Контрольные вопросы и задания
- •6.8. Задания в тестовой форме
- •6.9. Ситуационные задачи
- •Эталоны ответов на задания в тестовой форме Биохимия соединительной ткани
- •Биохимия костной ткани
- •Биохимия мышечной ткани
- •Биохимические особенности нервной ткани
- •Обмен веществ в печени
- •Метаболизм лекарственных соединений в организме человека
- •Эталоны ответов на ситуационные задачи Биохимия соединительной ткани
- •Биохимия костной ткани
- •Биохимия мышечной ткани
- •Биохимические особенности нервной ткани
- •Обмен веществ в печени
- •Метаболизм лекарственных соединений в организме человека
- •Рекомендуемая литература
- •Библиографический список
6.4. Реакции второй фазы инактивации лекарственных веществ
Вторая фаза инактивации лекарственных веществ – это реакции конъюгации. В них происходит присоединение к функциональным группам вещества, образующегося на первом этапе, других молекул, которые еще больше повысят гидрофильность и уменьшат токсичность лекарственных препаратов. В качестве эндогенных гидрофильных веществ чаще всего выступают глюкуроновая кислота, метильные, ацетильные или сульфогруппы, глутатион и глицин. Катализируют эти реакции энзимы, которые относят к классу трансфераз. Существует 6 основных видов трансфераз, участвующих в реакциях коньюгации (Таблица 2):
Таблица 2
Характеристика трансферазных реакций коньюгации [15, 11 с изменением)
Фермент |
Метаболит, используемый для коньюгации |
Активная форма метаболита |
Функциональная группа лекарства для коньюгации с активным метаболитом |
Глутатион-S-трансфераза |
Глутатион (GSH) |
Глутатион (GSH) |
Галогенированные алкильные и арильные углеводороды, эпоксиды, ареноксиды |
УДФ-глюкуронилтрансфераза |
Глюкуронат |
УДФ-глюкуронат |
-ОН, -СООН, -NH2, -SH, -CH |
Сульфотрансфераза |
Сульфат |
ФАФС |
-ОН, -NH2, -SH |
Ацетилтрансфераза |
Ацетат |
Ацетил-КоА |
-ОН, -NH2 |
Метилтрансфераза |
Метил |
SAM |
-ОН, -NH2 |
Глицилтрансфераза |
Глицин |
Глицин |
-СООН |
УДФ-глюкуронилтрансферазы локализованы в эндоплазматическом ретикулуме гепатоцитов, их коферментом является УДФ - глюкуроновая кислота (Рис. 43):
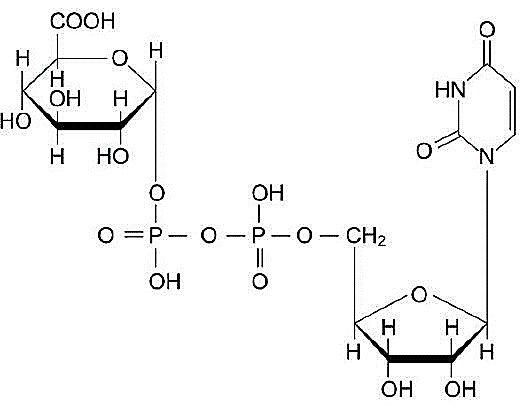
Рис. 43. Структурная формула УДФ-глюкуроновой кислоты [15].
Смысл данной трансферазной реакции сводится к переносу остатка глюкуроновой кислоты на молекулы лекарственных препаратов, модифицированных в ходе I фазы микросомального окисления, с образованием глюкуронидов. Например, в ходе УДФ-глюкуронилтрансферазной реакции салициловой кислоты образуется глюкуронид салициловой кислоты (Рис.44):
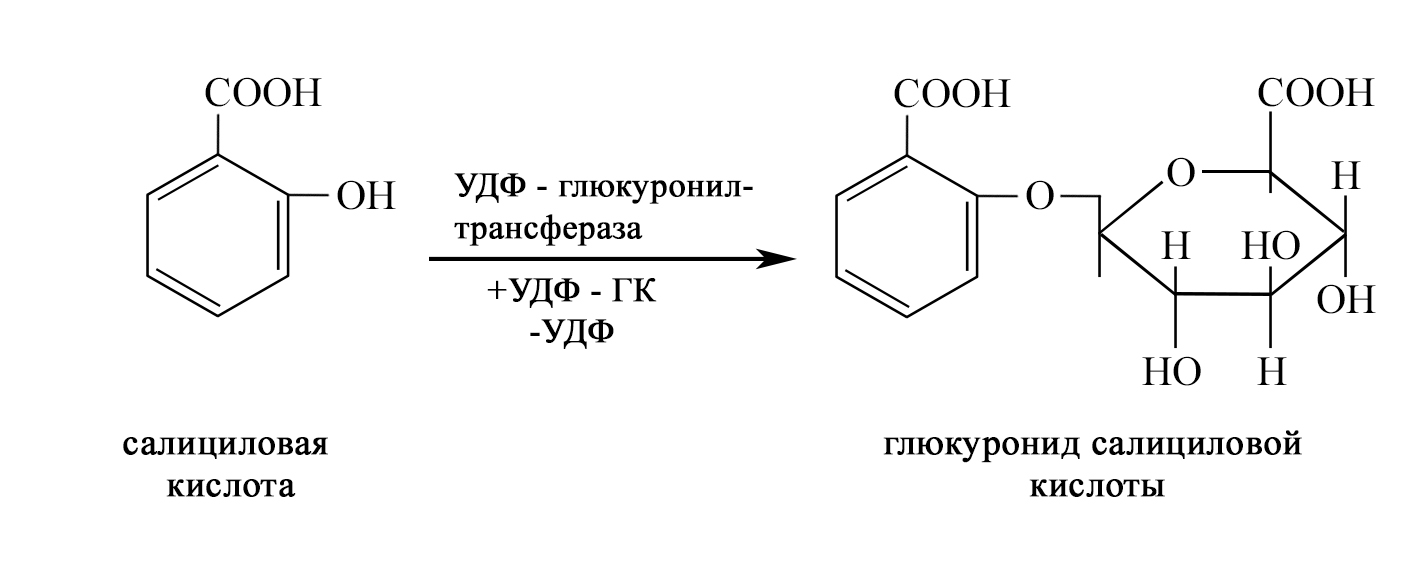
Рис.44. Реакция
коньюгации салициловой кислотыс
УДФ-глюкоуроновой кислотой[ 6].
6].
Сульфотрансферазы – это в основном цитоплазматические энзимы, которые содержат в качестве кофермента сложную молекулу фосфоаденозилфосфосульфатата (ФАФС) (Рис.45).
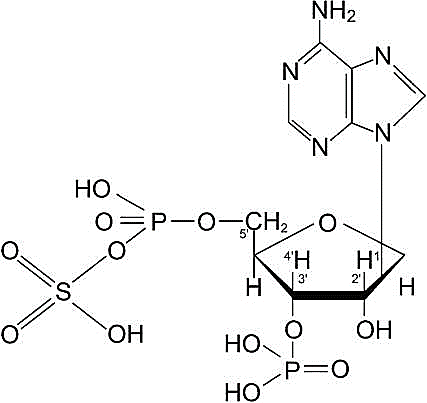
Рис.45. Структурная формула фосфоаденозилфосфосульфата (ФАФС) [15].
В ходе реакции инактивации происходит перенос на вещество остаток серной кислоты от молекулы ФАФС. Результатом действия этих ферментов являются сложные эфиры серной кислоты или эфирсульфаты, примером которых является индоксилсерная кислота, образованная при обезвреживании индола с образованием в итоге животного индикана (см. Рис.31)
Глутатионтрансферазы функционируют во всех тканях. Локализованы они преимущественно в цитозоле, но имеются в ядре и митохондриях. Простетической группой этих энзимов является глутатион – трипептид, собранный из остатков 3 аминокислот: Глу-Цис-Гли.
Глутатионтрансфераза обладают малой специфичностью к субстратам. В связи с этим общее количество лекарственных препаратов, которые трансформируются с помощью данного фермента, превышает 3000. Он участвует в реакциях дегалогенизации, замещения лабильных нитрогрупп или сульфатов, взаимодействует с эпоксидами, веществами с ненасыщенными связями, с органическими фосфатами, тиоцианатами, поли- и гетероциклическими соединениями и т. д.
Обезвреживание ксенобиотиков и лекарств (R) с участием глутатионтрансферазы может осуществляться тремя различными способами:
- путем их конъюгации с глутатионом по схеме:
1) R +GSH → GS- R-Н
- путем нуклеофильного замещения в их составе групп атомов (Х):
2) RX +GSH → GS- R+HX
- восстановления карбоксильной группы ксенобиотиков до спиртовой:
3) R-COOH + 2 GSH → R – HС – OH + GS-SG +H2O
Система обезвреживания с участием глутатионтрансферазы играет ведущую роль в обезвреживании и формировании резистентности организма к самым различным воздействиям чуждых для организма веществ. Конъюгаты ксенобиотиков с глутатионом менее реакционноспособны, более гидрофильны, менее токсичны и легче выводятся из организма.
Кроме того, глутатионтрансферазы способны своими гидрофобными центрами ковалентно связывать огромное число липофильных лекарств, предотвращающая этим их внедрение в липидный слой мембран, проникновение в цитоплазму клеток и участие в обмене веществ.
Ацетилтрансферазы катализируют реакции конъюгации, т.е. переноса и присоединения к азоту ксенобиотика ацетильного остатка от ацетил-КоА. Многие лекарственные вещества, в структуре которых имеется аминогруппа или иминогруппа, подвергаются конъюгации с остатком уксусной кислоты, донором которой служит ацетил-КоА. N-ацетилирование характерно для биотрансформации новокаина, анестезина, клоназепама, сульфаниламидов и других препаратов, например, изониазида (Рис. 46):

Рис.46. Реакция ацетилирования изониазида [10].
Метилтрансферазы переносят и присоединяют метильные радикалы
(-СН3) на группы атомов (-Р=О), (- NH2), (-SН) ксенобиотиков, инактивируя их. Метилирование заключается в переносе метильных групп от кофермента S-аденозилметионина на амины, фенолы и тиоловые соединения с образованием N-, O-, S-метиловых коньюгатов (Рис. 47):
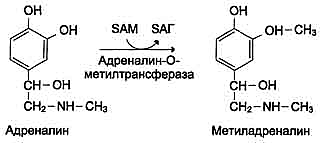
Рис.47. Реакция метилирования адреналина [10].
Коньюгация с глицином (глицилтрансферазы) и другими аминокислотами (глутаматом, цистеином) является характерной метаболической реакцией ароматических карбоновых кислот, таких как бензойная, салициловая и гетероциклические карбоновые кислоты (Рис. 48).
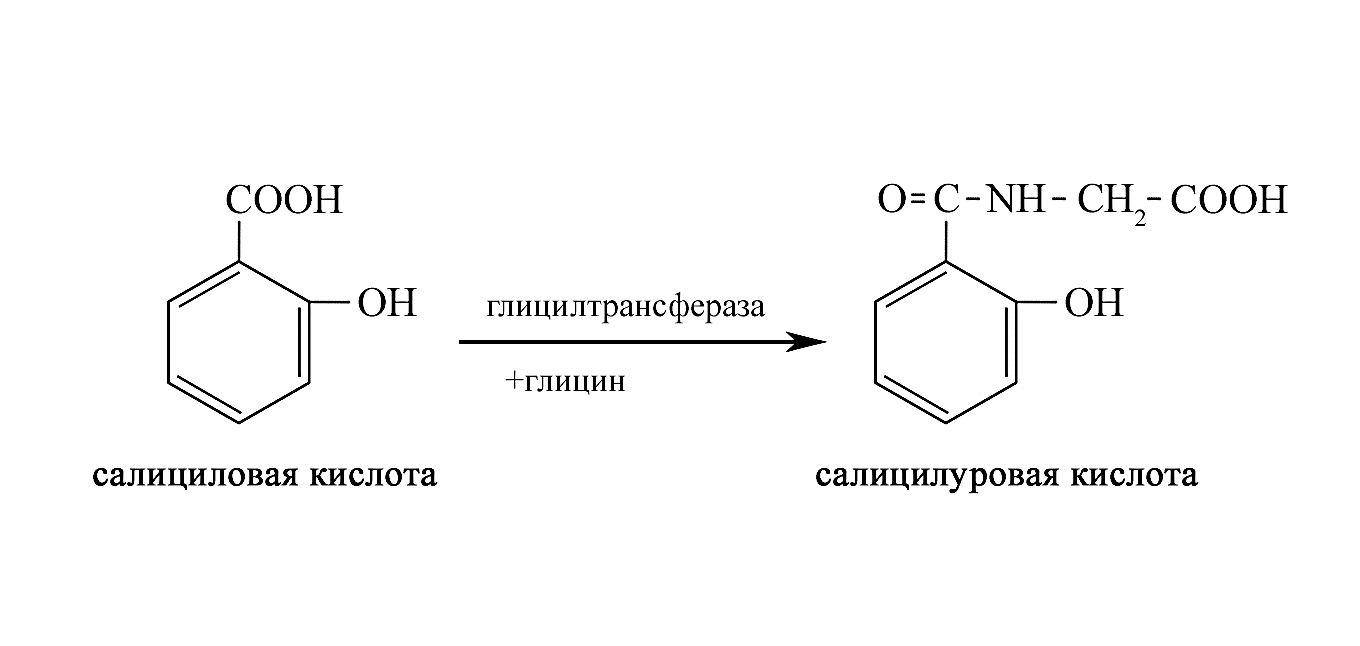
Рис.48. Реакция коньюгации салициловой кислоты с глицином [14].
Механизм обезвреживания часто заключается в образовании сначала коэнзим-А-производных чужеродных карбоновых кислот, которые взаимодействуют с глицином. Например, при обезвреживании бензойной кислоты сначала происходит ее активация, а затем взаимодействие с коэнзимом А с образованием бензоил-КоА. Затем бензоил-КоА коньюгирует с глицином с образованием гиппуровой кислоты (Рис. 49).
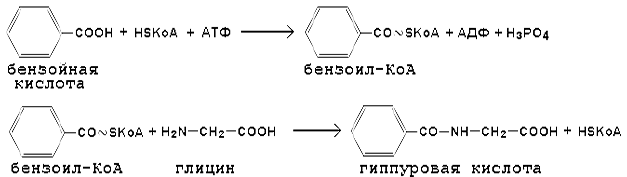
Рис.49. Реакция коньюгации бензойной кислоты с глицином [6].
Скорость этой реакции отражает функциональное состояние печени. В клинической практике используют определение скорости образования и выведения гиппуровой кислоты после введения в организм ксенобиотика бензойной кислоты (бензойнокислого натрия) – проба Квика.
Очень важный механизм инактивации и выведения из организма ксенобиотиков связан с функцией Р-гликопротеина (транспортная АТФ-аза). Этот сложный белок локализован в плазматических мембранах клеток многих органов и тканей, в частности в почках и кишечнике. Он способен присоединять гидрофобные токсичные соединения, в том числе лекарства, и выводить их из клетки с затратой АТФ, что снижает их количество в клетке.
Многие ферменты, участвующие в первой и второй фазе обезвреживания, индуцируемые белки, т.е. сами лекарственные вещества способны активировать синтез ферментов, их инактивирующих. Например, фенобарбитал активирует синтез цитохрома Р450, УДФ-глюкуронилтрансферазы и эпоксид гидролазы. При химиотерапии злокачественных процессов начальная эффективность лекарства часто постепенно падает и может развиваться лекарственная устойчивость не только к определенному лечебному препарату, но и целому ряду других лекарств. Это происходит потому, что противоопухолевые лекарства индуцируют синтез Р-гликопротеина, глутатионтрансферазы и глутатиона. Использование веществ, ингибирующих синтез Р-гликопротеина, а также ферменты синтеза глутатиона, повышает эффективность химиотерапии.
