
- •Оглавление
- •Список сокращений
- •Аминокислоты, входящие в состав белков
- •Предисловие
- •Введение
- •Глава 1. Биохимия соединительной ткани
- •1.1. Клеточные элементы соединительной ткани
- •1.2. Коллаген
- •1.3. Эластин
- •1.4. Протеогликаны
- •1.5. Адгезивные и антиадгезивные белки
- •1.6. Контрольные вопросы и задания
- •1.7. Задания в тестовой форме
- •1.8. Ситуационные задачи
- •Глава 2. Биохимия костной ткани
- •2.1. Клетки костной ткани
- •2.2. Межклеточный матрикс костной ткани
- •2.3. Неколлагеновые белки костной ткани
- •2.4. Вещества небелковой природы органического матрикса костной ткани
- •2.5. Ремоделирование костной ткани
- •2.6. Факторы, регулирующие ремоделирование костной ткани
- •2.7. Контрольные вопросы и задания
- •2.8. Задания в тестовой форме
- •2.9. Ситуационные задачи
- •Глава 3. Биохимия мышечной ткани
- •3.1. Структура поперечнополосатой скелетной мышечной ткани
- •3.2. Химический состав поперечнополосатой скелетной мышечной ткани
- •3.3. Механизмы сокращения и расслабления скелетной мышцы
- •3.4. Источники энергии для мышечного сокращения
- •3.5. Особенности биохимии гладкой мышечной ткани
- •3.6. Особенности структуры и химического состава мышечной ткани сердца (миокарда)
- •3.7. Контрольные вопросы и задания
- •3.8. Задания в тестовой форме
- •3.9. Ситуационные задачи
- •Глава 4. Биохимические особенности нервной ткани
- •4.1. Химический состав нервной ткани
- •4. 2. Энергетические субстраты головного мозга
- •4.3. Гематоэнцефалический барьер
- •4.4. Особенности метаболизма в нервной ткани
- •4.5. Сигнальные молекулы: нейромедиаторы и их рецепторы
- •4.6. Контрольные вопросы и задания
- •4.7. Задания в тестовой форме
- •4.8. Ситуационные задачи
- •Глава 5. Обмен веществ в печени
- •5.1. Роль печени в белковом обмене
- •5.2. Особенности углеводного обмена в печени
- •5. 3. Метаболизм липидов в печени
- •5. 4. Внешнесекреторная и экскреторная функции печени
- •5. 5. Гомеостатическая функция печени
- •5. 6. Роль печени в обезвреживании токсинов и ксенобиотиков
- •5.7. Контрольные вопросы и задания
- •5.8. Задания в тестовой форме
- •5.9. Ситуационные задачи
- •Глава 6. Метаболизм лекарственных соединений
- •6.1. Всасывание, транспорт по крови и распределение лекарственных соединений в тканях
- •6. 2. Реализация фармакологических эффектов лекарственных веществ
- •6.3. Химические механизмы первой фазы биотрансформации лекарственных соединений
- •6.4. Реакции второй фазы инактивации лекарственных веществ
- •6.5. Удаление лекарственных веществ из организма
- •6.6. Факторы, влияющие на скорость биотрансформации лекарственных соединений
- •6.7. Контрольные вопросы и задания
- •6.8. Задания в тестовой форме
- •6.9. Ситуационные задачи
- •Эталоны ответов на задания в тестовой форме Биохимия соединительной ткани
- •Биохимия костной ткани
- •Биохимия мышечной ткани
- •Биохимические особенности нервной ткани
- •Обмен веществ в печени
- •Метаболизм лекарственных соединений в организме человека
- •Эталоны ответов на ситуационные задачи Биохимия соединительной ткани
- •Биохимия костной ткани
- •Биохимия мышечной ткани
- •Биохимические особенности нервной ткани
- •Обмен веществ в печени
- •Метаболизм лекарственных соединений в организме человека
- •Рекомендуемая литература
- •Библиографический список
3.1. Структура поперечнополосатой скелетной мышечной ткани
Скелетная мышца, покрытая соединительнотканной фасцией, состоит из множества пучков мышечных волокон, или мышечных клеток. Мышечное волокно обычно рассматривают как многоядерную клетку больших размеров, покрытую эластичной оболочкой-сарколеммой - миоцит. Каждое волокно в полужидкой саркоплазме содержит множество нитевидных образований – миофибрилл, обладающих поперечной исчерченностью. В саркоплазме находится и ряд других структур: митохондрии, микросомы, рибосомы, система цистерн и трубочек называемая саркоплазматический ретикулум (СР).
Миофибриллы человека толщиной 1-2 мкм, а длиной до нескольких сантиметров (длина всей клетки), состоят из повторяющихся участков – саркомеров, длиной около 2-2,5 мкм. Саркомер является структурной и функциональной единицей поперечнополосатой мышцы.
При изучении миофибрилл под электронным микроскопом видны чередующиеся темные и светлые полосы или А- и I-диски (анизотропные и изотропные). I-диски разделяются пополам электронно плотными Z-линиями (пластинками), называемыми телофрагмами. Часть микрофибриллы между двумя соседними Z-линиями называется саркомером (рис. 19). Каждый саркомер включает диск А и по сторонам от него два полудиска I.

Рис.19. Структура мышечного волокна [16]
Саркомеры содержат два типа белковых филаментов: тонкие миофиламенты состоят из актина, толстые миофиламенты — из миозина (рис. 1). Телофрагмы (Z-диски) включают белки альфа-актинин, который фиксирует там тонкие нити, и бета-актинин, регулирующий длину тонких нитей. С актиновыми филаментами (тонкие нити) связаны вспомогательные белки – небулин и белки тропонин-тропомиозинового комплекса. Небулин – длинный нерастяжимый белок, связанный с Z-диском и идущий параллельно актиновым филаментам. Белок десмин содержится между Z-дисками соседних миофибрилл, обеспечивая совпадение границ всех их саркомеров. При электронной микроскопии поперечного среза миофибриллы заметно гексагональное взаимоположение толстых и тонких нитей.
3.2. Химический состав поперечнополосатой скелетной мышечной ткани
В мышечной ткани содержится до 80% воды. Около 20-28% массы мышц приходится на долю сухого остатка, большую часть которой составляют белки. Белки мышц делят на 3 группы: миофибриллярные белки, белки саркоплазмы и белки стромы. Среди мышечных белков на долю миофибриллярных приходится 45%, саркоплазматических – 35% и белков стромы – 20%.
К группе миофибриллярных белков относят: миозин, актин, актомиозин, тропомиозин, тропонин, α- и β-актинин, М-белок, С-белок, десмин, небулин, титин.
Миозин составляет 50-55% от сухой массы миофибрилл и является основным белком толстых миофиламентов. Миозин – крупный олигомерный белок, молекулярной массой 460 кДа, состоит из 6 субъединиц, попарно одинаковых – 2 тяжелых и 4 легких цепей, связанных нековалентно. Каждая молекула миозина имеет форму длинного стержня длиной 150 нм с глобулярной головкой на N-конце и напоминает клюшку для гольфа (рис. 20). α-Спиральные участки двух тяжелых цепей свернуты в двойную суперспираль, а четыре небольших субъединицы связаны с глобулярными головками. В мышечном волокне миозин образует толстые миозиновые филаменты, которые представляют собой пучки из сотен молекул миозина, расположенных параллельно и взаимодействующих между собой «бок-в-бок» с помощью ионных, гидрофобных связей, при этом глобулярные головки обращены наружу. Толстая нить состоит из порядка 400 молекул миозина, по 200 с каждой стороны от М-линии.
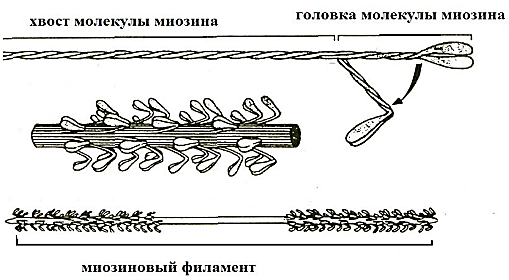
Рис.20. Схема строения миозина [5].
Легкие цепи, находящиеся в «головке» миозиновой молекулы, принимают участие в проявлении АТФ-азной активности, регулируемой малыми субъединицами.
Актин – основной белок тонких миофиламентов, на долю которого среди белков мышц приходится 20-25%. Актин представляет собой небольшой глобулярный белок молекулярной массой 43 кДа, который называют G-актином. Молекулы G-актина в присутствии ионов магния способны к агрегации с образованием фибриллярного белка – F-актина. В состав тонкой нити миофибрилл входят две F-актиновые нити, которые закручиваются относительно друг друга, образуя суперспираль.
При соединении F-актина с миозином, образуется актомиозин, обладающий большей АТФ-азной активностью, чем миозин. Активация актомиозина происходит при участии ионов Mg2+, а ингибирующим действием обладают этилендиаминтетраацетат (ЭДТА) и высокая концентрация АТФ. В то время как АТФ-азная активность миозина повышается при участии ЭДТА и ингибируется ионами Mg2+.
Тропомиозин – фибриллярный белок молекулярной массой 70 кДа и имеет вид альфа-спирали. Тропомиозин связан с F-актином, охватывая примерно семь актиновых субъединиц, то есть в тонкой нити миофибриллы на одну молекулу тропомиозина приходится 7 молекул G-актина. Молекулы тропомиозина соединяются «конец-в-конец» в непрерывную цепочку, которая располагается в желобке между двумя скрученными нитями F-актина. В состоянии мышечного расслабления нить тропомиозина обратимо закрывает активные центры связывания молекул G-актина с головками миозина, что обеспечивает релаксацию миофибрилл, так как миозин не может взаимодействовать с актином.
Тропонин – глобулярный белок молекулярной массой 78 кДа, состоит из трех субъединиц (Т, С, I), располагается на тропомиозине через равные промежутки, длина которых равна длине молекулы тропомиозина (рис.21).
Тропонин С (ТнС) связывает ионы кальция. Тропонин I (ТнI) – обладает ингибиторной функцией, создает пространственное препятствие для взаимодействия актина и миозина во время, когда ТнС не связан с Са2+. Тропонин Т (ТнТ) отвечает за связывание тропонина с тропомиозином. Комплекс тропомиозина с тропонином прикрепляется к актиновым филаментам и придает актомиозину чувствительность к ионам Са2+.

Рис.21. Структура тонкого филамента: 1 – актин; 2 – тропомиозин; 3 – тропонин C; 4 – тропонин I; 5 – тропонин T [1].
Белок α-актинин входит в Z-линию и фиксирует там тонкие линии; β-актинин регулирует длину тонких нитей; М-белок входит в М-линию и фиксирует там толстые нити; С-белок регулирует длину толстых нитей; десмин содержится между Z-линиями соседних миофибрилл, обеспечивая совпадение границ саркомеров; небулин отходит от Z-линии и ассоциирован с тонкими нитями; титин – связывает толстые нити с Z-линией и отвечает за их расположение в центре саркомера.
К белкам саркоплазмы относятся белки с регуляторной функцией – миогеновая фракция (ферменты гликолиза, тканевого дыхания, пентозофосфатного цикла), миоглобин, миоальбумин, нуклеопротеины, а также белки, способные обратимо связываться с ионами кальция – кальмодулин и кальсеквестрин. Кальсеквестрин находится внутри саркоплазматического ретикулума, в близкой связи с кальциевыми каналами. Благодаря высокому содержанию кислых аминокислот одна молекула кальсеквестрина связывает около 50 ионов кальция, что обеспечивает депонирование Ca2+ в саркоплазматическом ретикулуме.
Отдельно следует выделить мембранный белок дистрофин выполняющий структурную роль в мышечных волокнах, обеспечивая их целостность путем стабилизации клеточной мембраны. В норме в мышечном волокне он локализуется на цитоплазматической поверхности сарколеммы, являясь важной составной частью цитоскелета и обеспечивая связь между актиновыми филаментами и сарколеммой. Кроме того, белок дистрофин входит в состав дистрофин-гликопротеинового комплекса (ДГК).
Белки стромы в поперечно-полосатой мускулатуре представлены в основном коллагеном и эластином.
Мышцы, помимо белков, содержат:
– небелковые азотистые компоненты: нуклеотиды аденинового ряда (АТФ, АДФ, АМФ) и неаденинового ряда (ГТФ, УТФ, ЦТФ), креатинфосфат, креатин, креатинин, карнозин, ансерин, свободные аминоксилоты, мочевина, мочевая кислота и др;
– небелковые безазотистые компоненты: гликоген, карбоновые кислоты (лактат, пируват), триглицериды, холестерин.
Химический состав мышечной ткани может значительно меняться при различных патологиях, так, например, возможно резкое снижение в мышцах содержания миофибриллярных белков и возрастание содержания белков стромы и белков сакроплазмы; снижение уровня АТФ, цАМФ, креатинфосфата; снижение АТФ-азной активности миозина и активности ферментов сакроплазмы; повышение активности фосфодиэстеразы и лизосомальных ферментов; нарушение в активации аденилатциклазной системы; нарушение метаболизма креатина и его выделение с мочой (креатинурия).
