
4 курс / Акушерство и гинекология / Гришин_И_И_Эмболизация_маточных_артерий_Новые_технологии_в_оперативной
.pdf
Через 6 месяцев средний уровень экспрессии PR в эндометрии пациенток I(гэ) группы составил 3,86 ± 0,12 усл.ед. при ПГЭ, 3,92 ± 0,11 усл.ед. при СГЭ и достоверно не различался с показателем в нормальном пролиферативном эндометрии 3,64 ± 0,15 усл.ед. (контрольная группа). В группе пациенток (II(гэ)), получавших после ЭМА противорецидивное лечение, показатели экспрессии PR (7,05 ± 0,02 усл.ед. при ПГЭ и 6,08 ± 0,02 усл.ед. при СГЭ) достоверно (p<0,05) отличались от показателей I (гэ) группы, пролиферативного эндометрия, а также с показателями II(гэ) до ЭМА (рис. 4.40). Увеличение экспрессии PR в эндометрии доказывает способность, на фоне приема дидрогестерона, увеличивать концентрацию собственных рецепторов.
*-p<0,05 – различия статистически достоверны с показателями контрольной группы **-p<0,05 – различия статистически достоверны по сравнению с показателями I(гэ)
группы после ЭМА
***-p<0,05 – различия статистически достоверны по сравнению с показателями II(гэ) группы до ЭМА
Рис. 4.40 Показатели экспрессии PR в эндометрии до и после ЭМА, усл.ед.
Исследования клаудинов CLDN-3 и 5 могут быть использованы в качестве маркеров, способных предсказать прогноз для больных миомой матки в сочетании с гиперпластическими процессами эндометрия.
При ИГХ исследовании установлено, что продукт реакции гена CLDN- 3 у больных с сочетанной патологией эндо - и миометрия через 6 месяцев после ЭМА у пациенток I(гэ) группы обнаруживался в мембране и
111

цитоплазме эпителиальных клеток эндометрия. У данной категории пациенток отмечалось незначительное снижение мембранного и цитоплазматического окрашивания, что достоверно не отличалось от показателей при ПГЭ и СГЭ до ЭМА (2,57 ± 0,15, 0,54 ± 0,03, 2,62 ± 0,04,
0,51 ± 0,01 баллов).
Показатели CLDN-3 через 6 месяцев после ЭМА составили в I(гэ) группе 2,43 ± 0,12мембранного и 0,49 ± 0,02цитоплазматического окрашивания при ПГЭ, 2,49 ± 0,08 и 0,50 ± 0,03 при СГЭ. В ходе проведенного анализа данные показатели достоверно отличались (p<0,05) от группы контроля (рис.4.41).
*-p<0,05 при сравнении с контрольной группой **-p<0,05 при сравнении с показателями до ЭМА.
***-p<0,05 05 при сравнении I(гэ) и II(гэ) групп после лечения
Рис. 4.41 Динамика ИГХ показателей CLDN-3 в эпителиальных клетках эндометрия пациенток I(гэ) и II(гэ) групп до и после ЭМА.
В |
группе |
пациенток |
II(гэ), |
получавших |
гормональную |
противорецидивную терапию показатели CLDN-3 через 6 месяцев после |
|||||
ЭМА, |
были достоверно ниже |
исходных показателей |
(мембранное |
||
окрашивание) до ЭМА (0,41 ± 0,01 баллов при ПГЭ и 0,48 ± 0,02 баллов при СГЭ) и соответствовали показателям эндометрия фазы пролиферации 0,41 ± 0,03 баллов (контрольной группы).
112
Цитоплазматическое окрашивание эпителиальных клеток эндометрия после ЭМА при оценке ИГХ реакций с CLDN-3 в II(ep) группе после курса противорецидивной терапии не определялось (рис. 4.41).
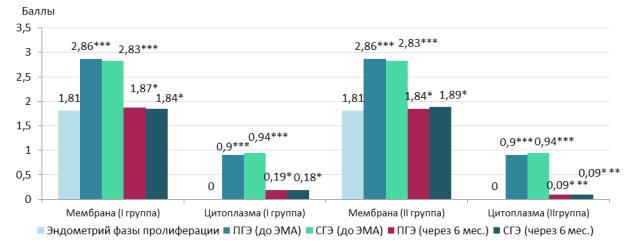
При ИГХ исследовании локализации и накопления в эндометрии пациенток изучаемых групп продукта реакции CLDN-5 после ЭМА выявлено преимущественно мембранное окрашивание клеток и, в меньшей степени, цитоплазматическое. Как видно из рисунка 4.42, показатели CLDN-5 в мембране эпителиальных клеток эндометрия больных миомой матки после ЭМА были достоверно выше (p<0,05), чем до ЭМА и составили в баллах: при ПГЭ в I(гэ) группе 1,87 ± 0,06, во II(гэ) группе – 1,84 ± 0,07 соответственно; при СГЭ в I(гэ) группе 1,92 ± 0,11, во II(гэ) группе 1,89 ± 0,08.
*-p<0,05 – различия статистически достоверны по сравнению с показателем до ЭМА **<0,05 при сравнении I(гэ) и II(гэ) групп после лечения
***<0,05 при сравнении с контрольной группой
Рис. 4.42 Динамика ИГХ показателей CLDN-5 в эпителиальных клетках эндометрия пациенток I(гэ) и II(гэ) групп до и после ЭМА.
Цитоплазматическое окрашивание эпителиальных клеток эндометрия после ЭМА выявлено у больных I(гэ) группы и II(гэ) группы, интенсивность его была достоверно ниже (p<0,05), чем до процедуры эмболизации. В I(ep) группе интенсивность окрашивания цитоплазмы клеток при ИГХ реакции с CLDN-5 составила 0,19 ± 0,01и 0,18 ± 0,01баллов у пациенток с выявленной до эмболизации ПГЭ и СГЭ соответственно. Во II(гэ) группе у больных с ПГЭ и СГЭ показатель цитоплазматического окрашивания CLDN-5 после
113
ЭМА был достоверно ниже, чем в I(гэ) группе, и составил 0,09 ± 0,003 баллов
(рис. 4.42).
Таким образом, результаты проведенного анализа выявили ряд иммуногистохимических и молекулярно-биологических особенностей гиперпластических процессов эндометрия у больных миомой матки через 6 месяцев после ЭМА в группе I(гэ) без дополнительной гормонотерапии и в группе II(гэ) с последующей противорецидивной терапией.
-через 6 месяцев после ЭМА отмечается достоверное увеличение Ki67 на фоне проводимого гормонального лечения и без него;
-достоверно увеличивается активность апоптоза APAF-1 в стромальном и эпителиальном компонентах эндометрия группы пациенток получавших противорецидивное лечение;
-в группах, получавших гормональную терапию и без нее после ЭМА, экспрессия ангиогенных факторов роста, к которым относится VEGF, соответствовала показателям пролиферативного эндометрия;
-достоверное увеличение показателя экспрессии генов к прогестерону (PR) в образцах гиперплазии, по-сравнению с показателем экспрессии до ЭМА;
-отмечалось снижение накопления продуктов реакции генов CLDN-3 и CLDN-5 в мембране клеток и отсутствие цитоплазматического окрашивания,
вгруппе получавших противорецидивное лечение.
Данное исследование убедительно доказывает, что сама по себе ЭМА не является лечебным фактором гиперплазии эндометрия. Поэтому обязательно проведение противорецидивной терапии.
4.4 Клиническая неэффективность эмболизации маточных артерий.
У 63 (4,6%) пациенток отмечено возникновение аменореи и олигоменореи. В зависимости от причины возникновения аменореи и олигоменореи мы выделяли 2 формы: маточную и яичниковую. Маточная
114

форма диагностирована у 15 (1,1%) пациенток. Данная форма возникала вследствие хирургического удаления субмукозных миоматозных узлов больших размеров, удаленных хирургическим (трансцервикальным) путем в течение 1-6 месяцев после ЭМА (рис. 4.43, 4.44).
Рис. 4.43 Синехии в полости матки
Рис. 4.44 Синехии в полости матки и нарушение пролиферации эндометрия
115
У данной категории пациенток причиной снижения кровопотери во время менструации или отсутствие таковых явились внутриматочные синехии и нарушение пролиферации эндометрия (рис. 4.44). После рассечения синехий (оперативная гистероскопия, гистерорезектоскопия) и проведенного адекватного лечения (гормонотерапия, витаминотерапия) менструальный цикл восстановился.
По данным УЗИ в динамике определялся рост фолликулярного аппарата, гормональный профиль был не изменен. Еще у 15 (1,1%) пациенток при проведении ЭМА использовались эмболы малых размеров (ПВА 300-500 нм), которые по ходу кровотока мигрировали и закупоривали радиальные артерии, питающие эндометрий.
При УЗИ у данных пациенток эндометрий во второй фазе менструального цикла оставался линейным, хотя яичники были нормальных размеров с выраженным фолликулярным аппаратом. Гормональный профиль также был не изменен. Аменорея у данных пациенток была транзиторной, и через 6 месяцев кровоснабжение эндометрия восстанавливалось.
Яичниковая форма олигоменореи встретилась у 33 (2,4%) пациенток в репродуктивном периоде.
Во время проведения ЭМА у этих пациенток диагностированы мощные маточно-яичниковые анастомозы, которые послужили главным фактором непреднамеренной эмболизации яичниковых артерий. В течение 1 года нормальная менструальная функция данных пациенток была восстановлена
(рис. 4.45, 4.46).
116

Рис. 4.45, 4.46 Маточно-яичниковые анастамозы
117
В нашем исследовании у 30 (2,2%) пациенток в связи с неэффективностью (отсутствие динамики уменьшения узлов, наличие кровотока в узлах и на границе) и возобновлением клинических симптомов (менометроррагаии) возникла необходимость в проведении повторной ЭМА. У всех пациенток рецидив развился спустя 6-12 месяцев, после проведенной ЭМА. Детальный анализ показал, что у 10 (0,7%) миома матки сочеталась с аденомиозом III степени и проводилась на фоне гормональной терапии (8 и 2 соответственно). В 3-х (0,2%) наблюдениях причиной рецидива явились развившиеся коллатеральные артериальные ветви, отходящие от срамной артерии, и питающие миому. В 5 (0,3%) случаях при контрольных ангиографических исследованиях стволы маточных артерий оставались полностью окклюзироваными, однако ультразвуковые исследования свидетельствовали о резком усилении кровотока по яичниковым артериям, которые и обеспечивали кровоснабжение миомы.
У 3-х (0,2%) пациенток источником восстановления кровоснабжения матки и миомы явилась компенсаторно гипертрофировавшаяся ветвь пузырной артерии, имеющая прямое анастомозирование с ветвями ранее окклюзированной маточной артерии. А у остальных 9 ( 0,7%) пациенток произошла частичная или полная реканализация маточных артерий, что объясняется наличием дополнительных коллатеральных путей кровоснабжении миомы.
У пяти 5 (0,4%) пациенток перенесших эмболизацию маточных артерий в отдаленном периоде произведена экстирпация матки. Показанием для проведения оперативного вмешательства явились длительное лихорадящее состояние пациенток, отсутствие эффекта от проводимой консервативной терапии (антибактериальная, инфузионная, дезинтоксикационная и т.д.), отсутствие условий для проведения гистерорезектоскопии, трансцервикальной миомэктомии (рис. 4.47, 4.48,
4.49).
118

Рис. 4.47 УЗ-картина вторичных изменений в миоматозном узле после ЭМА.
119

Рис. 4.48, 4.49 Макропрепарат
Таким образом, возникшая потребность в оказании хирургического пособия можно рассматривать как осложнение, только тот вариант, когда течения постэмболизационного периода у больных миомой матки перенесших эмболизацию маточных артерий в отдаленный период закончилось удалением матки 5 (0,4%) (гистерэктомией).
4.5 Изменения в системе гемостаза у пациенток после ЭМА и гистерэктомии.
4.5.1.Клиническая характеристика групп больных.
Врамках проводимого исследования за период 2003-2010гг., мы провели выборку больных из двух основных групп, которая составила 110 (4,2%) пациенток, находившихся на стационарном лечении в гинекологическом отделении ГКБ №1 Н.И.Пирогова.
При диагностики острого тромботического процесса все пациентки были госпитализированы в хирургические и реанимационные отделения
120
