
4 курс / Акушерство и гинекология / Гришин_И_И_Эмболизация_маточных_артерий_Новые_технологии_в_оперативной
.pdf
Рис. 4.17, 4.18 Миомэктомия, проведенная традиционным (открытым) доступом.
Рис. 4.19 Макроскопическая картина миоматозного узла (9 см).
91

Рис. 4.20, 4.21 Гистологическая картина узла.
Динамика уменьшения узлов миомы в целом при сочетании с аденомиозом была меньше, чем при изолированной миоме. Так, уменьшение объема матки при сочетании с аденомиозом составило 40% за 12 месяцев. При этом при узловой форме отмечалось уменьшение на 45%, а при
92

диффузной – лишь на 33%. Хотя менометррагии купировались практически как при изолированных миомах (88,7%).
4.2Сочетание миомы матки с опухолями яичников.
У47 (3,5%) пациенток до проведения ЭМА были диагностированы
объемные образования яичников. Данные гинекологического осмотра, ультразвукового исследования с изучением характера кровоснабжения этих образований, показатели опухолевых маркеров позволили предположить доброкачественный процесс. Этим пациенткам были проведены оперативная лапароскопия и резекция яичников. Гистологически у всех подтверждена доброкачественная патология. У 36 (2,6%) пациенток диагностирован наружный эндометриоз и эндометриоидные кисты яичников (рисунок 4.22), у 11 (0,8%) – доброкачественные объемные образования (серозные, муцинозные цистаденомы). Проведение операций по-поводу яичниковых новообразований, конечно, целесообразно проводить до ЭМА.
Оперативное вмешательство перед ЭМА позволит вовремя диагностировать возможную злокачественную патологию яичников и избежать неоправданной, в данном случае, эмболизации маточных артерий. Однако в нашей работе такой ситуации не встретилось.
93
Рис. 4.22 Наружный эндометриоз и эндометриоидные кисты яичников III ст.
Детальный анализ проведения оперативных вмешательств в периэмболизационном периоде представлен в таблице 4.2.
Таблица 4.2
Комплексное лечение гинекологической патологии в периэмболизационном периоде у пациенток исследуемых групп.
|
|
Количество |
|
Объем лечебных мероприятий |
|||
Нозология |
|
пациентов |
|
в периэмболизационном |
|||
|
абс. |
|
|
% |
|
периоде |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
Опухоли яичников: |
|
|
|
|
|
|
Оперативная лапароскопия: |
Серозные, муцинозные, |
|
11 |
|
|
0,8 |
|
цистэктомии; |
эндометриоидные кисты |
|
36 |
|
|
2,6 |
|
резекция яичников |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Оперативная лапароскопия: |
Субсерозные миоматозные узлы |
|
17 |
|
|
1,2 |
|
миомэктомия |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Самостоятельная экспульсия, |
|
|
24 |
|
|
1,8 |
|
не требующая оперативного |
Субмукозные миоматозные узлы |
|
|
|
|
|
|
лечения |
|
|
15 |
|
|
1,1 |
|
Трансцервикальная |
|
|
|
|
|
|
|
миомэктомия,гистерорезекция |
|
|
|
|
|
|
|
Наблюдение: УЗИ через 3, 6 |
Гиперпластические процессы |
|
316 |
|
|
23,3 |
|
мес., |
эндометрия |
|
|
|
|
|
|
Аспирационная биопсия |
|
|
|
|
|
|
|
эндометрия, |
|
|
|
|
|
|
|
гистероскопияРДВ |
4.3 Сочетание миомы матки с гиперплазией эндометрия.
Железистая гиперплазия (МКБ-10) занимает одно из ведущих мест в структуре гинекологической заболеваемости. Высокая частота распространенности гиперплазии, тесная связь с различными нарушениями менструального цикла и эндокринной патологией, риск предраковой трансформации и рака эндометрия – все это определяет актуальность проблемы лечения гиперплазии эндометрия [20, 24, 30, 245].
Особая актуальность данной проблемы обусловлена высокой частотой сочетания миомы матки с гиперплазией эндометрия (ГПЭ) – 316 (23,3%).
94
С целью достижения максимальной однородности для молекулярнобиологических и иммуногистохимических исследований были отобраны образцы эндометрия у 180 (n=180) пациенток репродуктивного возраста с сочетанной патологией эндо - и миометрия.
Взависимости от дальнейшей тактики ведения пациентки были разделены на три группы.
I(гэ) группу составили 50 (n=50) пациенток, средний возраст 39,3 ± 1,4 лет, у которых в связи с экстрагенитальной патологией либо отказом от лечения после ЭМА по тем или иным причинам лечение гиперплазии эндометрия не проводилось.
Во II(гэ) группу вошли 100 (n=100) пациенток, средний возраст которых составил 40,4 ± 1,4 лет, которым после ЭМА с целью противорецидивного лечения гиперпластического процесса эндометрия применялась различная гормонотерапия. Пациентки получали препараты на основе дидрогестерона (Дюфастон) и низкодозированный монофазный комбинированный диеногест содержащий оральный контрацептив (Жанин), при необходимости дополнительной контрацепции.
Вконтрольную группу III(гэ) были включены 30 (n=30) пациенток с миомой матки без гиперплазии эндометрия, средний возраст которых составил 35,4 ± 1,7, с миомой матки без гиперплазии эндометрия (гэ – индекс групп в которых проводилось исследование состояния эндометрия).
Всем пациенткам в качестве основного метода лечения миомы матки была произведена эмболизация маточных артерий.
Критерием отбора в исследование являлось наличие у пациенток миомы матки в сочетании с морфологически верифицированной гиперплазией эндометрия простой и сложной без атипии.
95
4.3.1 Клинические, иммуногистохимические и молекулярнобиологические особенности состояния эндометрия у больных миомой матки.
Для оценки срединного маточного эхо (М-эхо), объема матки, определения количества, локализации, размеров, объема и структуры миоматозных узлов, а также характера их роста и кровоснабжения проводилось трансабдоминальное и трансвагинальное ультразвуковое исследование. Следует отметить, что данное УЗ исследование выполнялось в пролиферативную фазу менструального цикла перед ЭМА, а также, через 6 месяцев после процедуры.
При ультразвуковом исследовании эндометрия пациенток основных групп (n=150), выполненном перед ЭМА, средняя величина переднезаднего размера срединного маточного эхо (М-эхо) составила в I(гэ) группе 11,09 ± 1,75 мм, во II(гэ) группе – 11,05 ± 1,89 мм, и достоверно (p<0,05) отличалась от показателя в контрольной группе – 5,73 ± 1,15 мм (рис. 4.23).
|
мм. |
11,09* |
11,05* |
|
|
|
|||||||||
12 |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5,73 |
|
|
|
|
|
|
|
|
|
|
|
||
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
*р |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
р<0,05 – различиястатистически достоверны посравнению сконтролем |
|
||||||||||||
|
|
|
Эндометрийфазыпролифер ц |
I группа |
|
|
|
II группа |
|
|
|||||
Рис. 4.23 Показатели срединного маточного эхо (М-эхо) исследуемых групп до ЭМА (мм).
Всем пациенткам, обязательно, выполнялась гистероскопия и раздельное диагностическое выскабливание слизистой цервикального канала
96

и стенок полости матки в плановом порядке перед ЭМА, особенно при нарушении менструального цикла и увеличении М-эхо.
При морфологическом исследовании соскобов из полости матки пациенток основных групп, во всех случаях выявлена гиперплазия эндометрия без атипии (рис. 4.24, 4.25).
97
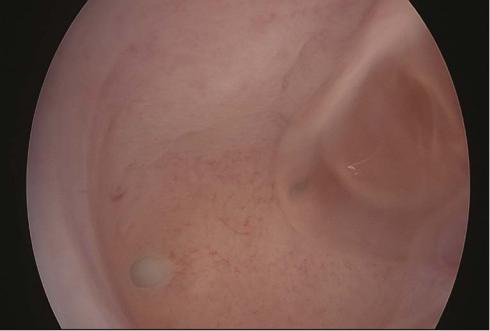
Рис. 4.24, 4.25 Гистероскопическая картина гиперплазии эндометрия.
Впервой группе I(гэ) простая гиперплазия эндометрия (ПГЭ) установлена при изучении 40 (80%) образцов. Гистологические признаки, характерные для сложной типичной гиперплазии эндометрия (СГЭ), выявлены у 10 (20%) пациенток (рис. 4.24, 4.25).
Во II(гэ) группе патоморфологический диагноз соответствовал простой гиперплазии эндометрия у 63 (63%) пациенток. Сложная гиперплазия эндометрия была выявлена в 37 (37%) случаях (рис. 4.24, 4.25).
Вконтрольной группе III(гэ) при морфологическом исследовании слизистой оболочки матки в 70% (21 пациентка) случаях выявлен эндометрий в фазе пролиферации (рис. 4.26), в 30% (9 пациенток) случаях – в фазе секреции.
Рис. 4.26 Гистероскопическая картина (эндометрий в фазе пролиферации).
В ходе иммуногистохимических (ИГХ) исследований изучали содержание антигенов Ki-67, APAF-1 и CLDN-3,5 в ткани эндометрия.
98

Методом RT-PCR дополнительно оценивалась экспрессия генов VEGF, рецепторов к эстрадиолу и прогестерону.
При ИГХ исследовании пролиферативной активности Ki-67 в эндометрии фазы пролиферации составил; в клетках стромы – 15,6 ± 1,12 %,
вэпителии 13,2 ± 1,16 %.
Вобразцах ПГЭ содержание Ki-67 в стромальном компоненте эндометрия оказалось 1,4 ± 0,08 %, в эпителиальном – 3,9 ± 0,18 %. Уровень пролиферативной активности при СГЭ оказался достоверно (p<0,05) выше, чем при простой гиперплазии как в строме, так и эпителии: ИГХ показатель Ki-67 в строме составил 6,4 ± 0,57 %, в эпителии – 11,05 ± 0,34 % (рис. 4.27).
*р<0,05 – различия статистически достоверны по сравнению с контролем ** р<0,05 – различия статистически достоверны по сравнению с ПГЭ
Рис. 4.27 Иммуногистохимические показатели Ki -67 в эндометрии пациенток (%).
При анализе активности апоптоза APAF-1 в контрольной группы составил: в строме 3,7 ± 0,62, в эпителии – 4,3 ± 0,34 баллов.
Содержание APAF-1 оказалось достоверно (p<0,05) ниже по сравнению с пролиферативным эндометрием. Так при простой гиперплазии APAF-1 составил 0,4 ± 0,08 и 0,8 ± 0,12 баллов в стромальном и эпителиальном компонентах слизистой оболочки матки соответственно; при сложном морфологическом варианте типичной гиперплазии эндометрия - 0,96 ± 0,13 баллов в строме и 2,38 ± 0,21 баллов в эпителии (рис. 4.28).
99

*р<0,05 – различия статистически достоверны по сравнению с контролем ** р<0,05 – различия статистически достоверны по сравнению с ПГЭ
Рис. 4.28 Иммуногистохимические показатели APAF-1 в эндометрии пациенток (баллы)
При молекулярно-биологическом исследовании экспрессии генов VEGF, рецепторов к эстрадиолу (ERα и ERβ) и прогестерону PR установлено.
Как видно из рисунка 4.29, экспрессия гена VEGF в эндометрии при гиперплазии была достоверно повышена, по сравнению с эндометрием фазы пролиферации, и достоверно не различалась при ПГЭ и СГЭ.
*-p<0,05 – различия статистически достоверны по сравнению с эндометрием фазы пролиферации.
Рис. 4.29 Показатели экспрессии и накопления VEGF в эндометрии пациенток (усл.ед.).
Показатель VEGF в пролиферативном эндометрии был 4,62 ± 0,40 усл. ед., в образцах простой и сложной гиперплазии – 6,71 ± 0,21 и 7,31 ± 0,31 усл.ед. соответственно. Что достоверно отличалось между содержанием VEGF в пролиферативном эндометрии и в образцах простой и сложной гиперплазии (рис. 4.29).
100
