
- •12.Характеристика простых и сложных белков. Характеристика классов сложных белков: нуклеопротеиды, липопротеиды, гликопротеиды, фосфопротеиды, хромопротеиды, металлопротеиды, флавопротеиды.
- •15. Методы выделения и очистки белков.
- •17. Скорость химических реакций и сущность явления катализа. Теоретические основы и особенности ферментативного катализа. Термодинамические и кинетические характеристики ферментативного катализа.
- •18.Классификация и номенклатура ферментов. Химическая природа ферментов, их функциональные группы. Активный и аллостерический центры.
- •19. Коферменты, простетические группы. Роль витаминов, металлов и других кофакторов в функционировании ферментов.
- •22. Влияние ингибиторов на ферментативную активность. Множественные формы ферментов. Изоферменты.
- •23. Общие представления о механизме ферментативного катализа. Количественная характеристика ферментативных реакций.
- •24. Принципы регуляции ферментативных процессов в клетке и регуляция метаболизма. Регуляция ферментативных процессов количеством субстрата и фермента. Локализация ферментов в клетке.
- •25. Роль нуклеиновых кислот в формировании и свойствах живой материи. Основной постулат молекулярной биологии. Строение нуклеиновых кислот. Пуриновые и пиримидиновые основания. Углеводные компоненты.
- •26. Нуклеозиды и нуклеотиды. Нуклеотидный состав днк. Правила Чаргаффа. Нуклеозиды, нуклеотиды
- •27. Первичная, вторичная и третичная структура днк. Функциональная организация
- •28. Общая характеристика рнк. Виды рнк. Особенности структуры, синтеза и функции м-рнк, т-рнк и р-рнк..
- •30. Регуляция синтеза белка у прокариот Мутации, их виды и последствия.
- •31.Ферментативный гидролиз белков. Протеолитические ферменты, их специфичность, активация.
- •32. Общая схема источников и расходования аминокислот в организме. Незаменимые аминокислоты. Общие пути катаболизма аминокислот.
- •34. Образование аммиака. Транспорт аммиака. Восстановительное аминирование. Амиды и их физиологическое значение.
- •35. Особенности обмена отдельных аминокислот и их роль в образовании важнейших биологически активных веществ.
- •36. Биосинтез мочевины. Орнитиновый цикл мочевинообразования.
- •37. Азотистые небелковые вещества (биогенные амины), их синтез, распад и биологическая роль. Нарушения структуры и обмена белков. Наследственные заболевания.
- •38. Алкалоиды, их роль у растений и значение в медицине
- •39. Углеводы и их биологическая роль, классификация и номенклатура.
- •40. Структура, свойства и распространение в природе основных представителей моносахаридов и полисахаридов. Гликопротеины и гликолипиды. Взаимопревращения моносахаридов.
- •4 1. Анаэробный и аэробный распад углеводов. Энергетическая характеристика аэробной и анаэробной фазы углеводного обмена.
- •42. Гликолиз. Спиртовое брожение.
- •43 Биосинтез полисахаридов. Гликозил-трансферазные реакции. Гликогенез
- •44. Окислительное декарбоксилирование пировиноградной кислоты. Пируватдегидрогеназный комплекс.
- •45. Цикл трикарбоновых кислот. Окислительное фосфорилирование на уровне субстрата. Прямое окисление глюкозо-6-фосфата.
- •47.Макроэргические соединения. Нуклеозидфосфаты, атф, креатинфосфат и аргининфосфат. Пути образования атф и других макроэргических соединений.
- •48.Окислительное фосфорилирование. Окислительно-востановительные процессы.
- •49. Цепь переноса водорода и электронов (дыхательная цепь).
- •52. Окислительное фосфорилирование в дыхательной цепи. Представление о механизмах сопряжения окисления и фосфорилирования в дыхательной цепи.
- •55. Жирные кислоты, их классификация и номенклатура. Простагландины.
- •56.Ферментативный распад и синтез липидов. Окисление жирных кислот, биосинтез жирных кислот. Мультиферментные комплексы синтеза жирных кислот.
- •57. Кетоновые тела, структура, синтез, утилизация в тканях.
- •60.Хим природа и физиол роль важнейших гормонов, их роль в регуляции обмена в-в и синтеза белков.
- •62. Связь между обменом белков, углеводов и липидов. Обмен веществ как единая система процессов.
23. Общие представления о механизме ферментативного катализа. Количественная характеристика ферментативных реакций.
Ферменты — высокоэффективные катализаторы. Они повышают скорость катализируемой реакции в 1012 раз и более.
Кинетика ферментативных реакций - раздел энзимологии, изучающий зависимость скорости химических реакций, катализируемых ферментами, от химической природы реагирующих веществ, а также от факторов окружающей среды. Скорость ферментативной реакции - мера каталитической активности фермента, ее обозначают как активность фермента. Математически скорость ферментативной реакции выражается в изменении концентрации субстрата (уменьшение) или продукта (увеличение) за единицу времени.
К числу главных факторов, влияющих на скорость ферментативных реакций, относятся: концентрация фермента, концентрация субстрата, присутствие ингибиторов или активаторов, рН и температура среды.
Процесс ферментативного катализа условно можно разделить на следующие три стадии:
1) Е + S -— ES (К - k1/k-1) (быстрая) 2) ES-----ЕР (к2)(медленная) 3) ЕР —- Е + Р
Таким образом, в момент равновесия скорости образования и исчезновения комплекса (ES) равны: Е + S — ES-----ЕР — Е + Р
Из
уравнения Михаэлнса следует, что Кт
численно равна конц. субстрата, при
которой скорость реакции равна половине
максимальной; действительно, при условии,
что V= Vmax/2, имеем:
![]()
Более
удобно для определения величин Vmax и Кт
использовать графики линеаризированых
форм уравнения Михаэлиса:
![]()
его
называют уравнением Лайнуивера-Берка.
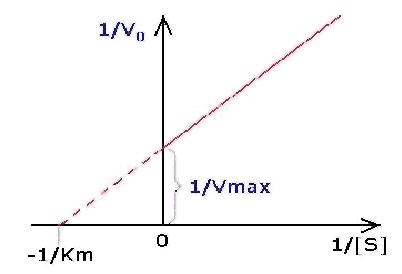
![]()
Для характеристики способности ферментов изменять скорость реакций введено понятие активности. Активность выражают в каталах: 1 кат – количество фермента, которое превращает 1 моль субстрата за 1 с. Другой единицей активности является международная единица (E) – количество фермента, превращающего 1 мкмоль субстрата в 1 мин (1 E = 16,7 нкат).
Ферменты специфически связывают реагенты (свои субстраты) в активном центре. При этом субстраты ориентируются таким образом, что приобретают оптимальное положение для образования переходного состояния. Сближение и необходимая ориентации реагентов значительно повышают вероятность образования продуктивного комплекса. Кроме того, связывание субстрата в активном центре приводит к удалению гидратной оболочки субстрата. В результате удаления молекул воды в активном центре фермента во время катализа создаются совершенно другие условия, чем в растворе. Еще одним важным фактором является стабилизация переходного состояния вследствие взаимодействия между аминокислотными остатками белка и субстратом. Таким образом, переходное состояние в случае ферментативной реакции требует меньшей энергии активации. Кроме того, многие ферменты во время катализа переносят специфические группировки с субстрата или на субстрат. Особенно часто осуществляется перенос протонов. Этот ферментативный кислотно-основной катализ значительно более эффективен, чем обмен протонов с кислотами и основаниями в растворе. Часто химические группировки ковалентно присоединяются к остаткам фермента. Это явление называют ковалентным катализом.
