
- •12.Характеристика простых и сложных белков. Характеристика классов сложных белков: нуклеопротеиды, липопротеиды, гликопротеиды, фосфопротеиды, хромопротеиды, металлопротеиды, флавопротеиды.
- •15. Методы выделения и очистки белков.
- •17. Скорость химических реакций и сущность явления катализа. Теоретические основы и особенности ферментативного катализа. Термодинамические и кинетические характеристики ферментативного катализа.
- •18.Классификация и номенклатура ферментов. Химическая природа ферментов, их функциональные группы. Активный и аллостерический центры.
- •19. Коферменты, простетические группы. Роль витаминов, металлов и других кофакторов в функционировании ферментов.
- •22. Влияние ингибиторов на ферментативную активность. Множественные формы ферментов. Изоферменты.
- •23. Общие представления о механизме ферментативного катализа. Количественная характеристика ферментативных реакций.
- •24. Принципы регуляции ферментативных процессов в клетке и регуляция метаболизма. Регуляция ферментативных процессов количеством субстрата и фермента. Локализация ферментов в клетке.
- •25. Роль нуклеиновых кислот в формировании и свойствах живой материи. Основной постулат молекулярной биологии. Строение нуклеиновых кислот. Пуриновые и пиримидиновые основания. Углеводные компоненты.
- •26. Нуклеозиды и нуклеотиды. Нуклеотидный состав днк. Правила Чаргаффа. Нуклеозиды, нуклеотиды
- •27. Первичная, вторичная и третичная структура днк. Функциональная организация
- •28. Общая характеристика рнк. Виды рнк. Особенности структуры, синтеза и функции м-рнк, т-рнк и р-рнк..
- •30. Регуляция синтеза белка у прокариот Мутации, их виды и последствия.
- •31.Ферментативный гидролиз белков. Протеолитические ферменты, их специфичность, активация.
- •32. Общая схема источников и расходования аминокислот в организме. Незаменимые аминокислоты. Общие пути катаболизма аминокислот.
- •34. Образование аммиака. Транспорт аммиака. Восстановительное аминирование. Амиды и их физиологическое значение.
- •35. Особенности обмена отдельных аминокислот и их роль в образовании важнейших биологически активных веществ.
- •36. Биосинтез мочевины. Орнитиновый цикл мочевинообразования.
- •37. Азотистые небелковые вещества (биогенные амины), их синтез, распад и биологическая роль. Нарушения структуры и обмена белков. Наследственные заболевания.
- •38. Алкалоиды, их роль у растений и значение в медицине
- •39. Углеводы и их биологическая роль, классификация и номенклатура.
- •40. Структура, свойства и распространение в природе основных представителей моносахаридов и полисахаридов. Гликопротеины и гликолипиды. Взаимопревращения моносахаридов.
- •4 1. Анаэробный и аэробный распад углеводов. Энергетическая характеристика аэробной и анаэробной фазы углеводного обмена.
- •42. Гликолиз. Спиртовое брожение.
- •43 Биосинтез полисахаридов. Гликозил-трансферазные реакции. Гликогенез
- •44. Окислительное декарбоксилирование пировиноградной кислоты. Пируватдегидрогеназный комплекс.
- •45. Цикл трикарбоновых кислот. Окислительное фосфорилирование на уровне субстрата. Прямое окисление глюкозо-6-фосфата.
- •47.Макроэргические соединения. Нуклеозидфосфаты, атф, креатинфосфат и аргининфосфат. Пути образования атф и других макроэргических соединений.
- •48.Окислительное фосфорилирование. Окислительно-востановительные процессы.
- •49. Цепь переноса водорода и электронов (дыхательная цепь).
- •52. Окислительное фосфорилирование в дыхательной цепи. Представление о механизмах сопряжения окисления и фосфорилирования в дыхательной цепи.
- •55. Жирные кислоты, их классификация и номенклатура. Простагландины.
- •56.Ферментативный распад и синтез липидов. Окисление жирных кислот, биосинтез жирных кислот. Мультиферментные комплексы синтеза жирных кислот.
- •57. Кетоновые тела, структура, синтез, утилизация в тканях.
- •60.Хим природа и физиол роль важнейших гормонов, их роль в регуляции обмена в-в и синтеза белков.
- •62. Связь между обменом белков, углеводов и липидов. Обмен веществ как единая система процессов.
1. Введение и краткая история биохимии. Роль и место биохимии в системе естественных наук. Значение биохимии для промышленности, сельского хозяйства и медицины. Изучение химии живых организмов, т. е. биохимии, тесно связано с общим бурным развитием биологии в XX в. Значение биохимии заключается в том, что она дает фундаментальное понимание физиологии, иными словами, понимание того, как работают биологические системы. Это в свою очередь находит применение в сельском хозяйстве (создание пестицидов, гербицидов и т. п.); в медицине (включая всю фармацевтическую промышленность); в различных бродильных производствах, которые поставляют нам широкий ассортимент продуктов, в том числе и хлебо-булочных изделий; наконец во всем, что связано с пищей и питанием, т. е. в диететике, в технологии производства пищевых продуктов и в науке об их хранении. С биохимией связано и появление ряда новых перспективных направлений в биологии, таких как генная инженерия, биотехнология или молекулярный подход к изучению генетических болезней. Биохимия играет также важную объединяющую роль в биологии. При рассмотрении живых организмов на биохимическом уровне чаще бросаются в глаза не столько различия между ними, сколько их сходство. Краткая история биохимии. Б. сформировалась как самостоятельная наука в конце 19 в., хотя истоки её относятся к далёкому прошлому. С 1-й половины 16 в. и до 2-й половины 17 в. свой вклад в развитие химии и медицины вносили ятрохимики (химики-врачи): немецкий врач и естествоиспытатель Ф. Парацельс, голландские учёные Я. Б. ван Гельмонт, Ф. Сильвий и др., занимавшиеся исследованием пищеварительных соков, жёлчи, а также процессов брожения. Сильвий, прославленный врач, придавал особенно большое значение правильному соотношению в организме человека кислот и щелочей; он полагал, что в основе многих, если не всех, болезней лежит расстройство этого соотношения. Великие открытия в области физики и химии 18 и начала 19 вв. (открытие ряда простых веществ и соединений, формулировка газовых законов, открытие законов сохранения материи и энергии) заложили научный фундамент общей химии. После открытия в составе воздуха кислорода голландский ботаник Я. Ингенхауз смог описать постоянное образование растением СО2 и выделение на солнечном свету зелёными частями растения кислорода. Опытами Ингенхауза было положено начало исследованию дыхания растений и процессов фотосинтеза, детальное изучение которых продолжается и в настоящее время. В конце 1-й четверти 19 в. было известно очень ограниченное количество органических веществ. Шведский учёный И. Берцелиус считал, что органические тела разделяются на два четко разграниченных класса — на растения и животные; сущность живого тела основана не на его неорганических элементах, а на чём-то ином. Начиная со 2-й половины 19 в. органическая химия становится всё больше химией синтетической, усилия которой направляются на получение новых соединений углерода, особенно имеющих промышленное значение; в её задачи уже не входит исследование состава растительных и животных объектов. Эти сведения поступали случайно в результате побочной работы химиков, ботаников, физиологов растений и животных, а также патологов и врачей, включавших в круг своих интересов химические исследования. Так, в 1814 русский химик К. С. Кирхгоф описал осахаривание крахмала под влиянием вытяжки из проросших семян ячменя: действие амилазы. К середине 19 в. были описаны и другие ферменты: амилаза слюны, расщепляющая полисахариды; пепсин желудочного сока и трипсин сока поджелудочной железы, расщепляющие белки. Берцелиус ввёл в химию понятие катализаторов, к числу которых были отнесены все известные в то время ферменты. Содержание в скелетных мышцах молочной кислоты и её накопление при работе установил немецкий химик Ю. Либих. В 1839 он же выяснил, что в состав пищи входят белки, жиры и углеводы, являющиеся главными составными частями животных и растительных организмов. В середине 19 в. была установлена структура жира и осуществлен его синтез французским химиком П. Бертло; синтез углеводов был проведён русским учёным А. М. Бутлеровым; он же предложил теорию строения органических соединений, сохранившую своё значение и поныне. В числе учёных, изучавших брожение, были Ю. Либих и французский учёный Л. Пастер. Пастер пришёл к выводу, что брожение — биологический процесс, в котором обязательно участвуют живые дрожжевые клетки. Либих же рассматривал сбраживание сахара как сложную химическую реакцию. В конце 19 века и в 20 в. развитие Б. приобрело выраженный специализированный характер в зависимости от разрабатываемой проблемы и объекта исследования. Б. растений развивалась по преимуществу на кафедрах ботаники и физиологии растений. Тесно связана с ней и Б. микроорганизмов. Белки, углеводы, липиды, витамины, являющиеся составными частями растений, животных и микроорганизмов, исследовали биохимики всех стран на самых различных объектах.
2. Структура клетки и биохимическая характеристика отдельных субклеточных компонентов. Клетки являются обязательными структурными элементами всех известных живых организмов. Клетки необычайно разнообразны по своим размерам, форме, внутренней структуре и функции. Огромное разнообразие клеток существует в виде одноклеточных организмов. В многоклеточных организмах клетки специализированы: следовательно, большое число различных типов клеток может существовать внутри одного организма. В организме человека число типов превышает двухсот.Многоклеточные организмы зарождаются из единственной клетки, обычно из оплодотворенного яйца. Дальнейшее развитие организма происходит путем ряда делений, сопровождающихся последовательным изменением клеток от поколения к поколению, приводящим к высокоспециализированным клеткам. Этот процесс известен как клеточная дифференцировка.Рост и развитие организма осуществляется за счет клеточного деления. Информация, необходимая как для получения двух дочерних клеток, идентичных материнской, так и запрограммированных изменений в процессе дифференцировки, поставляется молекулами ДНК. Обязательным процессом, происходящим при клеточном делении, является репликация (удвоение) ДНК. Во время жизненного цикла клетки возможно повреждение ДНК. Реставрация поврежденных ДНК осуществляется в процессе репарации.Для синтеза биополимеров (белков, РНК, ДНК) необходимо наличие в клетке достаточного количества соответствующих мономеров. Химические реакции распада «отработавших» полимеров, и синтеза мономеров, а из них новых полимеров составляют метаболизм клетки.Синтез полимеров требует притока энергии. Клетка может использовать только свободную энергию, запасенную в виде химической энергии высокоэнергетических связей. Во всех живых организмах такими связями являются Р–О–Р-связи остатка трифосфорной кислоты аденозинтрифосфата (ATP). При гидролизе АТР до аденозиндифосфата (ADP) или аденозинмонофосфара (AMP) высвобождается энергия, которая и обеспечивает протекание всех энергетически невыгодных процессов в клетке.Очевидно, что для нормальной жизнедеятельности клетки необходимо постоянно восполнять потерю АТР. Это происходит в энергетических системах клетки. Зеленые растения непосредственно используют для фосфорилирования ADP энергию солнечного света. Весь процесс называется фотосинтезом, а превращение ADP в АТР — фотосинтетическим фосфорилированием.Огромное число живых организмов не обладает системой для фотосинтеза, а в качестве источника энергии используют окисление органических соединений (преимущественно глюкозы и жирных кислот) кислородом воздуха. В этом случае процесс называют окислительным фосфорилированием.Все типы живых клеток делят на два основных класса: прокатиотические и эукариотические. Наиболее замечательная особенность последних заключается в наличии специальной внутриклеточной структуры — ядра, которое содержит преобладающую часть ДНК. Ядро отделено от внутреннего содержимого клетки — цитоплазмы — ядерной мембраной. В ядре эукариотической клетки ДНК существует в виде хромосом, состоящих из ДНК и специальных белков — гистонов. В более примитивных прокариотических клетках ДНК не выделяется специальной мембраной.. Клетка как химический реактор. Живая клетка является своеобразным химическим реактором, в котором протекает одновременно более тысячи химических реакций. Большинство процессов представляют собой цепи последовательных реакций, включающие от 2 до 20 стадий. Кроме того, компоненты отдельных процессов или условия их протекания порой несовместимы между собой. Очевидно, что возможность жизнедеятельности клетки невозможна без строгой организации всех этих процессов и разделения в пространстве несовместимых процессов. Организация процессов метаболизма включает образование сложных надмолекулярных структур, состоящих из нескольких белков, а порой и нуклеиновых кислот, которые обеспечивают протекание сложных метаболических процессов (например, рибосомы синтезирующие белки), часть процессов протекает не в цитоплазме, а в ферментных структурах, прикрепленных к внутренней мембране, наконец, для процессов, несовместимых с цитоплазматическими, в клетке существуют как-бы маленькие клеточки, отделенные от цитоплазмы собственной мембраной. К таким образованиям, кроме упомянутого выше ядра относятся лизосомы, митохондрии и ряд других. Такое явление разделения в пространстве отдельных метаболических процессов называют компартментализацией.
3.Аминокислотный
состав белков. Классификация аминокислот.
Протеиногенные и непротеиногенные
аминокислоты.
Несмотря
на то что первая аминокислота – глицин
– была выделена А. Браконно еще в 1820 г.
из кислотного гидролизата желатина,
полный аминокислотный состав белков
был расшифрован только к 30-м годам XX в.
Большая заслуга в этом принадлежит
работам Н.Н. Любавина, который в 1871 г.
установил, что под действием ферментов
пищеварительных соков белки расщепляются
на аминокислоты.Были сделаны два важных
вывода: 1) в состав белков входят
аминокислоты; 2) методами гидролиза
может быть изучен химический, в частности
амнокислотный, состав белков. Для
изучения аминокислотного состава белков
пользуются сочетанием кислотного (НСl),
щелочного [Ва(ОН)2] и, реже, ферментативного
гидролиза или одним из них. Установлено,
что при гидролизе чистого белка, не
содержащего примесей, освобождаются
20 различных α-аминокислот. Все другие
открытые в тканях животных, растений и
микроорганизмов аминокислоты (более
300) существуют в природе в свободном
состоянии либо в виде коротких пептидов
или комплексов с другими органическими
веществами.α-Аминокислоты представляют
собой производные карбоновых кислот,
у которых один водородный атом, у
α-углерода, замещен на аминогруппу
(—NH2), например: R – CH2 (β) – CH2 (α) – COOH
жирная кислота, R – CH (α) – COOH α-аминокислота
( где СН группа, снизу черточка и NH2).
Аминокислоты делят на протеиногенные
(входят в состав белков - их 20) которые
кодиpyютcя генетичеcким кодом и постоянно
oбнapyживaютcя в белкax .Некоторые из них
пoдвеpгaютcя посттрансляционной
модификации, т.е. мoгyт быть фocфopилиpовaны,
aцилиpoваны или гидpoксилирoваны. и
непротеиногенные (встречаются в растениях
в свободном виде - их около 200).Все
встречающиеся в природе аминокислоты
обладают общим свойством – амфотерностью,
т.е. каждая аминокислота содержит как
минимум одну кислотную и одну основную
группы. Общий тип строения α-аминокислот
может быть представлен в следующем
виде:
![]()
Как видно из общей формулы, аминокислоты будут отличаться друг от друга химической природой радикала R, представляющего группу атомов в молекуле аминокислоты, связанную с α-углеродным атомом и не участвующую в образовании пептидной связи при синтезе белка. Почти все α-амино- и α-карбоксильные группы участвуют в образовании пептидных связей белковой молекулы, теряя при этом свои специфические для свободных аминокислот кислотно-основные свойства. Поэтому все разнообразие особенностей структуры и функции белковых молекул связано с химической природой и физико-химическими свойствами радикалов аминокислот. Именно благодаря им белки наделены рядом уникальных функций, не свойственных другим биополимерам, и обладают химической индивидуальностью. Классификация аминокислот разработана на основе химического строения радикалов. Различают циклические и алифатические (ациклические) аминокислоты. По числу аминных и карбоксильных групп аминокислоты разделяют на:1 – моноаминомонокарбоновые (глицин, аланин, лейцин и др.);2 – диаминомонокарбоновые (лизин, аргинин);3 - моноаминодикарбоновые (аспарагиновая и глутаминовая кислоты);4- диаминодикарбоновые (цистин). Различают 4 класса аминокислот, содержащих следующие радикалы: 1) неполярные (гидрофобные, нейтральные) – глицин, аланин, валин, лейцин, изолейцин, пролин; фенилаланин, триптофан 2) с гидрофобным полярным незаряженным радикалом (нейтральные): серин, треонин, метионин, аспарагин, глутамин. 3) с гидрофильным отрицательно заряженным радикалом (кислые): Аспарагиновая кислота, глутаминовая кислота, тирозин, цистеин. 4) гидрофильным положительно заряженным радикалом (основные): лизин, аргинин, гистидин. Аминокислоты различают по их растворимости в воде. Это связано со способностью радикалов взаимодействовать с водой (гидрироваться). К гидрофильным относят радикалы, содержащие анионные, катионные и полярные незаряженные функциональные группы.К гидрофобным относят радикалы, содержащие метильные группы, алифатические цепи или циклы. Всго существует 20 аминокислот, из них 8 - "незаменимые" (организм не может самостоятельно синтезировать их) - изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин. Эти аминокислоты поступают в организм с мясом, рыбой, яйцами и молочными продуктами. "Условно заменимые" аминокислоты: цистеин и тирозин, синтезируются из незаменимых: фенилааланина и метионина соответсвенно. «Частично заменимые» аргинин и гистидин. "Заменимые" - аланин, аспарагин, аспартовая кислота, глютаминовая кислота, глютамин, глицин, пролин, серин.. Непротеиногенные aминoкиcлoты oбpaзyютcя в качестве прoмeжyточныx продуктов при биоcинтeзе и деградации протеиногенных аминокислот или в цикле мочевины
4. Классификация аминокислот по свойствам их радикалов: неполярные (гидрофобные) аминокислоты, полярные (гидрофильные) аминокислоты, гидрофильные отрицательно заряженные и положительно заряженные. Заменимые, незаменимые, полузаменимые аминокислоты. Аминокисло́ты — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. Современная рациональная классификация аминокислот основана на полярности радикалов (R-групп), т.е. способности их к взаимодействию с водой при физиологических значениях рН (близких к рН 7,0). Различают 4 класса аминокислот, содержащих следующие радикалы: 1) неполярные (гидрофобные, нейтральные) – глицин, аланин, валин, лейцин, изолейцин, пролин; фенилаланин, триптофан 2) с гидрофобным полярным незаряженным радикалом (нейтральные): серин, треонин, метионин, аспарагин, глутамин. 3) с гидрофильным отрицательно заряженным радикалом (кислые): Аспарагиновая кислота, глутаминовая кислота, тирозин, цистеин. 4) С гидрофильным положительно заряженным радикалом (основные): лизин, аргинин, гистидин. Изоэлектрической точки (рI) – рН при котором АК в виде цвиттер-иона.
Перечисленные аминокислоты присутствуют в разных количественных соотношениях и последовательностях в тысячах белков, хотя отдельные индивидуальные белки не содержат полного набора всех этих аминокислот. Помимо наличия в большинстве природных белков 20 аминокислот, в некоторых белках обнаружены производные аминокислот : оксипролин, оксилизин, дийодтирозин, фосфосерин и фосфотреонин. Всего существует 20 аминокислота, из них 8 - так называемые "незаменимые" (организм не может самостоятельно синтезировать их в достаточном количестве) - изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин. Эти аминокислоты поступают в организм с мясом, рыбой, яйцами и молочными продуктами. "Условно заменимые" аминокислоты: цистеин и тирозин. Отличаются они от остальных тем, что организм может использовать их вместо, соответственно, метионина и фенилаланина для производства белка.. «Частично заменимые» аргинин и гистидин. "Заменимые" - аланин, аспарагин, аспартовая кислота, глютаминовая кислота, глютамин, глицин, пролин, серин.
5.Физико-химические
свойства аминокислот. Кислотно-основные
свойства аминокислот. Амфотерность.
Изоэлектрическая точка. Буферные
свойства.
Аминокисло́ты
— органические соединения, в молекуле
которых одновременно содержатся
карбоксильные и аминные
группы.
Кислотно-основные свойства.
Эти свойства аминокислот определяют
многие физико-химические и биологические
свойства белков. На этих свойствах
основаны, кроме того, почти все методы
выделения и идентификации аминокислот.
Аминокислоты легко растворимы в воде.
Они кристаллизуются из нейтральных
водных растворов в форме биполярных
(амфотерных) ионов (цвиттерионов), а не
в виде недиссоциированных молекул
(последнюю структуру приводят для
удобства представления, однако все
аминокислоты при физиологических
значениях рН имеют структуру
цвиттериона).Цвиттерон:
![]() При
растворении в воде кристаллическая
аминокислота, например аланин, может
реагировать или как H++ NH3CH(CH3)COO или
каккислота
(донатор протона):+NH3CH(CH3)COO- NH3CH(CH3)COOH.
Еслиоснование
(акцептор протона): H++ NH3CH(CH3)COO радикалы
аминокислот нейтральные, то они почти
не оказывают влияния на диссоциацию
α-карбоксильной группы или α-аминогруппы,
и величины рК (отрицательный логарифм
константы диссоциации) остаются
относительно постоянными. Вследствие
этого кривые диссоциации почти всех
нейтральных аминокислот накладываются
друг на друга и могут быть рассмотрены
на примере аланина.
молекулы аланина
являются полностью протонированными
и несут положительный заряд. Из кривой
титрования видно, что точка перехода
между ветвями кривой располагается при
рН 6,02. Это означает, что при данном
значении рН суммарный (или средний)
электрический заряд молекулы аланина
равен нулю и она не перемещается в
электрическом поле ни к аноду, ни к
катоду (изоэлектрическое состояние).
Такое значение рН получило название
изоэлектрической точки и обозначается
pI. Изоэлектрическая точка аминокислот,
не содержащих дополнительных NH2- или
СООН-групп, представляет собой среднее
арифметическое между двумя значениями
рК':pl=(〖pK〗^COOH+〖pK〗^NH2)/2
. Изоэлектрическая точка ряда других
аминокислот, содержащих дополнительные
кислотные или основные группы
(аспарагиновая и глутаминовая кислоты,
лизин, аргинин, тирозин и др.), зависит,
кроме того, от кислотности или основности
радикалов этих аминокислот.
При
растворении в воде кристаллическая
аминокислота, например аланин, может
реагировать или как H++ NH3CH(CH3)COO или
каккислота
(донатор протона):+NH3CH(CH3)COO- NH3CH(CH3)COOH.
Еслиоснование
(акцептор протона): H++ NH3CH(CH3)COO радикалы
аминокислот нейтральные, то они почти
не оказывают влияния на диссоциацию
α-карбоксильной группы или α-аминогруппы,
и величины рК (отрицательный логарифм
константы диссоциации) остаются
относительно постоянными. Вследствие
этого кривые диссоциации почти всех
нейтральных аминокислот накладываются
друг на друга и могут быть рассмотрены
на примере аланина.
молекулы аланина
являются полностью протонированными
и несут положительный заряд. Из кривой
титрования видно, что точка перехода
между ветвями кривой располагается при
рН 6,02. Это означает, что при данном
значении рН суммарный (или средний)
электрический заряд молекулы аланина
равен нулю и она не перемещается в
электрическом поле ни к аноду, ни к
катоду (изоэлектрическое состояние).
Такое значение рН получило название
изоэлектрической точки и обозначается
pI. Изоэлектрическая точка аминокислот,
не содержащих дополнительных NH2- или
СООН-групп, представляет собой среднее
арифметическое между двумя значениями
рК':pl=(〖pK〗^COOH+〖pK〗^NH2)/2
. Изоэлектрическая точка ряда других
аминокислот, содержащих дополнительные
кислотные или основные группы
(аспарагиновая и глутаминовая кислоты,
лизин, аргинин, тирозин и др.), зависит,
кроме того, от кислотности или основности
радикалов этих аминокислот.
Цвиттерионы АК-т являются амфотерными соединениями, т. е. могут проявлять как свойства и кислот, так и свойства оснований. Если при этом значении pH поместить аминокислоту в электрическое поле, то она не будет перемещаться ни к катоду, ни к аноду. Амфотерные свойства аминокислот обусловливают то, что в растворах аминокислоты могут действовать как кислотно-основные буферные системы, компенсирующие изменения кислотности (щёлочности) раствора, характеризуемой pH. При добавлении в раствор аминокислот щёлочи, то есть при повышении pH аминокислоты являются донорами катионов, например H+, (и/или акцепторами анионов и/или электронов). При этом аминокислоты отдают катионы водорода, приобретают отрицательный заряд. В электрическом поле такая заряженная аминокислота будет перемещаться к положительному электроду (аноду). При добавлении в раствор кислоты, то есть при понижении pH аминокислоты являются акцепторами катионов, например H+, (и/или донорами анионов и/или электронов). В результате при любом изменении кислотности буферного раствора аминокислота восстанавливает исходный уровень pH, компенсируя внешнее влияние на раствор щелочи или кислоты. Её суммарный заряд опять становится нейтральным. Аминокислоты занимают центральное место в метаболизме азотистых веществ в организме. Они входят в состав белков, пептидов, участвуют в биосинтезе пуринов, пиримидинов, витаминов, медиаторов, алкалоидов и др. соединений. Катаболизм аминокислот (по преимуществу в печени, почках) путём дезаминирования главным образом глутаминовой кислоты, приводит к образованию кето- и оксикислот. Далее они превращаются в углеводы, новые аминокислоты или окисляются с выделением энергии до двуокиси углерода, CO2 и воды, H2O. При этом азот в виде аммонийных солей, мочевины и мочевой кислоты выводится из организма. В тканях встречаются аминокислоты (гаммааминомасляная кислота) не входящие в состав белков.
6. Реакции на аминогруппу и карбоксильную группу. Реакции на отдельные аминокислоты. Нингидриновая реакция (Руэманна). α-Аминокислоты реагируют с нингидрином, образуя сине-фиолетовый комплекс (пурпур Руэманна), интенсивность окраски которого пропорциональна количеству аминокислоты. Реакция с нингидрином используется для визуального обнаружения α-аминокислот на хроматограммах, а также для колориметрического определения концентрации аминокислот по интенсивности окраски продукта реакции.
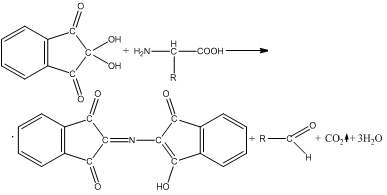
Образование
комплексов с металлами.
α-Аминокислоты образуют с катионами
тяжелых металлов внутрикомплексные
соли. Со свежеприготовленным гидроксидом
меди(II) все α-аминокислоты в мягких
условиях дают хорошо кристаллизующиеся
внутрикомплексные (хелатные) соли
меди(II) синего цвета: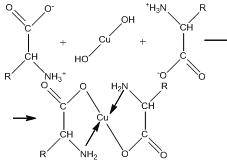
Реакция с формальдегидом. При взаимодействии α-аминокислот с формальдегидом образуются относительно устойчивые карбиноламины. Эта реакция лежит в основе количественного определения аминокислот методом формального титрования:
![]()
Реакция Сакагучи (на аргинин). Эта реакция основана на взаимодействии аргинина с α-нафтолом в присутствии окислителя. Ее механизм еще полностью не выяснен. По-видимому, реакция осуществляется по следующему уравнению:
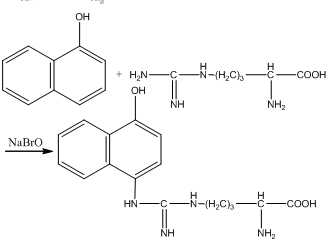
Реакция Фоля (на серосодержащие аминокислоты). При щелочном гидролизе «слабосвязанная сера» в цистеине и цистине достаточно легко отщепляется, в результате чего образуется сероводород, который, реагируя со щелочью, дает сульфиды натрия или калия. При добавлении ацетата свинца(II) образуется осадок сульфида свинца(II) серо-черного цвета.
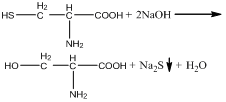
![]()
Реакция Циммермана (на глицин). Основана на взаимодействии углеродов альдегидных групп с азотом аминогруппы и углеродом α-положения аминокислоты.
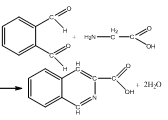
Ксантопротеиновая реакция (на аминокислоты с ароматическим радикалом). Тирозин, триптофан, фенилаланин при взаимодействии с концентрированной азотной кислотой образуют нитропроизводные, имеющие желтую окраску. В щелочной среде нитропроизводные этих α-аминокислот дают соли, окрашенные в оранжевый цвет:
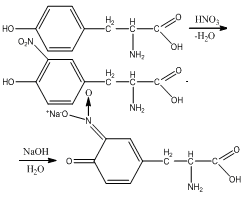
Реакция на триптофан.
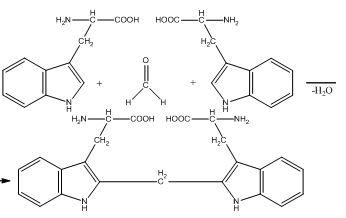
7.Способы связывания аминокислот в белке. Пептидные, дисульфидные, ионные, гидрофобные взаимодействия и водородные связи.
Пептиды и белки – высокомолекулярные соединения, построенные из остатков α-аминокислот. Условно пептидами считают соединения, содержащие до 100, а белками – свыше 100 аминокислотных остатков. Среди пептидов, в свою очередь, различают олигопептиды (до 10 остатков аминокислот) и полипептиды (от 10 до 100 остатков).
Пептиды и белки характеризуются особенностью аминокислотного состава, т.е. природой и количественным соотношением входящих в них α-аминокислот. Аминокислоты объединяются посредством пептидной связи в цепочки различной длинны и образуют таким образом первичную структуру белков и пептидов:
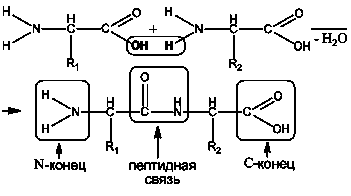
Каждая полипептидная цепь имеет N-конец, на котором находится свободная концевая аминогруппа и С-конец, образованный концевой свободной карбоксильной группой.
В результате взаимодействия боковых групп аминокислотных остатков отдельные относительно небольшие участки полипептидной цепи принимают ту или иную конформацию, известную как вторичная структура белков. Стабилизируются такие конформации водородными связями (обр-ся альфа бетта спирали и бетта складчатые структуры).
Дальнейшая пространственная укладка вторичных структур приводит к образованию третичной структуры, стабилизированной четырьмя типами межмолекулярных взаимодействий:
ковалентные связи между двумя остатками цистеина – дисульфидные мостики (I)
ионные связи между двумя противоположно заряженными боковыми группами аминокислотных остатков (II)
водородные связи (III)
гидрофобные взаимодействия (играют главную роль) (IV)
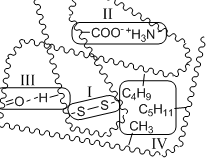
По форме пространственной укладки белки можно разделить на две основные группы:
фибриллярные – образованы несколькими спиралями, свернутыми в суперспираль (супервторичная структура Коллаген
глобулярные белки – имеют сферическую форму (третичная структура). Большинство этих белков водорастворимы.
8.Структурная организация белков. Первичная, вторичная, третичная и четвертичная структура белков. Пептиды и белки – высокомолекулярные соединения, построенные из остатков α-аминокислот. Условно пептидами считают соединения, содержащие до 100, а белками – свыше 100 аминокислотных остатков.
Пептиды и белки характеризуются особенностью аминокислотного состава, т.е. природой и количественным соотношением входящих в них α-аминокислот. Аминокислоты объединяются посредством пептидной связи в цепочки различной длинны и образуют таким образом первичную структуру белков и пептидов:
В результате взаимодействия боковых групп аминокислотных остатков отдельные относительно небольшие участки полипептидной цепи принимают ту или иную конформацию, известную как вторичная структура белков. Существуют 2 главнейших типа вторичной структуры: 1) Альфа-спираль. Для белков характерна правозакрученная спираль. Фиксируется альфа-спираль с помощью водородных связей между NH-группами одного витка спирали и С=О группами соседнего витка. Эти водородные связи расположены параллельно оси спирали и многократно повторяются, поэтому прочно удерживают спиралеобразную структуру. Более того, удерживают в несколько напряженном состоянии (как сжатую пружину).
2) Бета-складчатая структура - или структура складчатого листа. Фиксируется также водородными связями между С=О и NH-группами. Фиксирует два участка полипептидной цепи. Эти цепи могут быть параллельны или антипараллельны (изгибы). Если такие связи образуются в пределах одного пептида, то они всегда антипараллельны, а если между разными полипептидами, то параллельны.
Д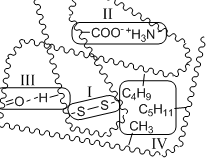 альнейшая
пространственная укладка вторичных
структур приводит к образованию третичной
структуры,
стабилизированной четырьмя типами
межмолекулярных взаимодействий:
альнейшая
пространственная укладка вторичных
структур приводит к образованию третичной
структуры,
стабилизированной четырьмя типами
межмолекулярных взаимодействий:
ковалентные связи между двумя остатками цистеина – дисульфидные мостики (I)
ионные связи между двумя противоположно заряженными боковыми группами аминокислотных остатков (II)
водородные связи (III)
гидрофобные взаимодействия (играют главную роль) (IV)
1) В фибриллярных белках (например, коллаген, эластин) молекулы которых имеют вытянутую форму и обычно формируют волокнистые структуры тканей, третичная структура представлена либо тройной альфа-спиралью (например, в коллагене), либо бета-складчатыми структурами. 2) В глобулярных белках, молекулы которых имеют форму шара или эллипса, встречается сочетание всех трех типов структур: всегда есть нерегулярные участки, есть бета-складчатые структуры и альфа-спирали. Обычно в глобулярных белках гидрофобные участки молекулы находятся в глубине молекулы.
ЧЕТВЕРТИЧНАЯ СТРУКТУРА
Белковые молекулы часто образуют четвертичные структуры, симметрично построенные комплексы, стабилизированные за счет нековалентных взаимодействий. Такие комплексы называются олигомерами, а составные единицы комплексов (от 2 до 12) – субъединицами или мономерами. В состав таких комплексов входят ионы различных металлов.
Встречается не у всех белков, а только у тех, которые состоят из двух или более полипептидных цепей. Например, молекула гемоглобина «А» состоит из двух субъединиц одного типа и двух субъединиц другого типа, то есть является тетрамером. Фиксируются четвертичные структуры белков всеми типами слабых связей, а иногда еще и дисульфидными связями.
Домен – отдельные уч-ки альфа и бетта структуры. Междомены пространство м\у ними.
9. Структура пептидной связи. Элементы вторичной структуры: альфа-спирал и бета-структура. Домены в структуры белка, их функциональная роль.
Аминокислоты способны соединяться между собой связями, которые называются пептидными, при этом образуется полимерная молекула. Если количество аминокислот не превышает 10, то новое соединение называется пептид; если от 10 до 40 аминокислот – полипептид, если более 40 аминокислот – белок. Пептидная связь –это связь между α-карбоксильной группой одной аминокислоты и α-аминогруппой другой аминокислоты.
При необходимости назвать пептид ко всем названиям аминокислот добавляют суффикс "-ил", только последняя аминокислота сохраняет свое название неизменным..Например, аланил-серил-триптофан или γ-глутаминил-цистеинил-глицин (по-другому называемый глутатион). К свойствам пептидной связи относятся:1. Копланарность Все атомы, входящие в пептидную группу находятся в одной плоскости, при этом атомы "Н" и "О" расположены по разные стороны от пептидной связи. 2.Транс-положение заместителей Радикалы аминокислот по отношению к оси C-N связи находятся по "разные" стороны, в транс-положении.3. Две равнозначные формы Пептидная связь имеет кетоформу и енольную форму. 4. Способность к образованию водородных связей. Атомы углерода и азота, входящие в пептидную связь обладают способностью образовывать две водородные связи с другими пептидными группами. 5. Пептидная связь имеет частично характер двойной связи. Длина пептидной связи меньше, чем одинарной связи, она является жесткой структурой, и вращение вокруг нее затруднено. Но так как, кроме пептидной, в белке есть и другие связи, цепочка аминокислот способна вращаться вокруг основной оси, что придает белкам различную конформацию (пространственное расположение атомов).
В результате взаимодействия боковых групп аминокислотных остатков отдельные относительно небольшие участки полипептидной цепи принимают ту или иную конформацию, известную как вторичная структура белков. Существуют 2 главнейших типа вторичной структуры: 1) Альфа-спираль. Для белков характерна правозакрученная спираль. Фиксируется альфа-спираль с помощью водородных связей между NH-группами одного витка спирали и С=О группами соседнего витка. Эти водородные связи расположены параллельно оси спирали и многократно повторяются, поэтому прочно удерживают спиралеобразную структуру. Более того, удерживают в несколько напряженном состоянии (как сжатую пружину).
2) Бета-складчатая структура - или структура складчатого листа. Фиксируется также водородными связями между С=О и NH-группами. Фиксирует два участка полипептидной цепи. Эти цепи могут быть параллельны или антипараллельны (изгибы). Если такие связи образуются в пределах одного пептида, то они всегда антипараллельны, а если между разными полипептидами, то параллельны.
10. Методы изучения структуры белка. Физико-химические свойства белков. Методы оценки размеров и формы белковых молекул. Денатурация и ренатурация белка.
БЕЛКИ, высокомол. природные полимеры, построенные из остатков аминокислот, соединенных амидной (пептидной) связью —СО—NH—. Каждый БЕЛКИ характеризуется специфический аминокислотной последовательностью и индивидуальной пространств, структурой (конформацией).
Методы выделения и очистки белков. 1 .гомогенизация - клетки растираются до однородной массы; 2.экстракция белков водными или водно-солевыми растворами; 3 .диализ;
Методы разделения белков: Высаливание – основано на различиях раст-мости белков при разной концентрации солей. Соли щелочных и щелочно-земельных металлов вызывают обратимую денатурацию белков (осаждение), т.е. после удаления соли белки снова р-тся сохр-ая свои нативные св-ва.
Электрофорез – основан на движении + заряж-ых мол-л к катоду, - к аноду. Проводят на различных носителях, бумаге, крахмалном геле.
Ультрацентрифугирование – основано на различии в мол-ой массе белка. Разделение под действием центробежной силы, в р-те белки делятся на фракции различной мол-ой массой.
Хроматографические: а) ионообменная хроматография - основана на различной способности отдельных белков к обмену с ионами ионообменных смол; б) на молекулярных ситах (гель-фильтрация) - на сефадексах - белки разделяются в зависимости от величины молекулы; в) аффинная хроматография белки делятся на индивидуальные в зависимости от средства к аффинату (наполнителю колонок).
Аминокислотный состав белков и пептидов после гидролиза опр-ют в аминокислотном анализаторе.
Денатурация – разрушение нативной конформации белка (разрушение слабых связей, не пептидных) Денатур-ие агенты: высокая темп-ра, интенсивное стряхивание р-ра (взаимод-ие с возд. средой), орг. в-ва (фенол) взаимодей-щие с функ-ми группами белков, к-ты и щелочи, соли тяжелых металлов, детергенты (различные мыла). Ренатурация – возвтращение нативной стр-ры белка, например после удаления соли из р-ра.
Физ.-хим. свойства Б. Белки образуют коллоидные растворы (размеры частиц - 0,1-0,001 мкм), для которых важны следующие характеристики: * низкое осмотическое давление; * высокая вязкость; * низкая способность к диффузии.
В лабораторной практике свойства коллоидных растворов белков используют при нефелометрическом определении количества белка на основе эффекта Тиндаля и при очистке белковых растворов от шгзкомолскулярных примесей с помощью полупроницаемых мембран методом диализа.
Белки бывают кислыми и основными. Кислые белки содержат много глу и асп, у которых есть дополнительные карбоксильные и меньше аминогрупп. В щелочных белках много лиз и арг. Каждая молекула белка в водном растворе окружена гидратной оболочкой, так как у белков за счет аминокислот есть много гидрофильных группировок (-СООН, -ОН, -NH2, -SH). В водных растворах белковая молекула имеет заряд. Заряд белка в воде может меняться в зависимости от РН.
Белковая молекула в растворе удерживается зарядом и гидратной оболочкой. Снятие заряда осущетевляется путем подведения рН к изоэлектрической точке.
Удаление гидратной оболочки производится водоотнимающими средствами (органические растворители, соли щелочноземельных металлов), изменением температуры и др.
11. Принципы классификации и номенклатуры белков. Классификация белков: по форме молекулы, составу, структуре и функциям. Глобулярные и фибриллярные белки. Простые и сложные белки. Функциональная классификация белков. Из огромного количества природных белков структура и функции расшифрованы для относительно небольшого числа (не более нескольких сотен), и поэтому структура и функции белков пока не могут служить основой для их рациональной классификации.
I По строению:1 Простые (протеины) состоят только из остатков аминокислот. 2 Сложные (протеиды) при гидролизе образуют аминокислоты и другие соединения (простетическая группа): а) нуклеопротеиды: белок + нуклеиновая кислота, растворимы в щелочах, не растворимы в кислотах, обеспечивают компактное хранение ДНК; б) фосфопротеиды: белок + остаток фосфорной кислоты. Денатурируют при действии кислот (казеин молока) Многие фертменты явл-ся фосфопротеинами; в) глюкопротеиды: белок + углевод. Не растворимы в воде, растворимы в щелочах, нейтральны (слизь) большинство белковых гормонов, гликопротеины мембран эритроцитов, предопределяют группу крови у человека., все антитела, интерфероны, компоненты комплемента, белки плазмы крови, молока, рецепторыне белки;г) хромопротеиды: белок + красящее вещество (гемоглобин с гемом); д) металлопротеины: уч-ют в обмене железа, многие ферменты. е) липопротеины: липиды и жирные кислоты. Явл-ся структурными комп-ми мембран клеток, транспортными белками.
II По растворимости в воде и солевых р-рах: 1 Альбумины – растворимы в воде и слабо в р-рах соли.(овальбумин) 2 Глобулины – растворимы в водных растворах солей (лактоглобулин молока). 3 Глутемины – растворимы в кислотах и щелочах (ориземин семян риса). 4. Проламины – р-ся в в 60-80% р-ре этилового спирта (глиандин пшеницы).
III По форме 1 Глобулярные имеют сложную конформацию: полипептидные цепи свернуты в компактные глобулы. (большинство водорастворимы) 2 Фибриллярные имеют вытянутую, нитевидную форму и состоят из нескольких полипептидных цепей (коллаген)
По Функции белков1 .Каталитическая (ферментативная). Все ферменты -белки. Ни одна реакция в организме не проходит самопроизвольно.
2.Транспортная. Пример: гемоглобин переносит кислород от легких к тканям и СС>2 от тканей к легким. В клеточных мембранах есть белки, переносящие глюкозу, аминокислоты внутрь клетки.
3.Пищевая и запасная (резервная). Пример: яичный альбумин - источник питания. Казеин молока и глиадин пшеницы - источник аминокислот.
4.Рецепторная. Пример: белки биомембран. (родопсин, холинорецептор и т.п.).Играют важную роль при передаче нервного или гормонального сигнала в клетку или ее некоторые компартменты.
5.Сократительная и двигательная. Пример: актин и миозин - белки мышечной ткани.
6.Структурная. Пример: кератин волос, ногтей, коллаген (соединительная ткань), эластин (сосуды), фосфолипопротеины (белки биологических мембран).
7.3ащитная. Пример: антитела сыворотки крови - образуются в ответ на поступление в организм чужеродных веществ (антигенов) (антитела и иммуноглобулины).
8.Регуляторная. В первую очередь к ним относятся гормоны белково-пептидной природы. Эти белки играют основную роль в регуляции клеточной и физиологической активности. Например, гормон инсулин регулируют потребление клетками глюкозы, кальцитонин – содержание кальция в крови и костной ткани.
9.Когенетическая. Совместно с нуклеиновыми кислотами участвуют в хранении и передаче наследственной информации.
10.Сохраняют онкотическое давление в клетках крови, поддерживают физиологическое значение РН внутренней среды организма.
11. Токсические (токсины ботулинический, дифтерийный).Представлены ядами змей, скорпионов, пчел.
12. Антибиотики (актиноксантин, неокарциностатин и т.п.)
12.Характеристика простых и сложных белков. Характеристика классов сложных белков: нуклеопротеиды, липопротеиды, гликопротеиды, фосфопротеиды, хромопротеиды, металлопротеиды, флавопротеиды.
Из огромного количества природных белков структура и функции расшифрованы для относительно небольшого числа (не более нескольких сотен), и поэтому структура и функции белков пока не могут служить основой для их рациональной классификации.
I По строению:1 Простые (протеины) состоят только из остатков аминокислот. 2 Сложные (протеиды) при гидролизе образуют аминокислоты и другие соединения (простетическая группа): а) нуклеопротеиды: белок + нуклеиновая кислота, растворимы в щелочах, не растворимы в кислотах, обеспечивают компактное хранение ДНК; б) фосфопротеиды: белок + остаток фосфорной кислоты. Денатурируют при действии кислот (казеин молока) Многие фертменты явл-ся фосфопротеинами; в) глюкопротеиды: белок + углевод. Не растворимы в воде, растворимы в щелочах, нейтральны (слизь) большинство белковых гормонов, гликопротеины мембран эритроцитов, предопределяют группу крови у человека., все антитела, интерфероны, компоненты комплемента, белки плазмы крови, молока, рецепторыне белки;г) хромопротеиды: белок + красящее вещество (гемоглобин с гемом); д) металлопротеины: уч-ют в обмене железа, многие ферменты. е) липопротеины: липиды и жирные кислоты. Явл-ся структурными комп-ми мембран клеток, транспортными белками.
В зависимости от характера входящей в состав нуклеопротеида нуклеиновой кислоты различают дезоксирибонуклеопротеиды (ДНП) и рибонуклеопротеиды (РНП). ДНП содержатся в ядрах всех клеток (составляют основу ядерного вещества — хроматина) и в головках сперматозоидов. Белковым компонентом ДНП служат преимущественно белки основного характера — гистоны. Гистоны при нейтральных рН несут большой положительный заряд, что обеспечивает возможность сильного электростатического взаимодействия с отрицательно заряженными нуклеиновыми кислотами (регуляция матричной активности ДНК). Из РНП состоят многие вирусы, информосомы, рибосомы. Липопротеиды, комплексы белков и липидов. Представлены в растительных и животных организмах в составе всех биологических мембран, пластинчатых структур (в миелиновой оболочке нервов, в хлоропластах растений, в рецепторных клетках сетчатки глаза) и в свободном виде в плазме крови. По скорости оседания при центрифугировании Л. подразделяют на 4 главных класса: 1) Л. высокой плотности (52% белка и 48% липидов, в основном фосфолипидов); 2) Л. низкой плотности (21% белка и 79% липидов, главным образом холестерина); очень низкой плотности (9% белка и 91% липидов, в основном триглицеридов); 4) хиломикроны (1% белка и 99% триглицеридов). Полагают, что структура Л. мицеллярная (белок связан с липид-холестериновым комплексом за счёт гидрофобного взаимодействия) либо аналогична молекулярным соединениям белков с липидами (молекулы фосфолипидов включены в изгибы полипептидных цепей белковых субъединиц).
Гликопротеиды присутствуют почти во всех тканях и жидкостях животных, в тканях растений и в микроорганизмах. К Г. относятся муцины (встречаются в секретах всех слизистых желёз — в слюне, желудочном соке, в спинномозговой и семенной жидкостях) и мукоиды (входят в состав опорных тканей — костей, хряща, связок). К Г. относятся многие белки плазмы крови (протромбин), групповые вещества крови, иммуноглобулины, некоторые ферменты (панкреатическая рибонуклеаза Б, така-амилаза), гормоны (тиреотропин). Содержание углеводов в Г. варьирует от долей процента до 80%; их полисахаридная часть может содержать глюкозамин, галактозамин, галактозу, маннозу и др. углеводы.
Фосфопротеиды входит остаток фосфорной к-ты, присоединённый к аминокислотным остаткам полипептидной цепи белка. Многие ф-ты, фосфорелированием-дефосфорелированием рег-ся их активность (с затратой АТФ). К Ф. относятся: казеин – один из основных белков молока, овальбумин и вителлин – белки куриного яйца.
Хромопротеиды содержащие окрашенные простетические (небелковые) группы. Наиболее обширную группу Х. составляют железосодержащие белки гемопротеиды, к которым относятся цитохромы (переносчики электронов в процессах клеточного дыхания, при фотосинтезе, в системах гидроксилирования), некоторые ферменты (каталаза, пероксидаза), дыхательные пигменты (гемоглобин, миоглобин). К Х. относится и зрительный пурпур (родопсин) сетчатки глаза, содержащий в качестве хромофорной группы 11-цис-ретиналь.
Металлопротеиды, Связь между белком и металлом (Fe, Cu, Zn, Mg, V, Mo…), как правило, непрочна, однако удаление металла приводит к нарушению строения и функциональных свойств. М. Распространены в живой природе и выполняют важные биологические функции: транспорт кислорода у беспозвоночных (гемэритрин, гемоцианин), депо и транспорт железа (ферритин, трансферрин), депо и транспорт меди (церулоплазмин) и др. К М. относятся многие ферменты (некоторые цептидазы, тирозиназа, оксидаза аспарагиновой кислоты и др.).
Флавопротеиды, жёлтые ферменты, простетической группой (небелковым компонентом) которых служат производные рибофлавина (витамина В2) – флавинадениндинуклеотид (ФАД) или флавинмононуклеотид (ФМН).

В состав простетической группы многие Ф. наряду с флавиннуклеотидами входят комплексно связанные с ними металлы (Fe, Cu, Mo), соединения серы Ф. относятся к классу оксидоредуктаз и катализируют важные окислительно-восстановительные реакции в живых организмах при непосредственном участии ФАД, реже – ФМН. Специфичность (избирательность) и эффективность действия Ф. определяются природой их белковых компонентов (апоферментов. Многие Ф. ассоциированы с клеточными мембранами, образуя прочные комплексы с входящими в их состав липидами. Основная функция Ф. – окисление восстановленного никотинамидадениндинуклеотида (НАДН) в цепи переноса электронов. Ф. способны также непосредственно окислять различные субстраты, отщепляя от них атомы водорода, которые переносятся затем на кислород либо сразу (например, ксантиноксидаза), либо через цепь переноса электронов (например, сукцинатдегидрогеназа).
13. Физико-химические свойства белков: молекулярная масса, кислотно-основные свойства белков. Заряд белковой молекулы, изоэлектрическая точка. Буферные свойства белков. БЕЛКИ, высокомол. природные полимеры, построенные из остатков аминокислот, соединенных амидной (пептидной) связью —СО—NH—. Каждый БЕЛКИ характеризуется специфический аминокислотной последовательностью и индивидуальной пространств, структурой (конформацией).
Физ.-хим. свойства Б. Белки образуют коллоидные растворы (размеры частиц - 0,1-0,001 мкм), для которых важны следующие характеристики: * низкое осмотическое давление; * высокая вязкость; * низкая способность к диффузии.
В лабораторной практике свойства коллоидных растворов белков используют при нефелометрическом определении количества белка на основе эффекта Тиндаля и при очистке белковых растворов от шгзкомолскулярных примесей с помощью полупроницаемых мембран методом диализа.
Белки бывают кислыми и основными. Кислые белки содержат много глу и асп, у которых есть дополнительные карбоксильные и меньше аминогрупп. В щелочных белках много лиз и арг. Каждая молекула белка в водном растворе окружена гидратной оболочкой, так как у белков за счет аминокислот есть много гидрофильных группировок (-СООН, -ОН, -NH2, -SH). В водных растворах белковая молекула имеет заряд. Заряд белка в воде может меняться в зависимости от РН.
Белковая молекула в растворе удерживается зарядом и гидратной оболочкой. Снятие заряда осущетевляется путем подведения рН к изоэлектрической точке.
Удаление гидратной оболочки производится водоотнимающими средствами (органические растворители, соли щелочноземельных металлов), изменением температуры и др.
Для белков характерны следующие основные физико-химические свойства: высокая вязкость растворов, незначительная диффузия, способность к набуханию в больших пределах, оптическая активность, подвижность в электрическом поле, низкое осмотическое давление и высокое онкотическое давление, способность к поглощению лучей при 280 нанометрах (10–9 м). Онкотическое давление крови обусловлено присутствием белков и равно 0,02…0,04 атм, т.е. 30 мм рт. ст. Онкотическое давление определяет распределение воды и минеральных веществ между кровью и тканями. Белки как и аминокислоты амфотерны. Благодаря наличию свободных амино- и карбоксильных групп. В зависимости от содержания функциональных групп они имеют различных заряд в растворах, перемещаясь к катоду или аноду. На этом основана их очистка методом электрофореза. Молекулы белков не в состоянии проходить через полупроницаемые искусственные мембраны (пергамент, коллодий, целлофан), а также через биомембраны. Белки относят к высокомолекулярным соединениям, их молекулярная масса колеблется от 6000 (нижний предел) до 1 000 000 и выше. При изменении внешних условий белки теряют нативную структуру. Денатурация – изменение уникальной структуры белковой молекулы, приводящее к потере характерных свойств. Наиболее ярким признаком денатурации является резкое снижение биологической активности, при этом разрушаются в основном невалентные водородные и дисульфидные связи и не затрагиваются пептидные связи. При непродолжительном действии возможен возврат биологической активности, т.е. ренатурация белка с полным восстановлением исходной структуры и нативных свойств.
Область рН, в которой белки являются электронейтральными, называется изоэлектрической точкой. Изоэлектрическая точка большинства белков лежит в пределах 5,5…7,0. В изоэлектрической точке белки наименее устойчивы и легко выпадают в осадок, обладая наименьшей растворимостью. Устойчивость белковой молекулы определяется наличием зарядов в полипептидной цепи, а также образованием гидратной оболочки. Отсутствие заряда и снятие гидратной оболочки приводит к сближению белковых молекул, в результате чего они слипаются, увеличиваются в размерах и выпадают в осадок под действием собственной силы тяжести. Это явление называется коагуляцией. Коагуляция является обратимой, если после снятия действия реагента белок возвращается в исходное состояние. Примерами обратимой коагуляции является высаливание (хлорида натрия, сульфата аммония). Такие соли нейтрализуют электрический заряд белка, разрушают его гидратную оболочку, и белок выпадает в осадок. При добавлению к такому белку воды он снова переходит в растворенное состояние. Процесс, обратный коагуляции, называется пептизацией. Необратимую коагуляцию (денатурацию) вызывает температура, соли тяжелых металлов, концентрированные неорганические кислоты. При растворении белков в воде образуются коллоидные растворы, которые обладают низким осмотическим давлением: они непрозрачны, способны рассеивать свет (эффект Тиндаля), опалесцировать (в проходящем свете – розовые, в отраженном – голубые). Для белков характерен ряд цветных реакций: биуретовая, ксантопротеиновая, Сакагучи и т.п.
14. Растворимость, коллоидные свойства, денатурация и оптические свойства белков. Белки - природные высокомолекулярные органические соединения, построенные из остатков 20 аминокислот, которые соединены пептидными связями в полипептидные цепи.
Растворимость белков в воде зависит от всех свойств белков: формы, молекулярной массы, величины заряда, соотношения полярных и неполярных функциональных групп на поверхности белка. Кроме этого, растворимость белка определяется составом растворителя, т.е. наличием в растворе других растворённых веществ.
По растворимости в воде и солевых р-рах: 1 Альбумины – растворимы в воде и слабо в р-рах соли.(овальбумин) 2 Глобулины – растворимы в водных растворах солей (лактоглобулин молока). 3 Глутемины – растворимы в кислотах и щелочах (ориземин семян риса). 4. Проламины – р-ся в в 60-80% р-ре этилового спирта (глиандин пшеницы).
С другой стороны, увеличение концентрации нейтральных солей может способствовать вьшадению определённых белков в осадок. Денатурирующие агенты, присутствующие в растворе, также снижают растворимость белков. Свойства белковых растворов определяются большими размерами молекул, т.е. белки являются коллоидными частицами и образуют коллоидные растворы. (размеры частиц - 0,1-0,001 мкм)
К свойствам белковых растворов относятся:1. Рассеивание света вследствие дифракции на коллоидных частицах – опалесценция. Особенно это заметно при прохождении луча света через белковый раствор, когда виден светящийся конус (эффект Тиндаля).2. Белковые растворы в отличие от истинных обладают малой скоростью диффузии. 3. Неспособность белковых частиц проникать через мембраны, поры которых меньше диаметра белков (полунепроницаемые мембраны). Это используется в диализе. Очистка белковых препаратов от посторонних примесей лежит в основе работы "искусственной почки". 4. Создание онкотического давления, то есть перемещение воды в сторону более высокой концентрации белка, что проявляется, например, как формирование отеков при повышении проницаемости сосудистой стенки. 5. Высокая вязкость в результате сил сцепления между крупными молекулами, что проявляется, например, при образовании гелей и студней Денатурация – разрушение нативной конформации белка (разрушение слабых связей, не пептидных) Денатур-ие агенты: высокая темп-ра, интенсивное стряхивание р-ра (взаимод-ие с возд. средой), орг. в-ва (фенол) взаимодей-щие с функ-ми группами белков, к-ты и щелочи, соли тяжелых металлов, детергенты (различные мыла). Ренатурация – возвтращение нативной стр-ры белка, например после удаления соли из р-ра.
