
- •12.Характеристика простых и сложных белков. Характеристика классов сложных белков: нуклеопротеиды, липопротеиды, гликопротеиды, фосфопротеиды, хромопротеиды, металлопротеиды, флавопротеиды.
- •15. Методы выделения и очистки белков.
- •17. Скорость химических реакций и сущность явления катализа. Теоретические основы и особенности ферментативного катализа. Термодинамические и кинетические характеристики ферментативного катализа.
- •18.Классификация и номенклатура ферментов. Химическая природа ферментов, их функциональные группы. Активный и аллостерический центры.
- •19. Коферменты, простетические группы. Роль витаминов, металлов и других кофакторов в функционировании ферментов.
- •22. Влияние ингибиторов на ферментативную активность. Множественные формы ферментов. Изоферменты.
- •23. Общие представления о механизме ферментативного катализа. Количественная характеристика ферментативных реакций.
- •24. Принципы регуляции ферментативных процессов в клетке и регуляция метаболизма. Регуляция ферментативных процессов количеством субстрата и фермента. Локализация ферментов в клетке.
- •25. Роль нуклеиновых кислот в формировании и свойствах живой материи. Основной постулат молекулярной биологии. Строение нуклеиновых кислот. Пуриновые и пиримидиновые основания. Углеводные компоненты.
- •26. Нуклеозиды и нуклеотиды. Нуклеотидный состав днк. Правила Чаргаффа. Нуклеозиды, нуклеотиды
- •27. Первичная, вторичная и третичная структура днк. Функциональная организация
- •28. Общая характеристика рнк. Виды рнк. Особенности структуры, синтеза и функции м-рнк, т-рнк и р-рнк..
- •30. Регуляция синтеза белка у прокариот Мутации, их виды и последствия.
- •31.Ферментативный гидролиз белков. Протеолитические ферменты, их специфичность, активация.
- •32. Общая схема источников и расходования аминокислот в организме. Незаменимые аминокислоты. Общие пути катаболизма аминокислот.
- •34. Образование аммиака. Транспорт аммиака. Восстановительное аминирование. Амиды и их физиологическое значение.
- •35. Особенности обмена отдельных аминокислот и их роль в образовании важнейших биологически активных веществ.
- •36. Биосинтез мочевины. Орнитиновый цикл мочевинообразования.
- •37. Азотистые небелковые вещества (биогенные амины), их синтез, распад и биологическая роль. Нарушения структуры и обмена белков. Наследственные заболевания.
- •38. Алкалоиды, их роль у растений и значение в медицине
- •39. Углеводы и их биологическая роль, классификация и номенклатура.
- •40. Структура, свойства и распространение в природе основных представителей моносахаридов и полисахаридов. Гликопротеины и гликолипиды. Взаимопревращения моносахаридов.
- •4 1. Анаэробный и аэробный распад углеводов. Энергетическая характеристика аэробной и анаэробной фазы углеводного обмена.
- •42. Гликолиз. Спиртовое брожение.
- •43 Биосинтез полисахаридов. Гликозил-трансферазные реакции. Гликогенез
- •44. Окислительное декарбоксилирование пировиноградной кислоты. Пируватдегидрогеназный комплекс.
- •45. Цикл трикарбоновых кислот. Окислительное фосфорилирование на уровне субстрата. Прямое окисление глюкозо-6-фосфата.
- •47.Макроэргические соединения. Нуклеозидфосфаты, атф, креатинфосфат и аргининфосфат. Пути образования атф и других макроэргических соединений.
- •48.Окислительное фосфорилирование. Окислительно-востановительные процессы.
- •49. Цепь переноса водорода и электронов (дыхательная цепь).
- •52. Окислительное фосфорилирование в дыхательной цепи. Представление о механизмах сопряжения окисления и фосфорилирования в дыхательной цепи.
- •55. Жирные кислоты, их классификация и номенклатура. Простагландины.
- •56.Ферментативный распад и синтез липидов. Окисление жирных кислот, биосинтез жирных кислот. Мультиферментные комплексы синтеза жирных кислот.
- •57. Кетоновые тела, структура, синтез, утилизация в тканях.
- •60.Хим природа и физиол роль важнейших гормонов, их роль в регуляции обмена в-в и синтеза белков.
- •62. Связь между обменом белков, углеводов и липидов. Обмен веществ как единая система процессов.
48.Окислительное фосфорилирование. Окислительно-востановительные процессы.
Окислительное фосфорилирование. Энергия окисляющихся веществ используется для синтеза АТФ из АДФ. В молекуле АДФ только одна высокоэнергетическая связь; в результате синтеза АТФ путем окислительного фосфорилирования добавляется ещё одна, т.е. энергия окисления субстрата трансформируется в энергию химических связей в молекуле АТФ. Главный путь синтеза АТФ из АДФ – окислительное фосфорилирование.
Систему окислительного фосфорилирования удается разделить на несколько сохраняющих активность комплексов, каждый из которых осуществляет одну из главных стадий цепи переноса электронов. Обычно эти комплексы обозначают как комплексы I, II, III и IV. (Далее по карте показываете и рассказываете) Комплекс I катализирует двухэлектронное окисление NADH специальным промежуточным переносчиком электронов -убихиноном или коферментом Q. Последний может существовать в окисленной хиноидной и восстановленной гидрохинонной формах, в дальнейшем обозначаемых сокращенно как CoQ и CoQH. Комплекс II представляет собой систему, катализирующую окисление сукцината в фумарат. Таким образом, и в этом случае перенос электронов осуществляется в конечном итоге на окисленную форму кофермента Q. Следует отметить, что аналогичная реакция с ацильными остатками, связанными с коферментом А, являющаяся одним из этапов окислительной деструкции жирных кислот, происходит с участием растворимого, т. е. не связанного с мембраной фермента. Комплекс III катализирует окисление восстановленного кофермента Q цитохромом с. При этом степень окисления входящего в его состав иона железа уменьшается от (III) до (II). Наконец, комплекс IV представляет собой цитохром с оксидазу, т. е. катализирует перенос электронов от ферроцитохрома непосредственно на кислород. Каждый из комплексов содержит набор белков, несущих те или иные кофакторы. Основные компоненты представлены тремя группами белков — флавопротеидами, содержащими флавинадениндинуклеотид (ФАД) или флавинмононуклеотид (или ФМН), гемопротеидами, содержащими железопорфириновые комплексы, и железосерными белками. В состав цитохром-оксидазы входит медьсодержащий белок
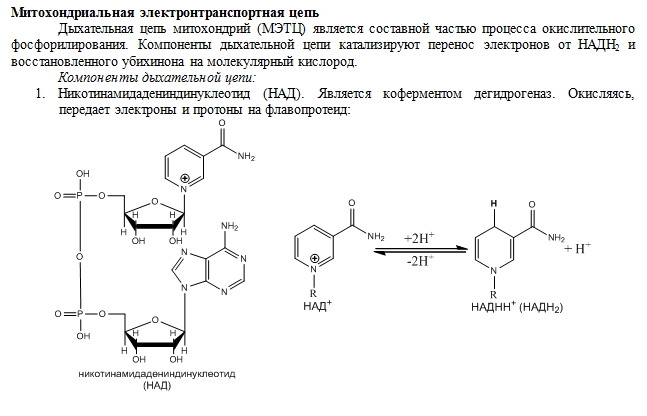
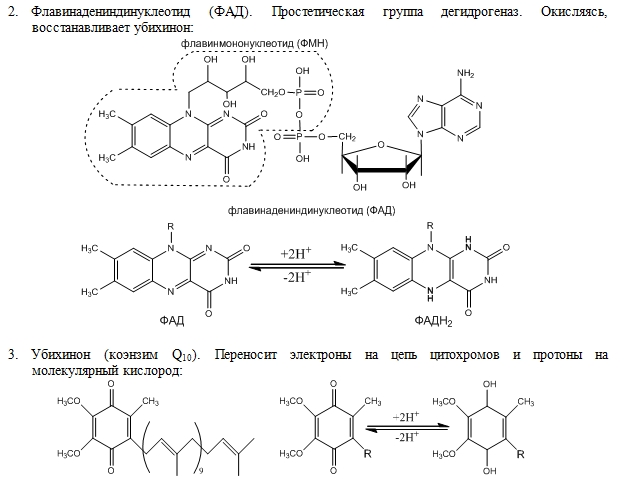
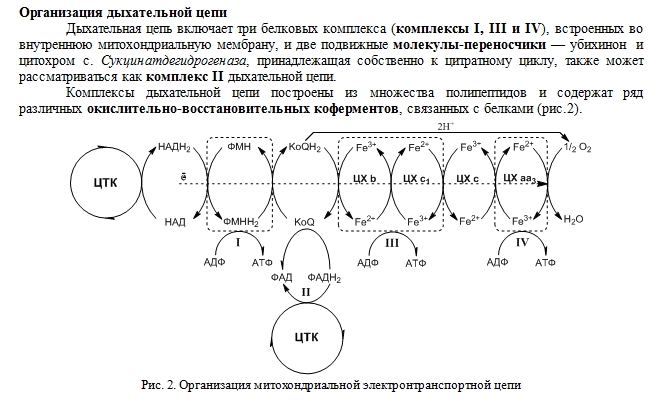
49. Цепь переноса водорода и электронов (дыхательная цепь).
Окисление субстратов в процессе дыхания можно представить как перенос электронов и протонов (т.е. в целом – атомов водорода) от органических веществ на кислород. На каждом этапе выделяется АТФ. Водород от первичных доноров вводится в дыхательную цепь с участием НАД-зависимых и ФАД-зависимых дегидрогеназ. ФАД-зависимые дегидрогеназы переносят водород на убихинон (образуется убихинон QH2), а НАД-зависимые дегидрогеназы – на НАД (образуется НАД*Н). Далее с НАД+Н водород передается тоже на убихинон. Затем в дыхательной цепи пути электронов и протонов расходятся. Перенос электронов осуществляется с помощью цитохромов (гемопротеины). В организме человека в результате тканевого дыхания образуется 300-400 мл воды за сутки (метаболическая вода).
50.
НАД и НАДФ-зависимые дегидрогеназы.
НАД
и НАДФ —
широко распространённые в природе
коферменты
некоторых
дегидрогеназ — ферментов,
катализирующих окислительно-восстановительные
реакции в живых клетках. Они принимают
на себя водород и электроны окисляемого
соединения и передают их на другие
вещества. Дегидрогеназы - это
оксидоредуктазы, катализирующие процесс
отщепления атомов водорода. Все
дегидрогеназы являются холоферментами,
коферментами которых служат следующие
соединения: никотинамидаденинди-нуклеотид
(НАД), никотинамидадениндинуклеотид
(НАДФ), флавинмононуклеотид (ФМН),
флавинадениндинуклеотид (ФАД), хиноны.
Наиболее распространены в природе
дегидрогеназы, содержащие в качестве
кофермента НАД. Эти ферменты катализируют
реакции окисления веществ путем
дегидрирования (дегидрирование
гидроксильных групп, альдегидных групп,
аминогрупп): при этом окисляемое вещество
служит донором водорода, а НАД выполняет
роль акцептора водорода, т.е.
восстанавливается. Остаток никотинамида
в молекуле НАД принимает непосредственное
участие в реакции. Примером
процесса, катализируемого НАД-зависимой
дегидрогеназой, может служить окисление
молочной кислоты (лактата) до пировиноградной
кислоты (пирувата): см рис.
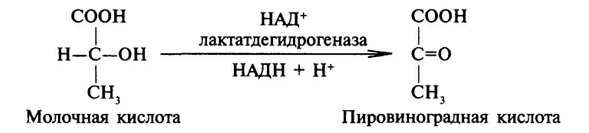
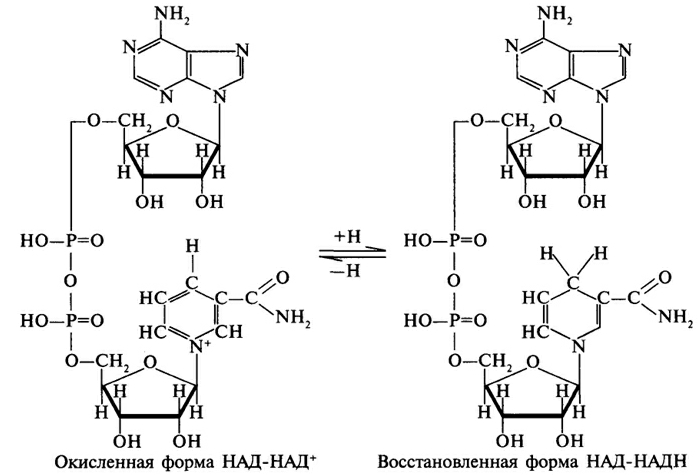
Такого же типа реакции катализируют дегидрогеназы, использующие в качестве кофермента никотинамидадениндинуклеотидфосфат (НАДФ). Этот кофермент отличается от НАД только наличием дополнительного фосфатного остатка. Однако биологические функции НАД и НАДФ различны. Например НАДФ-зависимая малатдегидрогеназа локализована в цитозоле клетки, в отличии от митохондриальной НАД-зависимой малатдегидрогеназы. В отличии от НАД*Н НАДФ*Н не может передавать водород в дыхательную цепь: водород НАДФ*Н используется в восстановительных реакциях. При восстановительных синтезах энергия высокоэнергетического водорода НАДФ*Н не теряется: она сохраняется во вновь синтезированных веществах, и во многих случаях может быть использована при их катаболизме.
51. Флавиновые ферменты, убихинон, цитохромы и цитохромоксидаза. Флавиновые дегидрогеназы составляют группу дегидрогеназ. Флавиновые ферменты принимают участие в окислении жирных, янтарной и других кислот; инактивируют и окисляют высокотоксичные альдегиды, расщепляют в организме чужеродные D-изомеры аминокислот, образующиеся в результате жизнедеятельности бактерий; участвуют в синтезе коферментных форм витамина B6 и фолацина; поддерживают в восстановленном состоянии глутатион и гемоглобин. В ферментах коферменты функционируют как промежуточные переносчики электронов и протонов, отщепляемых от окисляемого субстрата. Коферментами для них являются флавинадениндиннуклеотид (ФАД) или флавиномононуклеотид (ФМН). Эти коферменты являются производными рибофлавина (витамин В2). Флавиновые коферменты прочно связаны с апоферментами, следовательно, флавиновые дегидрогеназы – это сложные белки. К флавиновым ферментам, содержащим ФМН, принадлежит НАД*Н-дегидрогеназа, которая окисляет НАД*Н. Акцептором водорода в этой реакции служит кофермент Q (убихинон), который может существовать в клетке в окисленной (убихинон Q) и восстановленной формах (убихинон QH2). НАД*Н-дегидрогеназа переносит водород с НАД*Н на убихинон. Дегидрогеназы, содержащие ФАД, катализируют отщепление водорода от групп –СН2-СН2- с образованием двойной связи. Кофермент Q (кофермент Q10, убихинон, ubiquinone, coenzyme Q10, coenzyme Q) — это группа коферментов —бензохинонов, содержащих хиноидную группу (отсюда обозначение Q) и содержащих несколько изопрениловых групп (например, 10 в случае кофермента Q10). Осн. ф-ция убихинонов- перенос электронов и протонов от разл. Субстратов к цитохромам при дыхании и окислительном фосфорилировании. Убихиноны, гл. обр. в восстановленной форме (убихинолы, QnH2), выполняют ф-цию антиоксидантов. Убихиноны могут быть простетич. группой белков. Выделены Q-связывающие белки трех классов, действующие в дыхат. цепи на участках функционирования ферментов сукцинату-бихинонредуктазы, НАДН-убихинонредуктазы и цитохромов в и с1. Цитохромы (гемопротеины) — это маленькие глобулярные белки, которые содержат ковалентно связанный гем, расположенный во внутреннем кармане, образованном аминокислотными остатками. Цитохромы присутствуют во всех клетках организмов. В клетках эукариот они локализованы в митохондриальных мембранах. Цитохромы катализируют окислительно-восстановительные реакции. Известно около 30 видов цитохромов. Все они содержат гем в качестве простетической группы и различаются структурами боковых и полипептидных цепей. В зависимости от типа гема выделяют 8 классов цитохромов. В зависимости от спектров поглощения, цитохромы делят на группы a, b, c. Цитохромы представляют собой гемопротеины (геминовые ферменты). Атом железа в геме цитохромов может менять валентность, присоединяя или отдавая электрон. Цитохромы дыхательной цепи обозначают латинскими буквами: b, c1, c, a, a3. Комплекс цитохромов a и а3 действует как цитохромоксидаза – помимо гема содержит ионы меди, которые тоже участвуют в переносе электронов, меняя валентность. Этот комплекс цитохромов переносит электроны с цитохрома с на кислород. Цитохром с-оксидаза (цитохромоксидаза), фермент класса оксидоредуктаз; катализирует конечный этап переноса электронов на кислород в процессе окислительного фосфорилирования.
