- •12.Характеристика простых и сложных белков. Характеристика классов сложных белков: нуклеопротеиды, липопротеиды, гликопротеиды, фосфопротеиды, хромопротеиды, металлопротеиды, флавопротеиды.
- •15. Методы выделения и очистки белков.
- •17. Скорость химических реакций и сущность явления катализа. Теоретические основы и особенности ферментативного катализа. Термодинамические и кинетические характеристики ферментативного катализа.
- •18.Классификация и номенклатура ферментов. Химическая природа ферментов, их функциональные группы. Активный и аллостерический центры.
- •19. Коферменты, простетические группы. Роль витаминов, металлов и других кофакторов в функционировании ферментов.
- •22. Влияние ингибиторов на ферментативную активность. Множественные формы ферментов. Изоферменты.
- •23. Общие представления о механизме ферментативного катализа. Количественная характеристика ферментативных реакций.
- •24. Принципы регуляции ферментативных процессов в клетке и регуляция метаболизма. Регуляция ферментативных процессов количеством субстрата и фермента. Локализация ферментов в клетке.
- •25. Роль нуклеиновых кислот в формировании и свойствах живой материи. Основной постулат молекулярной биологии. Строение нуклеиновых кислот. Пуриновые и пиримидиновые основания. Углеводные компоненты.
- •26. Нуклеозиды и нуклеотиды. Нуклеотидный состав днк. Правила Чаргаффа. Нуклеозиды, нуклеотиды
- •27. Первичная, вторичная и третичная структура днк. Функциональная организация
- •28. Общая характеристика рнк. Виды рнк. Особенности структуры, синтеза и функции м-рнк, т-рнк и р-рнк..
- •30. Регуляция синтеза белка у прокариот Мутации, их виды и последствия.
- •31.Ферментативный гидролиз белков. Протеолитические ферменты, их специфичность, активация.
- •32. Общая схема источников и расходования аминокислот в организме. Незаменимые аминокислоты. Общие пути катаболизма аминокислот.
- •34. Образование аммиака. Транспорт аммиака. Восстановительное аминирование. Амиды и их физиологическое значение.
- •35. Особенности обмена отдельных аминокислот и их роль в образовании важнейших биологически активных веществ.
- •36. Биосинтез мочевины. Орнитиновый цикл мочевинообразования.
- •37. Азотистые небелковые вещества (биогенные амины), их синтез, распад и биологическая роль. Нарушения структуры и обмена белков. Наследственные заболевания.
- •38. Алкалоиды, их роль у растений и значение в медицине
- •39. Углеводы и их биологическая роль, классификация и номенклатура.
- •40. Структура, свойства и распространение в природе основных представителей моносахаридов и полисахаридов. Гликопротеины и гликолипиды. Взаимопревращения моносахаридов.
- •4 1. Анаэробный и аэробный распад углеводов. Энергетическая характеристика аэробной и анаэробной фазы углеводного обмена.
- •42. Гликолиз. Спиртовое брожение.
- •43 Биосинтез полисахаридов. Гликозил-трансферазные реакции. Гликогенез
- •44. Окислительное декарбоксилирование пировиноградной кислоты. Пируватдегидрогеназный комплекс.
- •45. Цикл трикарбоновых кислот. Окислительное фосфорилирование на уровне субстрата. Прямое окисление глюкозо-6-фосфата.
- •47.Макроэргические соединения. Нуклеозидфосфаты, атф, креатинфосфат и аргининфосфат. Пути образования атф и других макроэргических соединений.
- •48.Окислительное фосфорилирование. Окислительно-востановительные процессы.
- •49. Цепь переноса водорода и электронов (дыхательная цепь).
- •52. Окислительное фосфорилирование в дыхательной цепи. Представление о механизмах сопряжения окисления и фосфорилирования в дыхательной цепи.
- •55. Жирные кислоты, их классификация и номенклатура. Простагландины.
- •56.Ферментативный распад и синтез липидов. Окисление жирных кислот, биосинтез жирных кислот. Мультиферментные комплексы синтеза жирных кислот.
- •57. Кетоновые тела, структура, синтез, утилизация в тканях.
- •60.Хим природа и физиол роль важнейших гормонов, их роль в регуляции обмена в-в и синтеза белков.
- •62. Связь между обменом белков, углеводов и липидов. Обмен веществ как единая система процессов.
31.Ферментативный гидролиз белков. Протеолитические ферменты, их специфичность, активация.
Переваривание белков пищи начинается в желудке. Здесь в кислой среде белок денатурирует и подвергается действию пепсина – эндонуклеазы желудочного сока, которая гидролизует внутренние связи, образованные карбоксильной группой ароматических аминокислот (Phe +, Tyr+, Thr+).
Образовавшиеся полинуклеотиды поступают в просвет тонкого кишечника. Здесь на них действуют четыре фермента панкреатического секрета: трипсин, химотрипсин, эластаза и карбоксипептидаза. Трипсин и химотрипсин гидролизуют связи, образованные аминогруппами основных (+Lys, +Arg) и ароматических аминокислот (+Phe, +Tyr, +Thr). Эластаза – эндонуклеаза широкого спектра действия. Карбоксипептидаза – экзонуклеаза, гидролизующая связь С-концевой аминокислоты.+N-CH(R)-COOH
В пристеночной области кишечника олигонуклеотиды гидролизуются до свободных аминокислот ферментами кишечного сока – аминопептидазой, ди- и трипептидазой. Образовавшиеся свободные аминокислоты всасываются и поступают в кровоток.
ПРОТЕОЛИТИЧЕСКИЕ ФЕРМЕНТЫ (протеазы), ферменты класса гидролаз, катализирующие гидролиз (протео-лиз) пептидных связей. Место расщепления пептидной связи в полипептидной цепи определяется позиционной и субстратной специфичностью фермента и пространств. структурой гидролизуемого субстрата (белка или пептида).
Различают экзопептидазы, расщепляющие связи вблизи С- или N-конца цепи (соотв. карбоксипептидазы и аминопеп-тидазы)и эндопептидазы (протеиназы), гидролизующие связи, удаленные от концевых остатков (напр., трипсин). Лишь ограниченное число протеолитических ферментов обладает строгой субстратной специфичностью. К ним относят, напр., ренин, гидроли-зующий связь между остатками лейцина в положениях 10 и 11 в ангиотензиногене (предшественник ангиотензина пептида, участвующего в регуляции кровяного давления).
В зависимости от локализации фермента протеолиз происходит при разл. рН. Так, протеолитические ферменты желудка (напр., пепсин, гастриксин) функционируют при рН 1,5-2, лизосомные ферменты-при рН 4-5, а протеолитические ферменты сыворотки крови, тонкого кишечника и др.-при нейтральных или слабощелочных значениях рН. Нек-рые протеолитические ферменты используют в качестве кофактора ионы металлов-Са2+, Mg2+ и др.
Дефектные и чужеродные белки деградируют в клетке при участии АТФ-зависимой системы протеолиза. У эукариот (все организмы, кроме бактерий и синезеленых водорослей) эта система включает низкомол. белок убикитин, образующий с белками-субстратами конъюгат, и протеазы, расщепляющие этот конъюгат.
32. Общая схема источников и расходования аминокислот в организме. Незаменимые аминокислоты. Общие пути катаболизма аминокислот.
Доставленные с кровотоком аминокислоты в печень имеют несколько основных путей метаболизма:
Биосинтеза белка – протекает как в самой печени, так и в других тканях.
Трансаминирование и использование углеродного скелета для биосинтеза глюкозы, жирных кислот и кетоновых тел, биосинтеза АТФ.
Декарбоксилирование с образованием биологически активных биогенных аминов (дофамин, норадреналин и адреналин (синтезируются изначально из аминокислоты тирозина), серотонин, мелатонин и триптамин (синтезируются из триптофана).
Биосинтез нуклеотидов, порфиринов, гормонов.
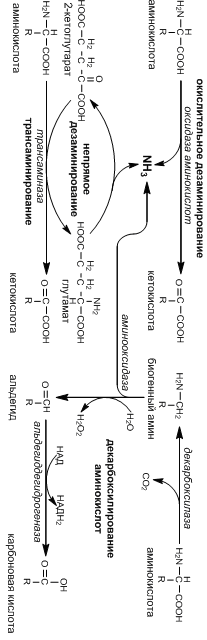
Трансаминирование и дезаминирование аминокислот
Часть аминокислот, поступивших в избыточном количестве с пищей, либо образовавшиеся в результате распада тканевых белков, теряют аминогруппу и превращаются в кетокислоту.
В процессе трансаминирования аминогруппа переносится на кетокислоту, в роли которой выступает 2-кетоглутарат, пируват или оксалоацетат, которые образуют глутамат, аланин и аспартат соответственно. Далее аминогруппа аланина и аспартата переносится на 2-кетоглутарат с образованием глутамата (непрямое дезаминирование). Глутамат – единственная аминокислота подвергающаяся окислительному дезаминированию.
В результате дезаминирования аминогруппа отщепляется в виде аммиака, который метаболизируется печенью.
Углеродные скелеты аминокислот могут быть вовлечены в ЦТК и окислены до конечных продуктов, либо использованы для биосинтеза глюкозы (глюкогенные аминокислоты), жирных кислот или кетоновых тел (кетогенные аминокислоты).
Глюкогенные аминокислоты образуют одно из пяти соединений, которые через оксалоацетат вовлекаются в глюконеогенез. Кетогенные аминокислоты образуют ацетоацетат или ацетил-КоА. Ряд аминокислот дают метаболиты обоих видов и являются одновременно кетогенныи и глюкогенными.
Декарбоксилирование аминокислот
В результате отщепления карбоксильной группы аминокислоты образуют биогенные амины, многие из которых выполняют важные биологические функции.
Так, серин образует этанолмаин, включаемый в состав фосфолипидов; глутамат – нейромедиатор γ-аминомасляную кислоту (ГАМК); гистидин – медиатор гистамин.
Дезактивация биогенных аминов происходит путем их окислительного дезаменирования и дальнейшего окисления в карбоновые кислоты.
Двенадцать из двадцати аминокислот могут быть синтезированы de novo в организме. При этом цистеин и тирозин образуются из незаменимых метионина и фенилаланина, а аргинин и гистидин синтезируются в незначительных количествах. Оставшиеся восемь получаются в результате переноса аминогруппы глутамата на кетокислоты-предшественники
реакция в обмене аминок-т 11рис
Вещества, образованные при внутриклеточном гидролизе или проникающие в клетку из крови, на втором этапе обычно превращаются в пировиноградную кислоту, ацетильную группу (в составе ацетил-S-КоА) и в некоторые другие мелкие органические молекулы. Локализация второго этапа – цитозоль и митохондрии. Часть энергии рассеивается в виде тепла и примерно 13% энергии вещества усваивается, т.е. запасается в виде макроэргических связей АТФ Ацетил-SКоА включается в реакции цикла трикарбоновых кислот и окисляется до углекислого газа. Выделенные атомы водорода соединяются с НАД и ФАД и восстанавливают их. После этого НАДН и ФАДН2 переносят водород в цепь дыхательных ферментов, расположенную на внутренней мембране митохондрий. Здесь в результате процесса под названием "окислительное фосфорилирование" образуется вода и главный продукт биологического окисления – АТФ.
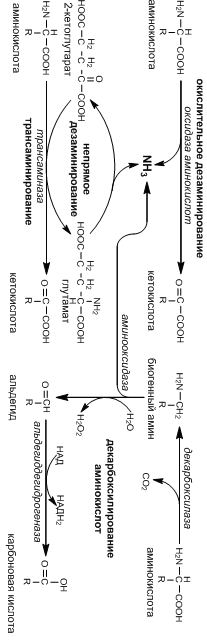
33.ПЕРЕАМИНИРОВАНИЕ (трансаминирование), обратимый перенос аминогруппы из молекулы одного орг. соед. в молекулу другого. Наиб. роль переаминирование играет в биохимии в процессах метаболизма азотистых оснований. Переаминирование аминокислот может происходить и вне клетки в присут. пиридоксаль-5'-фосфата, однако скорость р-ции в 106 раз меньше.
Часть аминокислот, поступивших в избыточном количестве с пищей, либо образовавшиеся в результате распада тканевых белков, теряют аминогруппу и превращаются в кетокислоту.
В процессе трансаминирования (рис.10) аминогруппа переносится на кетокислоту, в роли которой выступает 2-кетоглутарат, пируват или оксалоацетат, которые образуют глутамат, аланин и аспартат соответственно. Далее аминогруппа аланина и аспартата переносится на 2-кетоглутарат с образованием глутамата (непрямое дезаминирование). Глутамат – единственная аминокислота подвергающаяся окислительному дезаминированию.
В результате дезаминирования аминогруппа отщепляется в виде аммиака, который метаболизируется печенью.
Углеродные скелеты аминокислот могут быть вовлечены в ЦТК и окислены до конечных продуктов, либо использованы для биосинтеза глюкозы (глюкогенные аминокислоты), жирных кислот или кетоновых тел (кетогенные аминокислоты).
Глюкогенные аминокислоты образуют одно из пяти соединений, которые через оксалоацетат вовлекаются в глюконеогенез.
Кетогенные аминокислоты образуют ацетоацетат или ацетил-КоА. Ряд аминокислот дают метаболиты обоих видов и являются одновременно кетогенныи и глюкогенными (пролин, лейцин и др).
Нарушение нормального течения переаминирования в организме наблюдается при патологич. состояниях, напр. при инфаркте миокарда, заболеваниях печени. Контроль концентрации аминотрансфераз используется в этих случаях как ср-во диагностики. ДЕЗАМИНИРОВАНИЕ (деаминирование), удаление группы NH2 из молекул орг. соединений. Сопровождается замещением аминогруппы на др. группу или образованием кратной связи. Осуществляется под действием HNO2, нитрозилсерной к-ты, N2O3, N2O4, H2O, H2, а также ферментов.