
- •Часть 1. Компьютерное моделирование электронной структуры фуллерена с60
- •Введение
- •Лабораторная работа №1 «Основы работы в редакторе GaussView пакета Gaussian03»
- •1.1 Теоретическая часть
- •1.1.1 Программный комплекс Gaussian03
- •1.1.2 Редактор GaussView
- •1.2 Практическая часть
- •1.2.1 Построение молекул c использованием библиотек редактора GaussView
- •1.2.2. Примеры задания конфигурации молекул в редакторе GaussView
- •Вопросы
- •Лабораторная работа №2 «Численное моделирование электронной структуры молекул с использованием пакета Gaussian03»
- •2.1 Теоретическая часть
- •2.1.1 Основные методы расчета молекулярных структур
- •2.1.2 Неэмпирические методы расчета
- •2.1.2.1 Метод Хартри-Фока
- •2.1.2.2 Метод теории функционала плотности
- •2.1.3 Основные квантово- механические базисы
- •2.2 Практическая часть
- •2.2.1 Использование Gaussian Calculation Setup для установки параметров расчетов
- •2.2.2 Контрольный пример. Расчет характеристик молекулы кислорода o2
- •2.2.2.1 Визуализация электронной структуры атома кислорода
- •2.2.2.2 Зависимость полной энергии двух атомов кислорода от расстояния между ними
- •2.2.2.3 Расчет равновесного расстояния молекулы кислорода
- •Лабораторная работа №3 «Молекулярное строение и электронная структура молекулы фуллерена с60»
- •3.1 Теоретическая часть
- •3.1.1 Молекулярное строение фуллеренов c60
- •3.1.2 Получение фуллеренов
- •3.1.3 Свойства фуллеренов
- •3.1.4 Применение фуллеренов
- •3.1.5 Фуллериты
- •3.1.6 Электронная структура фуллеренов с60
- •3.2 Практическая часть
- •3.2.1 Электронная структура молекулы фуллерена с60
- •Вопросы
- •Лабораторная работа №4 «ик- спектр изолированной молекулы фуллерена с60»
- •4.1 Теоретическая часть
- •4.1.2 Колебательный спектр двухатомной молекулы
- •4.1.3 Колебания многоатомных молекул
- •4.2 Практическая часть
- •4.2.1 Расчет нормальных колебательных мод в Gaussian
- •4.2.2 Расчет структуры и колебательного спектра молекулы воды
- •Вопросы:
- •Лабораторная работа №5 «ик- спектр молекулы фуллерена с60 в растворах»
- •5.1 Теоретическая часть
- •5.1.1 Типы растворов
- •5.1.2 Растворимость фуллеренов
- •5.2 Практическая часть
- •5.2.1 Учет эффектов сольватации при расчетах в Gaussian03
- •Вопросы:
- •Литература
- •Глоссарий терминов.
- •Приложение 1. Панель меню и панель команд редактора GaussView.
- •Приложение 2. Настройки параметров расчетов Gaussian03.
- •Приложение 3. Справочная информация о неорганических молекулах
- •Приложение 4. Справочная информация об органических молекулах
- •Приложение 5. Правила оформления лабораторных работ
Приложение 2. Настройки параметров расчетов Gaussian03.
Для входа в меню Gaussian Calculation Setup необходимо во вкладке Calculate контрольной панели GaussView выбрать Gaussian Calculation Setup или нажать сочетание клавиш Ctrl+G. Откроется окно настроек расчетов в Gaussian, которое содержит следующие кнопки внизу панели:
Submit –начать расчет текущего входного файла.
Cancel – закрыть диалоговое окно. Все параметры сбрасываются.
Edit – редактировать входной файл. Редактирование невозможно, пока файл не сохранен.
Retain – закрыть диалоговое окно. Измененные параметры сохраняются.
Defaults – сброс настроек.
Help - вызов справки.
В окне настроек на первой вкладке Job Type выбирается тип расчета
Energy – расчет энергетического спектра
Optimization – оптимизация геометрии структур
Frequency – расчет частотного спектра
Opt+Freq – оптимизация и расчет частотного спектра
IRC – расчет химических реакций
Scan – сканирование поверхности потенциальной энергии
Stability - проверка стабильности волновых функций
NMR – расчет спектра ядерного магнитного резонанса (ЯМР)
BOMD – вычисление траекторий, используя молекулярную динамическую модель Борна-Оппенгеймера
Во вкладке Method выбирается квантово-механический метод расчета.
Method –выбор теоретического метода. В третьем выпадающем списке выбирается тип волновых функций: Restricted, Unrestricted и Restricted-Open – ограниченный, неограниченный и с открытыми оболочками.
Basis Set - выбор базиса
Charge, Spin – заряд и спин, GaussView задает эти значения исходя из молекулярной структуры, при необходимости их можно заменить.
Вкладка Title – название и описание выполняемых вычислений.
Во вкладке Link 0 – задается имя *.chk файла, размер выделяемой памяти и количество процессов.
Приложение 3. Справочная информация о неорганических молекулах
Азотная кислота (HNO3) — сильная одноосновная кислота. Азотная кислота смешивается с водой в любых соотношениях. В водных растворах она практически полностью диссоциирует на ионы.
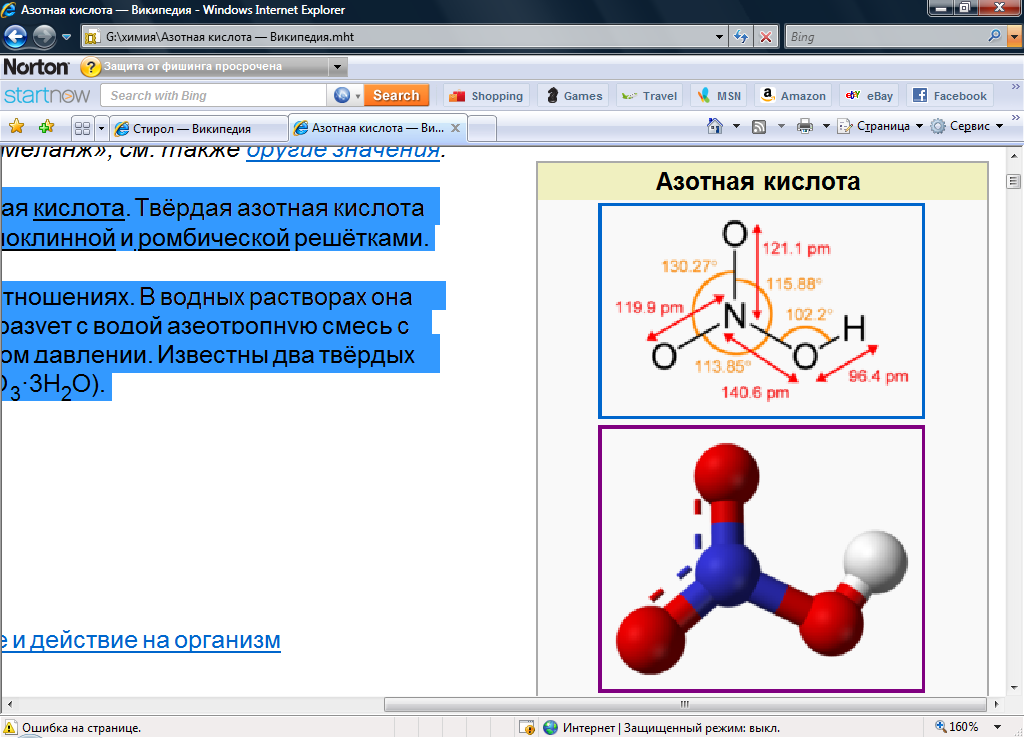
Рис.1П Молекула азотной кислоты
Молярная масса 63.012 г/моль, жидкость при н.у. с плотностью 1.513 г/см3. Температура плавления Тпл= -41.59ºС, температура кипения Ткип=82.6 ºС. Дипольный момент 2.17±0.02 Дебай.
Аммиак (NH3) – при н.у. бесцветный газ с резким запахом (нашатырного спирта), почти вдвое легче воздуха. Растворимость NH3 в воде чрезвычайно велика – около 1200 объемов (при 0 ºС) в объеме воды. Молекула аммиака имеет форму тригональной пирамиды а атомом азота в вершине. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s электронами трех атомов водорода, четвертая пара внешних электронов является неподеленной, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония NH4+. Благодаря тому, что не связывающее электронное облако строго ориентировано в пространстве, молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.

Рис.2П Молекула аммиака
Молярная масса 17.0306 г/моль. Тпл=-77.73 ºС, Ткип=-33.34 ºС.
История. Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона в Северной Африке, расположенному на перекрестке караванных путей. В жарком климате мочевина (NH2)2CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак. По другим сведениям, аммиак получил своё название от древнеегипетского слова амониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH4Cl, который при нагревании испаряет аммиак.
Вода (оксид водорода) (Н2O) — химическое вещество в виде прозрачной жидкости, не имеющей цвета (в малом объёме), запаха и вкуса (при нормальных условиях). В твёрдом состоянии называется льдом или снегом, а в газообразном— водяным паром. Около 71 % поверхности Земли покрыто водой (океаны, моря, озёра, реки, лёд). Является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы). Вода имеет ключевое значение в создании и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды.

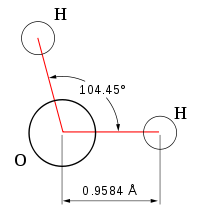
Рис.3П Молекула воды
Молярная масса Mr= 18.01528 г/моль, плотность ρ=0.9982 г/см3, Тпл=0 ºС, Ткип=99.974 ºС
В среднем в организме растений и животных содержится более 50 % воды.
В составе мантии Земли воды содержится в 10-12 раз больше, чем количество воды в Мировом океане.
При средней глубине в 3,6 км Мировой океан покрывает около 71 % поверхности планеты и содержит 97,6 % известных мировых запасов свободной воды.
Если бы все ледники растаяли, то уровень воды на Земле поднялся бы на 64 м и около 1/8 поверхности суши было бы затоплено водой.
Морская вода при обычной её солёности 35 ‰ замерзает при температуре −1,91 °C.
При определённых условиях (внутри нанотрубок) молекулы воды образуют новое состояние, при котором они сохраняют способность течь даже при температурах, близких к абсолютному нулю.
Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лёд океана проникает только 2 % солнечного света.
С помощью капель воды из кранов можно создать напряжение до 10 киловольт, опыт называется «Капельница Кельвина».
Вода — это одно из немногих веществ на Земле, которые расширяются при переходе из жидкой фазы в твёрдую (кроме воды, таким свойством обладают висмут, галлий, свинец и некоторые соединения и смеси).
Вода может гореть, если ее поместить в атмосферу с фтором, иногда даже со взрывом. При этом выделяется кислород.
4. Оксид углерода (II) (угарный газ, окись углерода, монооксид углерода) (CO) — бесцветный ядовитый газ без вкуса и запаха. Молекула CO имеет тройную связь, как и молекула азота N2. Так как эти молекулы сходны по строению (изоэлектронны, двухатомны, имеют близкую молярную массу), то и свойства их также схожи — очень низкие температуры плавления и кипения, близкие значения стандартных энтропий и т. п. Благодаря наличию тройной связи молекула CO весьма прочна (энергия диссоциации 1069 кДж/моль, или 256 ккал/моль, что больше, чем у любых других двухатомных молекул) и имеет малое межъядерное расстояние (dC≡O=0,1128 нм или 1,13Å). Mr= 28.0101 г/моль, плотность ρ=0.00125 г/см3 (при 0 0С), Тпл= -205 ºС, Ткип= -191.5 ºС.


Рис. 4П Молекула оксида углерода II
Осторожно: Угарный газ очень опасен, так как не имеет запаха и вызывает отравление и даже смерть. Признаки отравления: головная боль и головокружение; отмечается шум в ушах, одышка, сердцебиение, мерцание перед глазами, покраснение лица, общая слабость, тошнота, иногда рвота; в тяжёлых случаях судороги, потеря сознания, кома. Токсическое действие монооксида углерода основано на том, что он связывается с гемоглобином крови прочнее и в 200—300 раз быстрее, чем кислород, блокируя процессы транспортировки кислорода и клеточного дыхания. Концентрация в воздухе более 0,1 % приводит к смерти в течение одного часа.
Интересно: Опытами на молодых крысах выяснено, что 0,02 % концентрация CO в воздухе замедляет их рост и снижает активность по сравнению с контрольной группой. Интересно то, что крысы, живущие в атмосфере с повышенным содержа нием CO, предпочитали воде и раствору глюкозы спиртовой раствор в качестве питья (в отличие от контрольной группы, особи в которой предпочитали воду).
5. Оксид углерода(IV) (углекислый газ, диоксид углерода, двуокись углерода, угольный ангидрид) (CO2) - бесцветный газ, без запаха, со слегка кисловатым вкусом. Mr= 44.0095 г/моль, плотность ρ=0.0019769 г/см3 (при н.у.), Тпл= -57 ºС, Ткип= -78 ºС.

Рис. 5П Молекула оксида углерода IV
При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное. Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
6. Серная кислота (H2SO4) — сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях концентрированная серная кислота — тяжёлая маслянистая жидкость без цвета и запаха. Mr= 98.082 г/моль, плотность ρ=1.8356 г/см3, Тпл= -10.38 ºС, Ткип= 279.6 ºС.
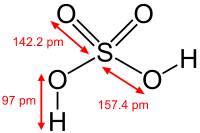
Рис. 6П молекула серной кислоты
Серная кислота очень едкое вещество. Оно поражают кожу, слизистые оболочки, дыхательные пути (вызывают химические ожоги). Предельно допустимая концентрация аэрозоля серной кислоты в воздухе рабочей зоны 1,0 мг/м³, в атмосферном воздухе 0,3 мг/м³ (максимальная разовая) и 0,1 мг/м³ (среднесуточная), смертельная 0,18 мг/л (60 мин). Аэрозоль серной кислоты может образовываться в атмосфере в результате выбросов химических и металлургических производств, вулканов, содержащих оксиды S, и выпадать в виде кислотных дождей.
Интересно: Мельчайшие капельки серной кислоты могут образовываться в средних и верхних слоях атмосферы в результате реакции водяного пара и вулканического пепла, содержащего большие количества серы. Получившаяся взвесь затрудняет доступ солнечных лучей к поверхности планеты. Поэтому (а также в результате большого количества мельчайших частиц вулканического пепла в верхних слоях атмосферы) после особо сильных вулканических извержений могут произойти значительные изменения климата. Например, в результате извержения вулкана Ксудач (п-ов Камчатка, 1907 г.) повышенная концентрация пыли в атмосфере держалась около 2 лет, а характерные серебристые облака серной кислоты наблюдались даже в Париже. Взрыв вулкана Пинатубо в 1991 году, отправивший в атмосферу 3×107 тонн серы, привёл к тому, что 1992 и 1993 года были значительно холоднее, чем 1991 и 1994.
Сероводород (сернистый водород, сульфид водорода) (H2S) — бесцветный газ с запахом тухлых яиц и сладковатым вкусом. Плохо растворим в воде, хорошо — в этаноле. Ядовит. При больших концентрациях разъедает многие металлы. Концентрационные пределы воспламенения с воздухом составляют 4,5 — 45 % сероводорода. В природе встречается очень редко в виде смешанных веществ нефти и газа. Входит в состав вулканических газов. Образуется при гниении белков. Сероводород используют в лечебных целях, например, в сероводородных ваннах. Mr= 34.082 г/моль, плотность ρ=1.5206 г/см3, Тпл= -82.30 ºС, Ткип= -60.28 ºС.
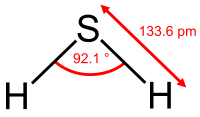

Рис. 7П Молекула сероводорода
Осторожно: Очень токсичен. Вдыхание воздуха с небольшим содержанием сероводорода вызывает головокружение, головную боль, тошноту, а со значительной концентрацией приводит к коме, судорогам, отёку лёгких и даже к летальному исходу. При высокой концентрации однократное вдыхание может вызвать мгновенную смерть. При небольших концентрациях довольно быстро возникает адаптация к неприятному запаху «тухлых яиц», и он перестаёт ощущаться. Во рту возникает сладковатый металлический привкус. При большой концентрации ввиду паралича обонятельного нерва запах сероводорода не ощущается.
8. Фтороводород (фтористый водород, гидрофторид, фторид водорода) (HF) — бесцветный газ с резким запахом. Смешивается с водой в любом отношении с образованием фтороводородной (плавиковой) кислоты. Mr= 20.01 г/моль, плотность ρ=0.99 г/см3, Тпл= -83.4 ºС, Ткип= 19.54 ºС. Фтороводород в жидком и газообразном состояниях имеет большую склонность к ассоциации вследствие образования сильных водородных связей. Даже в газообразном состоянии, фтороводород состоит из смеси полимеров H2F2, H3F3, H4F4, H5F5, H6F6. Простые молекулы HF существуют лишь при температурах выше 90 °C. Вследствие высокой прочности связи, термический распад фтороводорода становится заметным лишь выше 3500°C (что выше температуры плавления вольфрама — самого тугоплавкого из металлов).
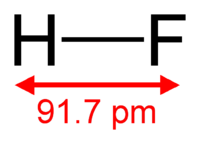
Рис. 8П Молекула фтороводорода
Осторожно: Очень ядовит. Фтористый водород дымит на воздухе (вследствие образования с парами воды мелких капелек раствора) и сильно разъедает стенки дыхательных путей.
Интересно: писатель-фантаст Иван Ефремов написал повесть «Сердце змеи», в которой описал гипотетическую жизнь, образовавшуюся на планете, где основную роль в природе играет не кислород, а фтор, а вместо воды поверхность планеты покрыта океанами фтороводорода. На эту мысль писателя навела глубокая аналогия между свойствами воды и фтороводорода.
