
- •Часть 1. Компьютерное моделирование электронной структуры фуллерена с60
- •Введение
- •Лабораторная работа №1 «Основы работы в редакторе GaussView пакета Gaussian03»
- •1.1 Теоретическая часть
- •1.1.1 Программный комплекс Gaussian03
- •1.1.2 Редактор GaussView
- •1.2 Практическая часть
- •1.2.1 Построение молекул c использованием библиотек редактора GaussView
- •1.2.2. Примеры задания конфигурации молекул в редакторе GaussView
- •Вопросы
- •Лабораторная работа №2 «Численное моделирование электронной структуры молекул с использованием пакета Gaussian03»
- •2.1 Теоретическая часть
- •2.1.1 Основные методы расчета молекулярных структур
- •2.1.2 Неэмпирические методы расчета
- •2.1.2.1 Метод Хартри-Фока
- •2.1.2.2 Метод теории функционала плотности
- •2.1.3 Основные квантово- механические базисы
- •2.2 Практическая часть
- •2.2.1 Использование Gaussian Calculation Setup для установки параметров расчетов
- •2.2.2 Контрольный пример. Расчет характеристик молекулы кислорода o2
- •2.2.2.1 Визуализация электронной структуры атома кислорода
- •2.2.2.2 Зависимость полной энергии двух атомов кислорода от расстояния между ними
- •2.2.2.3 Расчет равновесного расстояния молекулы кислорода
- •Лабораторная работа №3 «Молекулярное строение и электронная структура молекулы фуллерена с60»
- •3.1 Теоретическая часть
- •3.1.1 Молекулярное строение фуллеренов c60
- •3.1.2 Получение фуллеренов
- •3.1.3 Свойства фуллеренов
- •3.1.4 Применение фуллеренов
- •3.1.5 Фуллериты
- •3.1.6 Электронная структура фуллеренов с60
- •3.2 Практическая часть
- •3.2.1 Электронная структура молекулы фуллерена с60
- •Вопросы
- •Лабораторная работа №4 «ик- спектр изолированной молекулы фуллерена с60»
- •4.1 Теоретическая часть
- •4.1.2 Колебательный спектр двухатомной молекулы
- •4.1.3 Колебания многоатомных молекул
- •4.2 Практическая часть
- •4.2.1 Расчет нормальных колебательных мод в Gaussian
- •4.2.2 Расчет структуры и колебательного спектра молекулы воды
- •Вопросы:
- •Лабораторная работа №5 «ик- спектр молекулы фуллерена с60 в растворах»
- •5.1 Теоретическая часть
- •5.1.1 Типы растворов
- •5.1.2 Растворимость фуллеренов
- •5.2 Практическая часть
- •5.2.1 Учет эффектов сольватации при расчетах в Gaussian03
- •Вопросы:
- •Литература
- •Глоссарий терминов.
- •Приложение 1. Панель меню и панель команд редактора GaussView.
- •Приложение 2. Настройки параметров расчетов Gaussian03.
- •Приложение 3. Справочная информация о неорганических молекулах
- •Приложение 4. Справочная информация об органических молекулах
- •Приложение 5. Правила оформления лабораторных работ
4.2 Практическая часть
4.2.1 Расчет нормальных колебательных мод в Gaussian
С помощью программы Gaussian можно рассчитывать инфракрасный и рамановский спектры молекул (частот, интенсивности, силовые постоянные, форму нормальных колебаний) в основном и возбужденых электронных состояниях.
Сначала выполняют процесс оптимизации структуры, затем рассчитывают частоты нормальных колебаний.
4.2.2 Расчет структуры и колебательного спектра молекулы воды
Молекула воды имеет почти тетраэдрическое строение, угол H–O–H равен 104°30’. Связи в молекуле частично ионные (30%) и частично ковалентные с высокой плотностью отрицательного заряда у кислорода и соответственно положительных зарядов у водорода. Молекулы воды имеют три нормальные моды 1595см-1, 3657см-1 и 3756см-1
Создаем новое рабочее окно и строим молекулу воды. Построение молекулы описано в лабораторной работе №1, пункт 1.2.2. Измеряем расстояния между атомами (rOH=0.096 нм).
Электронная плотность молекулы неоднородна. Около ядер водорода имеется недостаток, около ядра кислорода, наблюдается избыток электронной плотности. Следовательно, для оптимизации выбираем метод, учитывающий градиент электронной плотности, например B3LYP в валентно - расщепленном базисе 3-21G. В параметрах расчета Calculate / Gaussian во вкладке Job Type выбираем Frequency.
Открываем результаты расчетов в формате .log. При нажатии Results / Vibrations появится новое окно. Кнопками Start / Stop осуществляется запуск/ остановка визуализации колебаний атомов в молекуле воды. Можно изменять амплитуду колебаний, ускорять или замедлять визуализацию. Кнопка Spectrum необходима для графического представления вибрационных даных. Infrared Spectrum – это ИК спектр.
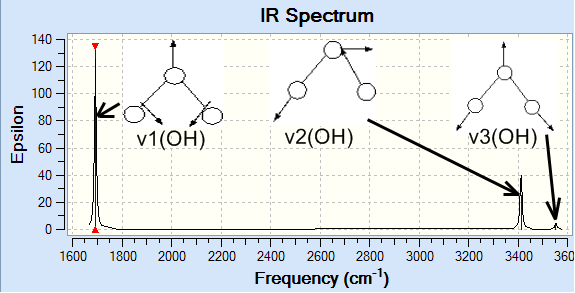
Рис.4.2 ИК- спектр молекулы воды
4.2.2 ИК-спектр молекулы фуллерена С60 (1664.96 3800.96 3914.25)
Открываем оптимизированную структуру молекулы фуллерена С60 в синглетном состоянии, рассчитанную в ходе выполнения лабораторной работы №3.
Задание 1. Произвести расчет ИК-спектра молекулы фуллерена С60 методом DFT LSDA 3-21G. Сравнить с экспериментальными данными.
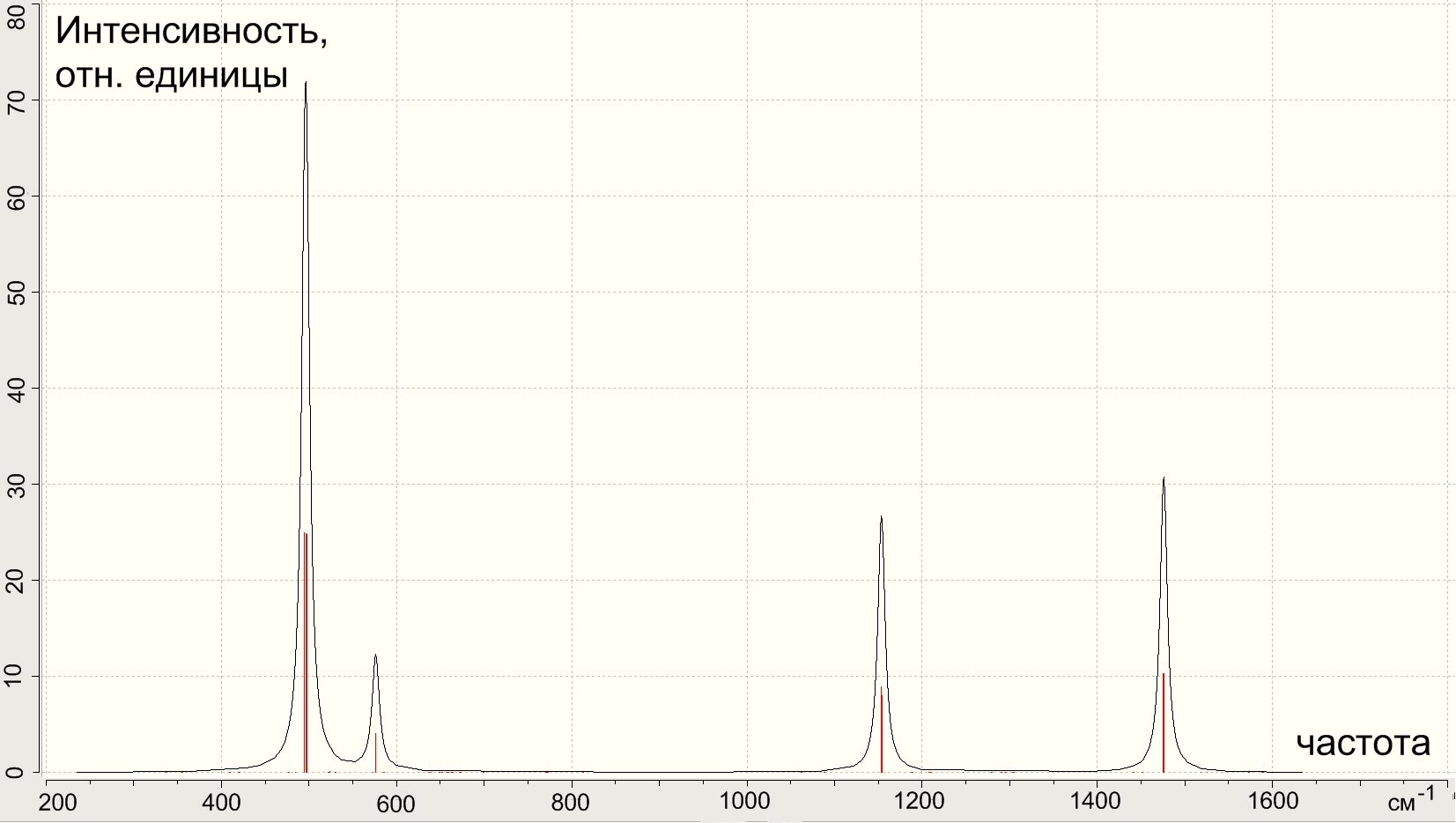
Рис.4.3 ИК-спектр основного состояния молекулы фуллерена С60
Вопросы:
Метод ИК-спектроскопии молекул.
Почему ИК-спектр называют «отпечатком пальцев» молекул.
Особенности ИК-спектра молекулы фуллерена С60.
Форма отчетности:
В электронном виде, в соответствии общим требованиям (см. приложение). Представить ИК-спектр молекулы фуллерена С60, сравнение с экспериментом. Сравнить спектры фуллеренов С60 и С70.
При сдаче работы необходимо знать ответы на вопросы лабораторной работы №4.
Лабораторная работа №5 «ик- спектр молекулы фуллерена с60 в растворах»
Цель работы: расчет ИК-спектра молекулы фуллерена в растворе толуола, ацетона и бензола.
5.1 Теоретическая часть
5.1.1 Типы растворов
К растворителям относится более трехсот веществ (при неограниченном числе возможных смесей растворителей), причем различие в их химических и физических свойствах очень велико. Несмотря на это, попыток их классификации предпринималось много.
Во-первых, растворители можно разделить на полярные и неполярные. Молекулы полярных растворителей отличаются тем, что «центры тяжести» положительного заряда ядра и отрицательного заряда электронной сферы не лежат в одной точке. К важнейшим растворителям этой группы принадлежат нитрометан, нитробензол, ацетонитрил, пропиленкорбанат, диметилформанид, диметилсульфоксид.
Во-вторых, можно выделить протонные и апротонные раствортели. Химические соединения, которые могут отдавать протон, т.е. быть протонодонорами, называются протонными, например спирты, карбокислоты. Растворители, которые не могут отщеплять протон, например толуол, тетрахлорметан, ацетонитрил, сероуглерод, называются соответственно апротонными.
В-третьих, принято различать кислотные и основные раствортели. Кислотами, по Льюису, можно считать вещества, способные принимать электронные пары, т.е. быть акцепторами электронов, а основания – вещества, способные отдать электронную пару, т.е. быть донорами электронов. Растворители, которые в процессе растворения проявляют себя и как кислоты, и как основания (вода, метанол, формамид) принято считать амфотерными.
Вернемся к такому важному свойству растворителя, которое обычно называют полярностью. Диэлектрическая проницаемость (ε) и дипольный момент (μ) не могут выступать как количественные характеристики полярности, т.к. изменяются в ряду растворителей не параллельно, и установить корреляцию их с совокупностью межмолекулярных взаимодействий между растворенным веществом и растворителем очень сложно. Поэтому возникает необходимость эмпирического определения показателей полярности растворителя. Одним из них является параметр Димрота и Рейхарда (ET), который рассчитывается по положению длинноволновой абсорбционной полосы в спектрах стандартного красителя, помещаемого в различные растворители.
Снайдером было определено восемь классов селективности растворителей. Представители нулевого класса инертны и не обладают полярной селективностью. К этому классу относят гексан, циклогексан, гексадекан. Вещества первого класса могут служить хорошими акцепторами, но плохими донорами протонов. К ним относятся преимущественно эфиры и амины, например, диэтиловый эфир, триэтиламин. Растворители второго класса одновременно являются хорошими донорами и акцепторами протонов, в основном, это алифатические спирты (метанол, этанол, пропанол). К растворителям третьего класса относятся такие полярные жидкости, как диметилформамид, диметилсульфоксид, а к четвертому классу – гликоль, формамид. Вещества пятого класса являются слабыми акцепторами и донорами протонов. К ним относятся хлорпроизводные углеводородов, например дихлорметан, дихлорэтан. Шестой класс растворителей включает в основном алифатические эфиры, кетоны и нитрилы, например этилацетат, ацетон, ацетонитрил, а седьмой класс – ароматические углеводороды, например бензол, толуол, хлорбензол. Вещества восьмого класса являются сильными донорами протонов. К ним относятся, в частности, вода и хлороформ.
Если ввести такие показатели, как донорное (DN) и акцепторное (AN) числа, определяемые по спектрам ядерного магнитного резонанса (ЯМР) то можно разделить растворители на следующие группы:
1. донорные (большое DN и малое AN)
2. акцепторные (малое DN и большое AN)
3. амфотерные (среднее DN и среднее AN)
4. инертные (малое DN и малое AN)
Чтобы вещество оптимально растворялось в растворителе, нужно чтобы их параметры хорошо согласовывались, вторым требованием к растворителю является его высокая селективность по отношению к растворяемому веществу. Аналогичной является проблема подбора растворителя для различных процессов разделения и органического синтеза. Немаловажными параметрами при выборе растворителя являтся: стоимость, доступность, токсичность, реакционную способность, температура кипения и замерзания, термостабильность, плотность, вязкость.
Ацетон (диметилкетон ) (CH3)2CO (температура плавления -95.35оС, тепература кипения 56.24 оС, плотность 0.7908) смешивается с водой и органическими растворителями. Ацетон применяется в производстве метилметакрилата, метилизобутилкетона, метакриловой кислоты, как растворитель перхлорвиниловых и полиакриловых лаков, ацетатовцеллюлозы. DN=17.0, AN=12.5, ET=42.2.
Бензол C6H6 (температура плавления 5.53 оС, температура кипения 80.1 оС, плотность 0.879) практически нерастворим в воде (0.08%), смешивается с неполярными растворителями, легко испаряется, самовоспламеняется при 534 оС. Бензол применяется в производстве стирола, фенола, капролактама, циклогексана, анилина, хлорбензолов, нитробензола, дифенила, красителей, полимеров, как растворитель лаков. DN=3.5, AN=8.2.
Уксусная кислота (этановая кислота) CH3COOH (температура плавления 16.75 оС, температура кипения 118.1 оС, плотность 1.0492) во всех соотношениях смешивается с водой, этанолом, диэтиловым эфиром, бензолом, нерастворима в сероуглероде, хорошо растворяет многие неорганические и органические вещества, например серу, фосфор, ацетаты целлюлозы, самовоспламеняется при 454 оС. Уксусная кислота применяется как растворитель лаков, коагулянт латексов. DN=15, AN=52.9, ET=51.2.
Этанол (этиловый спирт) C2H5OH (температура плавления -114.15 оС, температура кипения 78.39 оС, плотность 0.79356) растворим в воде и органических растворителях, самовоспламеняется при 422.8 оС. Этанол применяется в производстве ацетальдегида, хлороформа, диэтилового эфира, этилацетата, уксусной кислоты, бутадиена и как растворитель лакокрасочных материалов, лекарственных средств. DN=19.6, AN=37.1, ET=51.9.
Метанол (метиловый спирт) CH3OH (температура плавления -97.9 оС, температура кипения 64.5 оС, плотность 0.7917) легко смешивается с водой, спиртами, бензолом, ацетоном и другими органическими растворителями. Метанол применяется для производстваформальдегида, уксусной кислоты, растворитель для красителей и лекарственных средств. DN=19.1, AN=41.5, ET=55.5.
Тетрахлорметан (четыреххлористый углерод, хладон 10) CCl4 (температура плавления -22.96 оС, температура кипения 76.75 оС, плотность 1.595) растворим в воде на 0.8%, смешивается с органическими растворителями. Тетрахлорметан применяется как сырье в производстве фторированных хладагентов, как растворитель. DN=0, AN=8.6, ET=31.2.
Тетрагидрофуран (ТГФ, оксолан) C4H8O (температура плавления -108.5 оС, температура кипения 65.6-65.8 оС, плотность 0.8892) смешивается с органическими растворителями, с водой образует азеотропную смесь (6% воды), легко испаряется, самовоспламеняется при 250 оС. Тетрагидрофуран применяется как растворитель, например, поливинилхлорида и поливинилиденхлорида, служит сырьем для получения полиуретановых эластомеров. DN=20.0, AN=8.0, ET=37.4.
Хлороформ (трихлорметан, хладон 20) CHCl3 (температура плавления -63.5 оС, температура кипения 61.2 оС, плотность 1.483) растворим в воде на 0.32%, смешивается с органическими растворителями. Хлороформ применяется в качестве хладагента в холодильных установках, как сырье в производстве фторированных хладагентов и фторопластов, как растворитель, ET=39.1
Циклогексан (гексагидробензол, гексаметилен) (CH2)6 (температура плавления 6.55 оС, температура кипения 80.74 оС, плотность 0.7785) нерастворим в воде, растворим в органических растворителях. Циклогексан применяется как растворитель, например, при полимеризации олефинов, для получения циклогексанола, циклогексанона, адипиновой кислоты, нитроциклогексана, капролактама.
Толуол (метил бензол) C6H5CH3 (температура плавления -95 оС, температура кипения 110.6 оС, плотность 0.8669) смешивается с этанолом, диэтиловым эфиром, углеводородами. Толуол применяется в производстве бензола, бензойной кислоты, толиулендиизоцинатов, нитротолуолов, бензилхлорида, бензотрихлорида, как растворитель для полимеров. ET=33.9
