
Примеры А и Б части
.pdf
Министерство образования Республики Беларусь
|
|
|
|
|
|
|
БЕЛОРУССКИЙ НАЦИОНАЛЬНЫЙ |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
У |
|
|
|
|
|
|
|
ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ |
||||||
|
|
|
|
|
|
Кафедра химии |
|
Т |
|||||
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
Н |
|
|
|
|
|
|
|
|
|
|
|
|
|
Б |
|
|
|
|
|
|
|
|
|
|
|
|
й |
|
|
|
|
|
|
|
|
|
|
|
|
и |
|
|
|
|
|
|
|
|
|
|
|
|
р |
|
|
|
|
|
|
ЗАДАЧИ ПРЕДЛАБОРАТОРНОГО |
||||||||||||
|
|
|
|
|
|
|
о |
|
|
|
|
|
|
|
|
|
КОНТРОЛЯ ПО ХИМИИ |
|
|
||||||||
|
|
|
|
|
|
т |
|
|
|
|
|
|
|
|
|
|
|
|
и |
|
|
|
|
|
|
|
|
|
|
|
|
Пособ е для студентов I курса |
|
|
|||||||
|
|
|
|
з |
|
|
|
|
|
|
|
|
|
|
|
|
о |
|
|
|
|
|
|
|
|
|
|
|
|
п |
|
|
|
|
|
|
|
|
|
|
|
е |
|
|
|
|
|
|
|
|
|
|
|
||
Р |
|
|
|
|
|
|
|
|
|
|
|
|
|
Минск 2009

Министерство образования Республики Беларусь БЕЛОРУССКИЙ НАЦИОНАЛЬНЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
Кафедра химии
|
|
|
|
|
|
|
|
|
У |
|
|
|
|
|
|
|
|
Т |
|
|
|
|
|
|
|
|
Н |
|
|
|
|
|
|
|
|
|
Б |
|
|
|
|
ЗАДАЧИ ПРЕДЛАБОРАТОРНОГО |
|
|
|||||
|
|
|
|
|
|
й |
|
|
|
|
|
|
|
КОНТРОЛЯ ПО ХИМИИ |
|
|
|||
|
|
|
|
|
|
и |
|
|
|
|
|
|
Пособие длярстудентов I курса |
|
|
||||
|
|
|
|
|
о |
|
|
|
|
|
|
|
|
т |
|
|
|
|
|
|
|
|
|
и |
|
|
|
|
|
|
|
|
зПод редакцией В.Н. Яглова |
|
|
||||
|
|
о |
|
|
|
|
|
|
|
|
п |
|
|
|
|
|
|
|
|
е |
|
|
|
|
|
|
|
|
|
Р |
|
|
|
|
|
|
|
|
|
Минск 2009
УДК 546.66.015
|
З 15 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Авторы: |
|
|
|
У |
|||
|
|
Г.А. Бурак, Е.А. Евсеева, Д.И. Медведев, А.А. Меженцев, |
||||||||||||
|
|
|
||||||||||||
|
|
И.Б. Проворова, Л.М. Слепнева, И.А. Шнып, В.Н. Яглов |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Т |
|
|
|
|
|
|
Рецензент Я.Н. Ковалев |
Н |
|
|||||||
|
|
|
|
|
|
|
|
|||||||
З 15 |
|
|
|
|
|
|
|
|
|
Б |
|
|
||
|
Задачи предлабораторного контроля по химии: пособие для сту- |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
й |
|
|
|
|
|
|
дентов I курса / Г.А. Бурак [и др.]; под ред. В.Н. Яглова. – Минск: |
|
|||||||||||
|
|
БНТУ, 2009. – 172 с. |
|
|
и |
|
|
|
|
|||||
|
|
|
ISBN 978-985-479-946-9. |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
В данном пособии представлены ешен я типовых задач раз- |
|
||||||||||
|
|
|
|
|
|
|
по |
|
|
|
|
|
|
|
|
|
личного уровня сложности |
основным разделам курса химии, ко- |
|
||||||||||
|
|
торый излагается студентам на лекциях. В задачах даны термины и |
|
|||||||||||
|
|
|
|
|
|
т |
|
|
|
|
|
|
|
|
|
|
условные обозначения, п именяемые в Международной системе |
|
|||||||||||
|
|
единиц. |
|
и |
|
р |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
УДК 546.66.015 |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
з |
|
|
|
|
|
|
|
|
|
|
|
|
|
о |
|
|
|
|
|
|
|
|
|
|
|
|
п |
|
|
|
|
|
|
|
|
|
|
|
||
е |
|
|
|
|
|
|
|
|
|
|
|
|
||
Р |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ISBN 978-985-479-946-9 |
© БНТУ, 2009 |
ВВЕДЕНИЕ
При изучении курса химии предусмотрены лекции и лабораторные занятия. Лекции читаются в соответствии с учебной програм-
мой, вопросы которой представлены в прил. 2. |
У |
На первом занятии студент получает номер варианта своего ин- |
|
дивидуального домашнего задания, которое он обязан выполнить к |
|
каждой лабораторной работе (прил. 1). |
Т |
|
|
Домашнее задание включает краткий конспект по вопросам |
|
предстоящей лабораторной работы и задачи, соответствующие по- |
|
лученному студентом варианту. |
|
Вопросы для конспектирования представлены в плане лабора- |
|
торных работ, вывешенном в лаборатории. |
|
Каждая лабораторная работа начинается с проверкиНдомашнего |
|
й |
|
задания. За правильно и качественно выполненное домашнее зада- |
|
ние студент может получить 1 балл. Затем проводитсяБ |
предлабора- |
торный контроль. На предлабораторном контроле каждому студен- |
||||||
10 минут, то он может при желанииуровнявзять задачу уровня С, на решение |
||||||
ту предлагаются две задачи |
А |
В, на решение которых ему |
||||
отводится 15 минут. За правильное |
ешен е задачи уровня А сту- |
|||||
|
|
|
|
о |
|
|
дент получает дополнительно0,5 баллаи, а за задачууровня В– 2 балла. |
||||||
|
Если студент правильно |
ешил задачи уровня А и В менее чем за |
||||
|
|
и |
|
|
||
которой ему отводи ся д п лнительно 10 минут. За правильное реше- |
||||||
ниезадачи уровня С с |
|
получает дополнительно 3,5 балла. |
||||
|
Тексты типовых удентадач предлабораторного контроля уровня А, В |
|||||
|
образом |
|
|
|
|
|
и С, а также их решен я представлены в настоящем пособии. |
||||||
|
После лаб рат рного контроля студент приступает к выполне- |
|||||
|
п |
|
|
|
|
|
нию лаб ратзрн й работы. |
|
|
||||
|
Качество вып лнения лабораторной работы оценивается сле- |
|||||
е |
|
: |
|
|
|
|
дующим |
|
|
|
|
||
Р |
а) студент, выполнивший эксперимент с ошибкой менее 10 %, |
|||||
оформивший и сдавший отчет и ответивший на 1–2 вопроса по лабораторной работе преподавателю за 15 минут до конца занятия, получает дополнительно 3 балла. Студент, сдавший отчет, но не ответивший на контрольныевопросы, получает дополнительно2 балла;
б) студент, выполнивший эксперимент, оформивший и сдавший отчет преподавателю и ответивший на контрольные вопросы в интервале от 5 до15минут доконца занятия, дополнительнополучает 2балла.
3
Студент, не ответивший на дополнительные вопросы, получает 1 балл;
в) студент, выполнивший эксперимент, оформивший и сдавший отчет преподавателю в интервале от 5 до 0 минут до конца занятия, получает 0,5 балла. Дополнительных вопросов студент не получает; г) студент, выполнивший экспериментальную часть лабораторного занятия, но не оформивший отчет либо представивший отчет
после окончания занятия, обязан представить его на следующем |
|||||||||||
лабораторном занятии. В этом случае оценка за лабораторную рабо- |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
У |
ту снижается на 1 балл от суммы оценок домашнего задания и |
|||||||||||
предлабораторного контроля. |
|
|
|
|
Т |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Преподаватель имеет право снижать оценки за некачественное |
||||||||||
выполнение отдельных видов работ на лабораторном занятии. |
|||||||||||
|
После выполнения лабораторной работы студентуНвыставляется |
||||||||||
оценка. |
|
|
|
|
|
|
|
|
Б |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
й |
|
|
|
|
|
|
|
|
|
|
и |
|
|
|
|
|
|
|
|
|
|
р |
|
|
|
|
|
|
|
|
|
|
о |
|
|
|
|
|
|
|
|
|
|
т |
|
|
|
|
|
|
|
|
|
|
и |
|
|
|
|
|
|
|
|
|
|
з |
|
|
|
|
|
|
|
|
|
|
о |
|
|
|
|
|
|
|
|
|
|
п |
|
|
|
|
|
|
|
|
|
|
е |
|
|
|
|
|
|
|
|
|
|
|
Р |
|
|
|
|
|
|
|
|
|
|
|
4
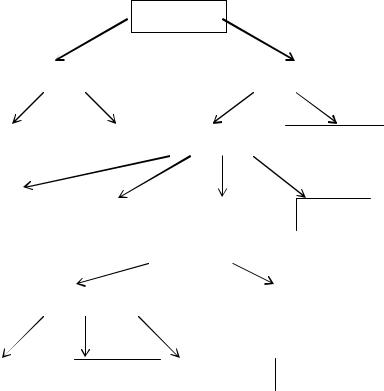
1. ОСНОВНЫЕКЛАССЫНЕОРГАНИЧЕСКИХСОЕДИНЕНИЙ
Вещества
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
У |
||
|
|
|
|
|
Простые |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Сложные |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Т |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
Металлы |
|
|
Неметаллы |
|
|
Неорганические |
|
|
Н |
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
Органические |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Б |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
Оксиды |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
й |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
Основания |
|
|
|
|
Кислоты |
|
|
|
|
|
Соли |
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
и |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
Окс ды |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
р |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
о |
|
|
|
|
|
|
Несолеобразующие |
|
|
|
||||||||||||||
|
|
|
|
Солеобразующие |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
т |
|
|
|
|
|
|
|
|
|
|
|
(безразличные) |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
и |
|
|
|
|
|
|
|
|
|
|
|
|
NO, CO, SiO, N2O |
|
|
|
||||||||||
|
|
|
Основные |
|
|
К сло ные |
|
|
|
|
Амфотерные |
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
МnОоксид– |
марганца (II). |
|
|
|
|
|
Mn2О7 |
– оксид марганца (VII) |
|||||||||||||||||||||||
|
|
Осн вные: |
|
|
|
|
|
|
|
|
|
|
|
Кислотные: |
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
п |
|
|
|
|
|
|
|
|
|
|
|
|
В2О3 |
– оксид бора; |
|
|
|
|
|
|||||||||||
|
|
Li2O – |
ксидзлития; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
MgO – |
ксид магния; |
|
|
|
|
|
|
|
|
СО2 |
– оксид углерода (IV); |
||||||||||||||||||||
е |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Р |
|
|
|
|
|
Амфотерные |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
BeO |
– оксид бериллия; |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
Al2O3 – оксид алюминия; |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
Cr2O3 – оксид хрома (III); |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
ZnO |
– оксид цинка; |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
SnO |
– оксид олова (II); |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
PbO |
– оксид свинца (II). |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
5

|
|
|
|
|
|
СВОЙСТВА ОКСИДОВ |
|
|
|
|
||||||||
Основные: |
|
|
|
|
|
|
|
Кислотные: |
|
|
|
|
||||||
CaO+СО2 =СаСO3; |
|
|
|
|
|
|
СО2 + СuО =СuСO3; |
|
У |
|||||||||
СuО + H2SO4 = CuSO4 + Н2О; |
|
|
СО2 + NaOН = NaHCO3 |
|||||||||||||||
|
|
|
|
|||||||||||||||
Na2O +H2O=2NaOH; |
|
|
|
|
|
|
|
|
Т |
|||||||||
|
|
|
СО2 + Ва(ОН)2 = ВаСО3↓+ Н2О; |
|||||||||||||||
|
|
t |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СuО + H2 Cu + Н2О. |
|
|
|
SO3 + Н2О =H2SO4. |
|
|
|
|||||||||||
|
|
|
Амфотерные: |
|
|
|
|
Б |
|
|
|
|||||||
|
|
|
ZnO + 2HCl = ZnCl2 + H2O; |
|
|
|
||||||||||||
|
|
|
|
Н |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
t |
|
|
|
|
|
|
||
|
|
|
ZnO + 2 NaOH Na2ZnO2 + H2O; |
|
|
|||||||||||||
|
|
|
ZnO + 2 NaOH+ H2O = Na2[Zn(OH)4]; |
|
|
|
|
|||||||||||
|
|
|
Al2О3 + 6HCl=2AlCl3 +3H2O; |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
р |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
t |
|
|
|
|
|
|
|
|
|
|
|
Аl2О3 + Na2CO3 2NaAlOй2 + CO2; |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
Основания |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
t |
и2NaAlO2 + H2O. |
|
|
|
|
|||
|
|
|
Аl2О3 + 2NaOH |
|
|
|
|
|||||||||||
|
|
|
|
|
|
т |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
и |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
з |
|
|
|
|
|
|
|
|
Труднорастворимые |
|
|
||||
|
Раствор мые |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
щелочи |
) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
( |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
п |
|
|
|
|
|
|
|
Fe(OH)3 – гидроксид железа (III); |
|||||||||
LiOH – гидр ксид лития; |
|
|||||||||||||||||
е |
|
|
|
|
|
|
|
|
Mg(OH)2 – гидроксид магния |
|
|
|||||||
NaOH – гидроксид натрия; |
|
|
|
|||||||||||||||
Р |
|
|
|
|
|
|
|
|
Амфотерные гидроксиды: |
|
|
|||||||
КОН – гидроксид калия; |
|
|
|
|||||||||||||||
RbOH – гидроксид рубидия; |
|
Zn(OH)2 |
= H2ZnO2 |
|
|
|
||||||||||||
CsOH – гидроксид цезия; |
|
гидроксид |
цинковая |
|
|
|
||||||||||||
|
|
цинка |
кислота |
|
|
|
||||||||||||
Са(ОН)2 – гидроксид кальция; |
|
|
|
|
||||||||||||||
Аl(ОН)3 = Н3АlO3 = НАlO2 + Н2О |
||||||||||||||||||
Sr(OH)2 – гидроксид стронция; |
гидроксид |
ортоалю- |
метаалю- |
|
|
|||||||||||||
Ва(ОН)2 – гидроксид бария; |
|
алюминия |
миниевая |
миниевая |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кислота |
кислота |
|
|
|
6
|
|
|
|
|
СВОЙСТВА ОСНОВАНИЙ |
|
|
|||||||
|
КОН +HCl = KCl + H2O; |
|
|
|
|
|
|
|
|
|||||
|
Са(ОН)2+CO2 =CaCO3↓+H2O; |
|
|
|
|
|
|
У |
||||||
|
|
|
|
|
t |
|
|
|
|
|
|
|
||
|
2NaOH +CuSO4 =Cu(OH)2↓+ Na2SO4; |
|
Т |
|||||||||||
|
Al(OH)3 + 3HCl= AlCl3 +3H2O; |
|
|
|
|
|
|
|
||||||
|
Al(OH)3+NaOH= Na[Al(OH)4]; |
|
|
|
|
Н |
|
|||||||
|
Al(OH)3+NaOH NaAlO2 + 2H2O; |
|
|
|
||||||||||
|
|
|
|
|
|
|||||||||
|
|
|
|
|
t |
|
|
|
|
|
Б |
|
|
|
|
Cu(OH)2 CuO+H2O. |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
Кислоты |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
и |
|
|
|
||
|
|
|
|
Бескислородные |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
йК слородсодержащие |
|
|||||
|
|
|
|
|
|
о |
|
|
|
|
|
|
|
|
HF |
|
|
|
H3BО3 |
– ортоборная; |
|
||||||||
– фтороводородная |
|
|
||||||||||||
HCl |
|
– хлороводородная; |
рHBО2 |
– метаборная |
|
|||||||||
HJ |
|
– иодоводородная; |
|
Н2СО3 |
– угольная; |
|
|
|||||||
НВr |
– бромоводородная; |
|
H4SiO4 |
– ортокремниевая, |
||||||||||
H2S |
|
|
з |
|
H2SiO3 |
–метакремниевая |
||||||||
|
– сероводороднаят; |
|
||||||||||||
HCN |
|
– циановодородная; |
|
НNO3 |
–азотная; |
|
|
|||||||
HSCN – р дан видородная. |
|
HNO2 |
– азотистая; |
|
||||||||||
|
|
|
|
о |
|
Н3РО4 |
– ортофосфорная; |
|||||||
е |
|
НРО3 |
– метафосфорная; |
|||||||||||
|
H2SO4 |
– серная; |
|
|
||||||||||
Р |
п |
|
|
|
Н2SО3 |
– сернистая; |
|
|||||||
|
|
|
НМnО4 |
– марганцовая; |
|
|||||||||
|
|
|
|
|
|
|
НClO4 |
– хлорная; |
|
|
||||
|
|
|
|
|
|
|
CH3COOH – уксусная. |
|
||||||
|
|
|
|
СВОЙСТВАКИСЛОТ |
|
|
|
|||||||
HCl + NaOH = NaCl + H2O;
7

2НС1 + BaO = BaCl2 + H2O; |
|
||
2HC1 + Zn = ZnCl2 + H2↑; |
|
||
H2SO4+ CuO = CuSO4 + H2O; |
У |
||
H2SO4 |
+ 2KOH = K2SO4 + 2H2O; |
||
|
|||
H2SO4 |
+K2SiO3 = H2SiO3↓ + K2SO4; |
|
|
HC1 + AgNO3 = AgCl↓ + HNO3. |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
Соли |
|
|
|
Б |
Т |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Основные |
|
||
|
|
|
|
Средние |
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Н |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(гидроксосоли) |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
и |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
Полное замещение |
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
Неполное замещение |
|||||||||||||
|
Н+ в кислотах на ион |
|
|
р |
|
|
||||||||||||||||
|
|
|
|
|
металла |
|
|
|
|
|
йгрупп ОН- в основаниях |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
на кислотный остаток |
|||||||
|
|
|
|
|
|
т |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
Zn(OH)2 + HNO3 = |
||||||||||||
2NaOH + H2SO4 = Na2SO4 |
+ 2H2O; |
|
|
|||||||||||||||||||
Na2SO4 – сульфат на ; |
|
|
|
|
|
|
= ZnOHNO3 + H2O |
|||||||||||||||
Ni(NO3)2 |
|
рия |
|
|
|
|
|
|
CuOHCl – хлорид |
|||||||||||||
– нитрат н келяо(II); |
|
|
||||||||||||||||||||
|
|
|
|
|
з |
|
|
|
|
|
|
|
|
|
гидроксомеди (II); |
|||||||
K2S – сульфид кал я; |
|
|
|
|
|
|
||||||||||||||||
NH4Cl – |
|
д аммон я; |
|
|
|
|
|
|
Fe(OH)2NO3 – нитрат |
|||||||||||||
|
|
|
хлор |
|
|
|
|
|
|
|
|
|
дигидроксожелеза (III); |
|||||||||
Сa3(PO4)2 |
– рт ф сфат кальция. |
|
|
|||||||||||||||||||
|
п |
|
|
|
|
|
|
|
|
|
|
(ZnOH)2SO4 – сульфат |
||||||||||
е |
|
|
|
|
|
|
|
|
|
|
|
|
гидроксоцинка. |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
Кислые (гидросоли) |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
Неполное замещение H+ |
|
|
|
||||||||||||||
|
|
|
|
|
в кислотах на ионы металла |
|
|
|
||||||||||||||
Р |
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
NaOH + H2SO4 = NaHSO4 + H2O; |
|
|
||||||||||||||||
KHSO3 – гидросульфит калия;
А1(Н2РО4)3 – дигидроортофосфат алюминия.
8

|
|
|
|
|
|
|
|
|
|
|
Таблица 1.1 |
|||
|
|
|
|
Кислоты и их соли |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
||||||||
|
Формула кислоты |
|
Формула аниона |
|
Название аниона |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
HBO2 |
|
|
|
BO2- |
|
|
|
Метаборат |
|
|
|||
|
H3BO3 |
|
|
|
BO33- |
|
|
|
|
Т |
|
|||
|
|
|
|
|
|
|
Ортоборат |
|
|
|||||
|
Н2SO4 |
|
|
|
SO42- |
|
|
|
Сульфат |
|
|
|
||
|
H2 SO3 |
|
|
|
|
|
2- |
|
|
|
Н |
У |
||
|
|
|
|
SO32- |
|
|
|
Сульфит |
|
|||||
|
HNO3 |
|
|
|
NO3- |
|
|
|
итрат |
|
|
|
||
|
HNO2 |
|
|
|
NO2- |
|
|
Б |
|
|
|
|||
|
|
|
|
|
|
|
итрит |
|
|
|
||||
|
H2CO3 |
|
|
|
CO32- |
|
|
|
Карбонат |
|
|
|||
|
H2SiO3 |
|
|
|
SiO3 |
|
|
|
Метасиликат |
|
|
|||
|
H3PO4 |
|
|
|
PO43- |
|
|
|
Ортофосфат |
|
|
|||
|
HPO3 |
|
|
|
PO3- |
|
|
|
Метафосфат |
|
|
|||
|
HF |
|
|
|
F- |
р |
й |
Фторид |
|
|
|
|||
|
|
|
|
|
|
|
|
|
||||||
|
HСl |
|
|
|
Cl- |
|
|
|
|
Хлорид |
|
|
|
|
|
HBr |
|
|
|
о |
и |
|
Бромид |
|
|
|
|||
|
|
|
|
Br- |
|
|
|
|
|
|||||
|
HI |
|
|
|
I- |
|
|
|
|
|
Иодид |
|
|
|
|
|
|
|
т |
|
|
|
|
|
|
|
|
||
|
H2S |
|
|
|
S |
2- |
|
|
|
|
Сульфид |
|
|
|
|
HCN |
|
и |
CN- |
|
|
|
Цианид |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||||
|
п |
з |
|
СВОЙСТВАСОЛЕЙ |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Hg(NO3)2 |
+Zn=Zn(NO3)2 +Hg; |
|
|
|
|
|
|
|
|||||
е |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CuSOо4 + 2 NaOH = Cu(OH)2↓+ Na2SO4; |
|
|
|
|
|
||||||||
|
Fe(NO3)2 + H2S = FeS↓ + 2HNO3; |
|
|
|
|
|
|
|||||||
|
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl; |
|
|
|
|
|
|
|||||||
|
KHSO4+ KOH = K2SО4 + H2O; |
|
|
|
|
|
|
|
||||||
РCuOHCl + HCl = CuCI2 + H2O; |
|
|
|
|
|
|
||||||||
t
CuSO4·5H2O CuSO4 + 5H2O.
9
