
Примеры А и Б части
.pdf
|
|
|
|
|
AlCl3 + 3NaOH = 3NaCl + Al(OH)3 |
|
||||||||||||||
|
|
|
|
|
Al(OH)3 + NaOH =Na[Al(OH)4] |
|
||||||||||||||
|
|
|
|
|
||||||||||||||||
|
|
4NaOH + AlCl3 = 3NaCl + Na[Al(OH)4] (суммарное уравнение). |
||||||||||||||||||
|
|
|
|
|
|
|
4 MNaOH |
– MAlCl3 |
|
|
|
У |
||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
mNaOH – mAlCl3 . |
|
|
|
|
Н |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
mNaOH = |
4MNaOH mAlCl3 |
= |
4 40 4,5 |
= 5,39 г; Т |
|||||||||||||
|
|
|
|
|
|
|
|
133,5 |
|
|||||||||||
|
|
|
|
|
|
|
MAlCl3 |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
й |
|
|
|
|
||
|
|
|
сэк(NaOH) = |
|
|
|
mNaOH |
|
|
; |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
Mэк(NaOH) Vр ра(БNaOH) |
|
|||||||||
|
откуда |
|
|
|
|
|
|
|
р |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
mNaOH |
|
|
|
|
|||
|
|
|
Vр ра(NaOH) |
|
|
и |
|
= |
|
|||||||||||
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
M (NaOH) c (NaOH) |
|
|||||||||
|
|
|
|
|
|
т3 |
эк |
|
|
|
эк |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
= |
5,39 |
|
|
= 0,135 л = 135 см3. |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
и |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
40о1 |
|
|
|
|
|
|
|
|
|
||||
|
|
Ответ: Vр-ра(NaOH) = 135 cм . |
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
о |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2. Определить, образуется ли осадок хлорида свинца (II), ес- |
||||||||||||||||||
|
|
п |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
ли к 0,05 Мзраствору нитрата свинца (II) добавить равный объ- |
|||||||||||||||||||
|
ем 0,02 М раств ра хлороводородной кислоты. |
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Решение |
|
|||||
|
Дано: |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Р |
|
|
|
|
|
|
|
|
|
При сливании растворов протекает |
||||||||||
|
сHCl = 0,02 M |
|
|
|
|
|
|
|||||||||||||
ес |
= 0,05 M |
|
следующая реакция: |
|
|
|
|
|||||||||||||
|
|
Pb(NO3)2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
V(р-ра)HCl V(р ра)Pb(NO3)2 |
|
Pb(NO3)2 + 2HCl = PbCl2 + 2HNO3. |
|||||||||||||||||
|
Образуется ли осадок – ? |
|
|
Осадок PbCl2 образуется только в |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
случае, если |
|
|
|
|
|
|
||||
140
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
сPb2 · сCl > ПРPbCl2 |
= 2·10 |
|
(таблица). |
|
|||||||||||||||||||||||
С учетом увеличения объема раствора при сливании в 2 раза: |
||||||||||||||||||||||||||||||||||||
с |
|
2 = |
1 |
|
сPb(NO |
|
) |
· ·n |
|
|
|
2 = |
|
1 |
5 10 2 |
1 1= 2,5·10-2 моль/л; |
||||||||||||||||||||
Pb |
2 |
|
3 |
Pb |
|
2 |
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Т |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
с |
|
|
|
= |
сHCl · ·n |
|
|
= |
|
2 10 2 |
|
1 1 |
Н |
|||||||||||||||||||||
|
|
|
Cl |
|
|
|
|
2 |
|
|
|
|
|
|
Cl |
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
2 |
|
2 |
|
|
6 |
|
|||
|
|
|
|
|
|
|
|
сPb2 ·сCl |
= 2,5·10 |
|
|
|
·(1·10 |
|
) = |
2,5·10 |
|
. |
||||||||||||||||||
Так как 2,5·10 6 < 2·10-5 (ПРPbCl |
|
|
|
|
й |
|
|
|||||||||||||||||||||||||||||
2 |
), то осадок PbClБ2 не образуется. |
|||||||||||||||||||||||||||||||||||
Ответ: осадок PbCl2 |
не образуется . |
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
3. |
Составить схему ко |
|
|
р |
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
оз онного ГЭ, возникающего при |
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
о |
|
|
|
|
|
|
|
|
|
3 |
|
|
|||||||||
контакте оловянной пластинкииплощадью 35 см2 с медной в |
||||||||||||||||||||||||||||||||||||
растворе соляной кисл |
|
|
|
|
. |
Написать уравнения электродных |
||||||||||||||||||||||||||||||
процессов и суммарной реакции процесса коррозии. |
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
и |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
а) Вычислить объемный и весовой показатели коррозии, если |
||||||||||||||||||||||||||||||||||||
за70 мин впроцессе коррозии выделилось 1,5 см газа(н.у.). |
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
з |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
б) Вычисл ть весовойтыи глубинный показатели коррозии, |
||||||||||||||||||||||||||||||||||||
если за 80 мин потеря массы корродируемого металла состави- |
||||||||||||||||||||||||||||||||||||
|
|
|
|
-3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
ла 5,6 ·10 |
|
г. Пл тность металла 7,3 г/см . |
|
|
|
|
||||||||||||||||||||||||||||||
|
п |
|
|
|
|
|
|
|
|
|
|
|
|
|
Решение |
|
|
|
|
|
|
|
||||||||||||||
По таблицеонаходим значения стандартных электродных потен- |
||||||||||||||||||||||||||||||||||||
циалов олова (II) и меди (II): |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
е |
|
|
|
|
|
0 |
|
|
|
= – 0,14 В, 0 |
|
|
|
|
= |
0,34 В. |
|
|||||||||||||||||||
РТак как 0 |
Sn2 /Sn |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cu2 /Cu |
|
|
|
|
||||||||||||||||
|
|
< 0 |
|
|
|
/Cu |
, то анодом в коррозионном ГЭ бу- |
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
Sn2 /Sn |
|
|
Cu2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
дет олово, катодом – медь.
141
Составим схему коррозионного ГЭ:
|
или |
|
|
|
|
|
А(-)Sn |
│ |
|
HCl |
|
│ |
Cu(+)K |
|
|
|
||||||||||
|
|
|
|
|
|
А(-)Sn |
│ |
|
H+ |
│ |
Cu(+)K |
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
Cоставляем уравнения электродных процессов и суммарной ре- |
||||||||||||||||||||||||
|
акции процесса коррозии: |
|
|
|
|
|
|
|
|
|
|
|
|
Т |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
Н |
У |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
На A(-)Sn – 2ē = Sn2+ |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
На К(+)2Н+ + 2ē = Н2 |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
Sn + 2H+ = Sn2+ + H2 |
Б |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
Sn + 2HCl = SnCl2 + H2 – суммарная реакция процесса коррозии. |
||||||||||||||||||||||||
|
|
а) Рассчитываем объемный показатель коррозии (KV) поформуле |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
и |
|
|
|
|
|
|
|||||
|
Дано: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Vгаза |
|
3 |
|
2 |
|
|
||||
|
τ = 70 мин |
|
|
|
|
|
|
|
|
|
|
KV = |
|
|
|
|
, см /м ·час. |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
й |
|
|
|
||||||||||
|
Vгаза = 1,5см3 |
|
|
|
|
|
|
газаобъем |
|
S |
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
S |
= 35 см |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
При |
асчете KV принимаем: |
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
т |
рщадь поверхности анода, м2; |
|
|||||||||||||
|
KV –? |
|
|
|
|
|
|
|
|
S – пл |
|
|||||||||||||||
|
Km – ? |
|
|
|
|
|
|
|
|
τ – время пр цесса коррозии, ч; |
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
V |
– |
|
|
выделившегося газа, см3. |
|
||||||||||||
|
|
Из уравнен я суммарной реакции процесса коррозии следует, |
||||||||||||||||||||||||
|
|
|
о |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
что при к рр |
ииивыделяется водород. Следовательно, Vгаза = VH2 . |
||||||||||||||||||||||||
|
|
Тогда |
|
з |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
е |
|
|
|
VH |
|
|
|
|
|
1,5 |
|
|
|
|
367,3 см3/м2·ч. |
|
|
|||||||||
Р |
|
|
KV = |
|
|
2 |
|
= |
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
п |
|
|
S |
|
|
35 10 |
4 70/60 |
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
ассчитываем весовой показатель коррозии Km по формуле |
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
Km = KV |
Mэк (Me) |
|
2 |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
, г/м ·ч. |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Mэк (газа) |
|
|
|
|
|
|
|
||||
142

В процессе коррозии разрушению подвергается олово и выделяется водород.
Следовательно:
Мэк(Ме) = Мэк(Sn) = MSn 119 = 59,5 г/моль,
n 2
|
|
|
|
|
|
VMэк (газа) VMэк (Н) = 11200 см3/моль. |
Т |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
Mэк (Sn) |
|
|
|
|
|
|
59,5 |
|
2 |
|
У |
|||||||
|
|
|
|
|
Km = KV |
|
|
|
|
|
|
|
|
367,3 |
|
|
|
|
= 1,95 г/м ·ч. |
|
|
||||||
|
|
|
|
|
|
V |
Mэк (H) |
|
11200 |
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Б |
|
|
||||||
|
|
Ответ: KV = 367,3 см3/м2·ч. |
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
Н |
|
|||||||||||||||||
|
|
|
|
Km = 1,95 г/м2·ч. |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
б) Рассчитываем весовой показатель коррозии Km по формуле |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
озии |
|
|
|
|
|
|||||||
|
S = 35 см |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
Дано: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Km = |
|
mMe |
, г/м2·ч. |
|
|||||||
|
τ = 80 мин |
|
|
|
|
|
|
|
|
|
|
р |
йS |
|
|
||||||||||||
|
m |
Me |
5,6·10-3 г |
|
|
|
Ко |
|
|
|
подвергается олово. |
|
|||||||||||||||
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ρMe = 7,3 г/см3 |
|
|
|
|
|
|
|
|
|
Т гда потеря массы металла |
|
|||||||||||||||
|
Km |
– ? |
|
|
|
иMe |
|
|
|
|
|
|
mMe mSn . |
|
|
||||||||||||
|
П – ? |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
з |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
При расчете Km пртн маем |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
m – г; S – м2, τ – ч. |
|
|
||||||||||||||
|
|
Тогда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
е |
о |
|
m |
|
5,6 10 3 |
2 |
|
|
|||||||||||||||||||
|
|
п |
Km = |
|
|
|
Sn |
= |
|
|
|
|
|
|
|
|
= 1,2 г/м ·ч. |
|
|
||||||||
Р |
|
|
|
|
35 10 4 80/60 |
|
|
||||||||||||||||||||
|
|
|
S |
|
|
|
|
|
|||||||||||||||||||
ассчитываем глубинный показатель коррозии по формуле |
|
||||||||||||||||||||||||||
|
|
|
|
П = Km |
|
8,76 |
= 1,2 |
8,76 |
1,44 мм/год. |
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
Me |
7,3 |
|
|
|
|
|
|
|
|
|
||||||
Ответ: Km = 1,2 г/м2·ч, П = 1,44 мм/год.
143
17. МЕТАЛЛЫ V–VI ГРУППЫ УРОВЕНЬ А
1. Определить степень окисления всех элементов в соедине- |
||||||||||||||||||||||
ниях WO2, WBr5, (NH4)2WO4. |
|
|
|
|
|
|
У |
|||||||||||||||
Ответ: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Т |
||||
+4 -2 +5-1 |
|
-3+1 +6-2 |
|
|
|
|
|
|
|
|
|
|||||||||||
WO2, WBr5, (NH4)2WO4 |
|
|
|
|
|
|
|
|||||||||||||||
2. Как изменяются кислотно-основные свойства гидрокси- |
||||||||||||||||||||||
дов хрома с увеличением его степени окисления в ряду |
|
|||||||||||||||||||||
Сr+2, Сr+3, Сr+6? |
|
|
|
|
|
|
|
|
|
|
|
Н |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
й |
|
||
Ответ: В указанном ряду с увеличением степениБокисления хро- |
||||||||||||||||||||||
ма кислотные свойства гидроксидов ус л |
ваются, а основные свой- |
|||||||||||||||||||||
ства ослабевают: (Cr(OH)2 |
Сr(OH)3 |
H2CrO4). |
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
основание |
|
|
HCrO2 |
кислота |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
амфотер |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
т |
|
|
и. гидроксид |
|
||||||||
3. Написать сокращеннуюрэлектронную формулу атомов |
||||||||||||||||||||||
вольфрама, |
ванадия ни бия и указать расположение валент- |
|||||||||||||||||||||
ных электронов по подуровням. |
|
|
||||||||||||||||||||
|
|
|
|
|
з |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
о |
|
и |
|
|
|
|
|
|
|
|
|
|
|||||||
Ответ: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
74W – 5d46s2 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
п |
|
|
|
|
|
|
|
|
5d |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
6s |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Р |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
23 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
еV – 3d 4s |
|
|
|
|
|
|
3d |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
4s |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
144
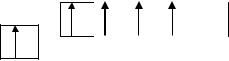
41Nb – 4d45s1
4d
5s
|
|
|
|
|
|
УРОВЕНЬ В |
|
|
Н |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
1. Можно ли восстановить оксид хрома (III) до металлаУпри |
|||||||||||||
|
стандартных условиях: |
|
|
|
|
|
|
Б |
Т |
|||||
|
а) цинком; |
|
|
|
|
|
|
|
|
|||||
|
б) кремнием. |
|
|
|
rGo(298 K) по |
fGo(298 K, B). |
||||||||
|
Ответ подтвердить расчетом |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
й |
|
|
||
|
Дано: |
|
|
|
|
|
|
|
|
|
Решение |
|
|
|
|
Cr2O3(к) |
|
|
|
|
|
|
из |
|
|
|
|||
|
Zn(к) |
|
|
|
|
а) Составляем уравнение реакции и рас- |
||||||||
|
|
|
|
|
|
|
р |
|
|
е стандартной энергии |
||||
|
Si(к) |
|
|
|
считываем |
зменен |
||||||||
|
|
|
|
Гиббса |
rGº(298 |
K) |
реакции, используя I |
|||||||
|
|
|
|
|
||||||||||
|
|
|
|
|
|
о |
закона Гесса. Значения стан- |
|||||||
|
Cr – ? |
|
|
|
следствие |
|||||||||
|
|
|
|
|
т |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
дартных эне гий Гиббса образования ве- |
|||||||||
|
|
|
|
|
щес в |
|
fGº (298 K,B) берем из таблицы. |
|||||||
|
|
|
|
и |
+ 3Zn(к) = 2Сr(к) + 3ZnO(к), |
|
|
|||||||
|
|
|
|
Cr2O3(к) |
|
|
||||||||
|
fGº(298 K) – 1058,97 0 |
|
0 |
|
3(-320,7) |
|
|
|||||||
|
кДж/ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
п |
|
|
|
|
|
|
|
|
|
|
|
||
|
rGº(298зK) = [3ΔfGº(298 K, ZnO(к)) + 2ΔfGº(298 K, Сr(к))] – |
|||||||||||||
е |
|
– [ΔfGº(298 K, Cr2O3(к)) + 3ΔfGº(298 K, Zn(к))] = |
|
|||||||||||
моль= 3(–320,7) – (–1058,97) = 96,87 кДж. |
|
|||||||||||||
Р |
|
|||||||||||||
|
Так как rGº(298 K) > 0, то при стандартных условиях реакция |
|||||||||||||
|
невозможна. |
|
|
|
|
|
|
|
|
|
|
|
||
|
б) Аналогично |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
2Cr2O3(к) |
+ 3Si(к) |
= 4Сr(к) |
+ 3SiО2(к) |
|
||||||
|
fGº(298K) 2(–1058,97) |
|
0 |
|
|
0 |
|
3(-856,7) |
|
|||||
145
кДж/моль
rGº(298 K) = [3ΔfGº(298 K, SiO2(к)) + 4ΔfGº(298 K, Cr(к))] –
–[2ΔfGº(298 K, Cr2O3(к)) + 3ΔfGº(298 K, Si(к))] =
=3(–856,7) – 2(–1058,97) = –452,16 кДж.
|
Так как |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
У |
|
|
|
rGº(298 K) < 0, то самопроизвольное протекание реак- |
||||||||||||||||||||||||||
|
ции при стандартных условиях возможно. |
|
|
|
|
|
Т |
|||||||||||||||||||||
|
Ответ: |
при |
стандартных |
|
условиях возможно |
|
||||||||||||||||||||||
|
|
восстановление |
||||||||||||||||||||||||||
|
хрома из оксида хрома (III) только кремнием. |
|
|
|
Н |
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Б |
|
|
|
|||
|
2. Определить рН раствора, при котором установилось рав- |
|||||||||||||||||||||||||||
|
новесие: 2CrO42 |
+ 2H+ <=> Cr2O72 + H2O. Равновесные концен- |
||||||||||||||||||||||||||
|
трации ионов |
|
Cr2O72 |
и |
CrO42 соответственно равны 4,5 и |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
и |
|
|
18 |
|
|
|
|
||
|
0,001 моль/л. Константа равновесия Кс = 1,1·10 . |
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
йРешение |
|
|
|
|||||
|
Дано: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2CrO2 |
|
|
|
|||||||||
|
[Cr2O2 ] = 4,5 моль/л |
|
|
|
|
|
+ 2H+ <=> Cr2O2 + H2O |
|||||||||||||||||||||
|
7 |
|
|
|
|
|
|
|
|
|
|
о |
4 |
|
|
4 |
|
|
7 |
|
|
|
||||||
|
[CrO42 ] = 0,001 моль/л |
|
|
|
|
|
р |
рН = -lg[H+] |
|
|
|
|||||||||||||||||
|
Кс = 1,1·10 |
18 |
|
|
|
|
т |
|
|
[Cr O |
2 ] |
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Kc = |
|
2 |
|
7 |
; |
|
|
|||||
|
рН – ? |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
[CrO2 ]2[H ]2 |
|
|
|||||||
|
|
|
|
з |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
о |
|
[Cr O2 |
] |
|
|
|
|
|
|
|
|
4,5 |
|
|
|
|
|
|
6 |
|
||||||
|
|
|
2 |
7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
[H ] = |
|
|
и |
|
|
|
|
= |
|
|
|
|
|
|
|
2,02 10 |
|
. |
|||||||||
|
|
|
|
|
|
]2 |
K |
|
|
(0,001)2 1,1 1018 |
|
|||||||||||||||||
|
|
|
|
|
[CrO2 |
c |
|
|
|
|
|
|
|
|
||||||||||||||
е |
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
рН = -lg2,02·10-6 |
= 5,7. |
|
|
|
|
|
|
|||||||||||||
|
Отвпт: рН = 5,7. |
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
3. Шестивалентный |
элемент образует оксид, содержащий |
||||||||||||||||||||||||||
|
20,71 % мас. кислорода. Вычислить молярную массу эквива- |
|||||||||||||||||||||||||||
Рлента элемента и назвать элемент. |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
146

Дано: |
Решение |
|
O2 |
20,71 % мас. |
По закону эквивалентов: |
В = 6 |
|
nэк(О2) = nэк(Э); |
|
Мэк(Э) – ? |
|
|
|
|
|
|
|
|
mO |
2 |
|
m |
|
|
|
У |
||
|
Э – ? |
|
|
|
|
|
|
|
|
|
|
|
|
э |
|
; |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
Мэк (О) |
Мэк(Э) |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
Мэк(О) = 8 г/моль; |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Мэк(Э) = |
mэ Мэк (О) |
; |
|
|
|
Т |
||||||||
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
mО2 |
|
|
|
Н |
|
|||||
|
|
|
|
|
|
|
mокс = mэ + mO2 ; |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
Б |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
mэ = 100 – mO2 |
= 100 – 20,71 = 79,29 г. |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
й |
|
|
|
|
|
|||
|
|
Мэк(Э) = |
|
79,29 8 |
= 30,63 ги/моль; |
Мэк(Э) = |
Мэ |
, |
|
||||||||||
|
|
|
|
|
|
||||||||||||||
|
|
|
|
20,71 |
|
|
р |
|
|
|
|
|
|
В |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
где В – валентность элемен а. |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
о |
|
|
|
|
|
|
|
|
|
|||
|
Мэ = Мэк(Э)·В = 30,63·6т= 183,77 г/моль, что соответствует моле- |
||||||||||||||||||
кулярной массе атома вольфрама . |
|
|
|
|
|
|
|
|
|
||||||||||
|
Ответ: Мэк(Э) |
и= 30,63 г/моль; элемент – W. |
|
|
|
|
|
|
|||||||||||
|
|
|
з |
|
УРОВЕНЬ С |
|
|
|
|
|
|
|
|
||||||
|
|
о |
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
1. Уравнять реакцию |
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
п |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cr(NO3)3 + Br2 + KOH → K2CrO4 + KBr + KNO3 + H2O , |
||||||||||||||||||
е |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
указать окислитель и восстановитель. |
|
|
|
|
|
|
|
|
|||||||||||
РОпределить, |
какой объем 2 н раствора нитрата хрома (III) |
||||||||||||||||||
расходуется на взаимодействие с бромом массой 4,3 г.
147

|
Дано: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Решение |
|
|
|
|
|
||||||||
|
mBr |
= 4,3 г |
|
|
|
|
|
|
|
|
|
|
Cr+3(NO3)3 + Br20 + KOH → |
|
||||||||||||||||
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
сэк(Cr(NO3)3) = 2 моль/л |
|
|
|
→ K2Cr+6O4 + KBr-1 + KNO3 + H2O. |
|||||||||||||||||||||||||
|
Vр-ра ( |
|
|
|
– ? |
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
У |
||||
|
|
|
Cr(NO3)3) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
Cr+3 – 3e = Cr+6 |
|
|
НОК |
ДМ |
|
|
|
Т |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
восст-ль |
|
3 |
|
|
|
1 |
|
|
|
|
2 |
|
|
||||||||||||
|
|
|
|
|
окисл-ль Br0 + e = Br- |
|
|
|
|
|
|
Н |
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
6 |
|
|
||||||||||||
|
|
|
|
|
|
|
|
3Br2 + 2Cr+3 = 6Br- + 2Cr+6 |
|
Б |
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
Переносим найденные коэффициенты в молекулярное уравне- |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
й |
|
|
|
|
|
|
|
||||||
ние. Уравниваем число ионов: NO →6KNO |
3 |
. Считаем число ио- |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
и |
|
|
|
|
|
|
|
|
|
|||||
нов К+ в продуктах реакции и определяем коэффициент перед |
||||||||||||||||||||||||||||||
КОН → 16КОН. Уравниваем число атомов Н и О → 8Н2О. |
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
р |
|
+ 6KBr + 6KNO3 + 8H2O. |
|||||||||||||
|
|
2Cr(NO3)3 + 3Br2 + 16KOH = 2K2CrO4 |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
о |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
По закону эквивалент в: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
и |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
з |
|
|
nэк(Cr(NO3)3) = nэк(Br2); |
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
т |
|
|
|
|
|
|
|
mBr |
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
Vр-ра ( |
|
|
|
|
|
|
·сэк(Cr(NO3)3) = |
|
|
|
2 |
|
|
; |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
о |
|
Cr(NO3)3) |
|
1 |
|
|
|
|
Mэк(Br) |
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
е |
|
|
|
|
Mэк(Br) = |
|
79,9 |
79,9 г/моль; |
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Р |
п |
|
|
|
|
|
|
Vр-ра ( |
|
|
|
·2 = |
4,3 ; |
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Cr(NO3)3) |
|
79,9 |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
Vр-ра ( |
|
|
|
|
|
= 0,0269 л = 26,9 см3. |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
Cr(NO3)3) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
Ответ: Vр-ра ( |
|
|
|
|
|
= 26,9 см3. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
Cr(NO3)3) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
148
2. Найти массы воды и кристаллогидрата CrCl3·6H2O, необходимые для приготовления 1 л раствора, содержащего 5 % (мас.) безводной соли. Плотность 5 % раствора CrCl3 равна 1,05 г.
|
Дано: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Решение |
|
|
|
|
|||||
|
Vр-ра = 1 л |
|
|
|
|
|
|
|
|
По определению |
|
|
|
|
|
|
|
|
|||||||||||
|
ωCrCl3 |
= 5% |
|
|
|
|
|
|
|
|
|
|
|
Т |
|||||||||||||||
|
ρр-ра= 1,05 г/см3 |
|
|
|
|
|
|
|
|
|
|
|
|
mCrCl |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
ωCrCl3 |
= |
|
|
Н |
У |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m |
|
3 |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
100, % |
|
||||||||||
|
mH2O ? |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
р ра |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Б |
|
|
|||||||
|
m |
|
|
|
|
? |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CrCl |
3 |
mр ра |
|
|
|||||||
|
|
CrCl 6H O |
|
|
|
|
|
|
откуда |
|
|
mCrCl3 |
|
|
|
|
|
|
|
|
|
||||||||
|
|
3 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
100 |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
Масса раствора равна |
|
|
|
|
|
|
й |
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
и |
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
mр ра |
|
|
|
, |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Vр ра р ра |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
итров |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
о |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
mр-ра = 1·103·1,05 =1050 г, |
|
|
|
|
|
|
||||||||||
где 103 – коэффициент перев да л |
|
|
|
в сантиметры кубические. |
|||||||||||||||||||||||||
|
|
Тогда масса CrCl3 |
в рас в ре с ставляет: |
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
и |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
з |
тm 1050 5 52,5 г . |
|
|
|
|
|
|
|||||||||||||||
|
|
|
по |
|
|
|
CrCl3 |
100 |
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
Масса CrCl3·6H2O, в которой содержится 52,5 г CrCl3, может |
|||||||||||||||||||||||||||
|
|
п |
|
|
|
|
пропорции |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
быть найдена |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
е |
|
|
|
|
|
|
|
|
MCrCl |
|
|
|
|
|
|
266 г/моль – 158 г/моль |
|
||||||||||||
Р |
MCrCl |
3 |
6H |
2 |
O |
3 |
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
mCrCl3 |
6H2O |
mCrCl3 |
|
|
|
|
|
|
mCrCl3 6H2O – 52,5 г. |
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
Тогда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m |
CrCl3 6H2O |
|
266 52,5 |
88,39 г . |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
158 |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
149
