
- •Старение, возрастные патологии и канцерогенез
- •Ил. 27. Табл. 3. Библиогр.– 3000 назв.
- •Кислородно-перекисная концепция старения
- •1.1. Общие положения и основные принципы
- •Гетерогенность старения
- •Дисгармонии между целым
- •1.2. Взаимосвязь процессов старения и перекисного окисления липидов
- •1.3. Митохондрии – наиболее уязвимое и основное «стартовое» звено в старении клетки
- •1.4. Возрастные изменения других клеточных структур и функций
- •1.5. Старение систем организма
- •Внутриклеточная
- •1.6. Некоторые «парадоксальные» феномены при старении
- •1.7. Возрастные патологии
- •1.7.1. Атеросклероз
- •1.7.2. Сахарный диабет типа 2
- •1.7.3. Болезнь Альцгеймера
- •1.8. Старение клеток in vitro
- •1.9. Антиоксиданты как геропротекторы
- •2.1. Митохондрии как первичный объект повреждения и индукции пероксидативного состояния в клетке
- •2.2. Опухолевый ангиогенез
- •2.3. Канцерогенная направленность и следствия глобальной пероксигенации в клетке
- •2.4. Возможная роль пероксигенации в инвазивном росте и метастазировании неоплазм
- •2.5. Пероксигеназные процессы и лейкозогенез
- •2.6. Воспаление и канцерогенез
- •Регуляторные аспекты клеточной пролиферации, опухолевой промоции и канцерогенеза
- •3.1. Сходство направления изменений при стимуляции клеток опухолевыми промоторами и канцерогенезе
- •3.2. Элементы систем биорегуляции митогенеза и опухолевой промоции
- •3.3. Об элементарных генераторах первичного митогенного сигнала
- •3.4. Некоторые вопросы преобразований и реализации пролиферативного сигнала
- •3.5. Фосфолипиды и позиционный (релейный) принцип регуляции активности ферментов
- •3.6. Биоэнергетические аспекты механизма пролиферации и дифференцировки клеток
- •4.1. Общая характеристика феномена «спонтанной» малигнизации клеток в культуре
- •4.2. Основные положения кислородно-перекисной
- •Угнетающее действие естественной гипероксии на внутриклеточные процессы, на рост клеточных культур в начальный период их жизни
- •1. Накопление активных радикальных центров в вакууме (при гипоксии)
- •2. Развитие хемилюминесцентной реакции при последующем пуске воз-духа (о2)
- •5.1. Полимерный канцерогенез: некоторые исходные факты и положения
- •5.2. Особенности индукции полимерного канцерогенеза и их интерпретация
- •5.3. Канцерогенез, индуцируемый природными и искусственными минеральными частицами
- •Взаимоотношения организма и опухоли
- •6.1. Изменение форменных элементов и белков крови
- •6.2. Мембранотоксическая активность неоплазмы как патогенетический фактор изменения клеток крови и опухолевого роста
- •6.3. Расстройство энергетического гомеостаза
- •6.4. Расстройство других видов обмена и регуляции
6.4. Расстройство других видов обмена и регуляции
в организме опухоленосителя
Системное действие опухоли на непосредственно не затронутые ею ткани и эндокринные железы ведёт параллельно или вслед за нарушением энергетичес-кого обмена к расстройству гомеостаза организма в целом. Многие имеющие к нему отношение эффекты давно и подробно описаны в литературе (Кавецкий, 1977; Шапот, 1975, 1979), но до сих пор, по существу, не объяснены. Как нам представляется, накопление продуктов свободнорадикального окисления в фос-фолипидах органов животных-опухоленосителей вызывает структурные нару-шения в мембранных образованиях клетки, которые, в свою очередь, ответст-венны за многие такие же эффекты, как и проявляющиеся в клетках самой
Выделение опухолевыми клетками в
окружающую среду гексокиназы, ингибиторов
дыхания, активных форм О2, продуктов
ПОЛ
Усиление гликолиза в том числе
cАМP-ингибируемого
Распространение этих веществ через
кровеносную систему по всему организму
опухоленосителя (опухолевая интоксикация)
Изменения в напра-влении деспециали-зации
и уменьшения управляемости кле-ток
тканей, не пора-женных опухолью
Развитие ПОЛ в мембранах эритроцитов
(эхиноцитоз)
Уменьшение массы функци-ональнополноценных
эритро-цитов и гемо-лиз части из них
Повышение в них внутриклеточных уровней
рО2 и ПОЛ мембран
Деградация части дыхательных фер-ментов
и митохон-дрий в гипоксичес-ких клетках
Выделение нормаль-ными гипероксичес-кими
клетками проду-ктов ПОЛ в окружаю-щую
их среду и в кро-веносные сосуды
Сохранение в некоторых клетках
относительной гипероксии, возникшей
до тканевой гипоксии и поддерживаемой
за счет ослабления дыхания в уловиях
избыточного ПОЛ
Возникновение в тканях опухолевого
организма относительной гипоксии
Снижение поступления О2 в клетки
вслед за тканевой гипоксией
Образование гипоксии в клетках, не
подвергнутых непосредственно опухолевой
интоксикации
Рис.26. Функциональная
схема системного действия
опухоли на организм
(энергетический аспект).
Пути индуцирования гипероксии и ПОЛ и
замкнутый контур
их поддержания выделены жирными
стрелками.










Снижение уровней АТP и cАМP
Снижение интенсивности дыхания, в том
числе cАМP-стимулируемого, в клетках
тканей, не затронутых неоплазмой
Вазоконстрикторная реакция
микроциркуляторного русла (периферических
сосудов) на продукты ПОЛ


неоплазмы (см. п. 2.1-2.3). Возможно, именно поэтому в отдалённых от неё нормальных тканях обнаруживаются характерные «раковые черты». О послед-ствиях в энергетическом обмене говорилось выше. Рассмотрим теперь другие факты, которые в той или иной степени могут быть интерпретированы с позиций развиваемых в данной книге представлений.
6.4.1. С состоянием пероксидации липидов и повышенным их потребле-нием клетками прежде всего периферийных, активно растущих участков нео-плазмы коррелирует усиленная мобилизация липидов в организме опухолено-сителя (Ланкин, 1971). Односторонний их транспорт в направлении новообра-зования приводит к тому, что содержание липидов в жировых депо такого организма падает в 10 раз, а в скелетных мышцах – в 2,5 раза (Шапот, 1979). Более того, опираясь на концепции предыдущих построений модели, можно прийти к мысли: по мере приобретения нормальными тканями «опухолевых» черт они также должны стать «ловушкой» липидов, хотя и менее активной, чем сама неоплазма. Это, естественно, усугубляет процесс обеднения липидами некоторых тканей организма-хозяина.
В различных органах мышей через 24 ч после перевивки им саркомы 180 содержание продуктов ПОЛ резко повышалось, например, в мозгу на 25 %, в печени – на 290 %. Одновременно в этих же органах снижалось содержание SH-групп, причём максимум снижения соответствовал группе животных, где масса опухоли была наибольшей (Гевондян и др., 1978). Все эти эффекты авторы логично объясняют усилением свободнорадикального ПОЛ биомембран в органах опухоленосителя. В условиях пероксидации концентрация SH-групп и должна уменьшаться – ведь, действуя на разных уровнях антиоксидантной системы клетки (см. Лю, Шайхутдинов, 1991), они расходуются в реакциях с молекулярным О2, свободными радикалами и перекисями липидов.
Весьма демонстративны последствия избыточного ПОЛ в мембранах мик-росом, где вследствие нарушения связи с ними полирибосом резко уменьшается доля мембраносвязанных и увеличивается доля свободных рибосом при неиз-менном их общем количестве. Этот, как считалось, характерный для опухоле-вых клеток феномен (см. п. 2.3.6) оказался присущ и некоторым нормальным тканям опухолевого организма, что, естественно, ведёт к количественному перераспределению белков, синтезируемых на указанных двух категориях ри-босом. Так, одной из причин гипоальбуминемии у онкологических больных и у животных с неоплазмой признана ослабленная способность печени к синтезу сывороточного альбумина. Последний же образуется на мембраносвязанных полирибосомах, но количество их в клетках печени у животных с разными моделями опухолей составляет всего лишь 65-50 % нормы (Шапот, 1979). Пос-ледствия дефицита альбумина могут быть весьма негативными, учитывая, в частности, влияние его на состояние и функцию митохондрий. В норме альбу-мин обеспечивает необходимую жизнедеятельность этих органелл доставкой микроэлементов, жирных кислот и набора аминокислот, которые особенно важ-ны в условиях окислительного стресса, приводящего к дестабилизации и умень-шению числа митохондрий (Seaton, 1995). При дефиците же альбумина проти-водействие его этим нарушениям в какой-то мере ограничивается. А в клетках органов и тканей, непосредственно не поражённых опухолью, гипоальбумине-мия, очевидно, способствует расстройству структуры и функции митохондрий, предоставляя дополнительную возможность для продвижения указанных кле-ток к состоянию гипероксии и пероксидации, изменения в них метаболизма по типу опухолевого.
По-видимому, активность таких ферментов мембраносвязанных рибосом печени, как ДНК-аза и РНК-аза (принадлежат к числу структурных рибосомных белков), каким-то образом зависит от наличия этой связанности. Действитель-но, у крыс с перевитой им в брюшную полость гепатомой Зайделя отношение мембраносвязанных рибосом к свободным уменьшалось в печени с 3,0 до 0,6. При этом активность указанных ферментов значительно падала, имея тенден-цию приближения к весьма низкой их активности в рибосомах самой гепатомы (Шапот, 1979). Как представляется нам, той же причиной, т. е. дестабилизацией микросомальных мембран при ПОЛ в тканях, не затронутых неоплазмой, мож-но объяснить и ряд других диспропорций в синтезе белков на «экспорт» и для собственных нужд конкретной ткани. Однако есть и факты, которые не согла-суются с феноменом нарушения рибосомомембранной связи. Так, если данные о синтезе SODs преимущественно на свободных полирибосомах (Hirano et al., 1985) достоверны, то содержание и активность этих ферментов в отдалённых тканях опухолевого организма должны быть увеличенными. Исследования же некоторых авторов (Leuthauser et al., 1984) показали обратное – снижение ак-тивности SODs в печени, селезенке, почках, лёгком и мышцах ноги мышей через 2-24 дня после перевивки им в правую часть мышц живота клеток рака Эрлиха. Это несоответствие можно, вероятно, в какой-то мере оправдать спо-собностью первичных продуктов ПОЛ ингибировать SODs (Гудзь и др., 1982).
При ПОЛ в мембранах микросом функциональная активность монооксиге-назной ферментной системы и, прежде всего, основного её компонента – CYP снижается. В результате ослабляется её способность обезвреживать различные ксенобиотики. Поэтому животные с опухолью в принципе должны быть более чувствительными к действию чужеродных соединений. Со ссылкой на итальян-ских авторов Рассо и Данелли в книге Шапота (1975) приведён наглядный пример: крысы с 10 различными штаммами перевивных опухолей из-за резкого падения в микросомах печени индуцибельности ферментов становились чувст-вительными к парализующему и наркотизирующему действию оксазолина и пентабарбитала соответственно.
Распространение ПОЛ на плазматическую мембрану неминуемо должно отразиться на свойствах клеточных рецепторов, «встроенных» в её липидный бислой и часто сопряжённых с каким-либо ферментом этой мембраны. Данные об изменении свойств рецепторов определённой локализации у опухоленоси-телей действительно имеются. Например, на белых крысах показано резкое ослабление реакции сокращения матки и семявыносящего протока на серото-нин и α-адренергические воздействия после перевивки им под кожу карцино-саркомы Уокера, сарком М-1 и 45. Авторы данной работы (Гедеванишвили, Гогитидзе, 1986) полагают, что эти эффекты обусловлены изменением связы-вающих свойств или числа рецепторов в изученных органах под влиянием про-дуцируемых опухолями трансформирующих факторов роста. В этой же лабо-ратории установлен ещё один факт: нечувствительность к изопротеренолу секреторных клеток околоушной слюнной железы мышей, которым перевиты опухоли асцитного рака Эрлиха, асцитной и солидной форм саркомы 37 и 180. Последние, действуя системно на организм, выключали реакцию клеток на β-адренергическую стимуляцию. Воспалительный процесс в острой или хрони-ческой фазах, искусственно вызванный под кожей спины животных, не оказы-вал такого дистанционного действия на клетки их слюнной железы. Предпола-гается, что снижение чувствительности указанных клеток к изопротеренолу обусловлено изменением структуры или функции β-адренорецепторов (Гедева-нишвили и др., 1985).
В упомянутых двух работах не обсуждаются причинные связи и возможный механизм влияния опухоли на рецепторы клеток отдалённых органов и тканей. Здесь, естественно, могут быть разные точки зрения. На наш взгляд, при ПОЛ в плазматической мембране ответ логично было бы искать в инактивации липи-дозависимых ферментов, в частности аденилатциклазы. Последняя в норме может активироваться соответствующими агонистами, в том числе серотони-ном, через β-адренергические рецепторы и, наоборот, ингибироваться другими соединениями через α2-адренергические рецепторы. Очевидно, принудительная инактивация аденилатциклазы, сопряжённой с указанными рецепторами, равно-сильна утрате чувствительности этих рецепторов к гормонам и биогенным ами-нам, выключению данных каналов из процесса управления клеточной реакцией. К общему снижению чувствительности должно приводить и уменьшение числа рецепторов по разным причинам, например, из-за частичной дестабилизации микрофиламентов, которыми они были «заякорены» изнутри клетки.
6.4.2. Биохимикам давно известно, что при регенерации печени после час-тичной гепатэктомии или после малигнизации печени, а также в печени живот-ных с перевитыми им опухолями резко повышается активность тимидин-киназы – одного из ключевых ферментов синтеза ДНК. Интересные данные приводит, в частности, Шапот (1979). Оказалось, что в ядерном соке печени онкологических больных с различной локализацией неоплазмы активность тимидинкиназы возрастает во много раз по сравнению с нормой (контролем служила печень внезапно погибших здоровых людей). Правда, она не достигала ещё более высокой активности этого фермента в малигнизированной печени у больных гепатоцеллюлярным раком. До некоторого времени причины этой активации и стимуляции синтеза ДНК в указанных случаях были не понятны. Однако в связи с данными о cAMP-зависимом ингибировании тимидинкиназы (Кульчицкий, 1987) здесь просматривается определённое «решение», исходя-щее из факта расстройства биоэнергетики в клетках отдалённых тканей опу-холевого организма. Дефицит ATP и снижение уровня cAMP, в том числе вследствие инактивации липидозависимой аденилатциклазы при ПОЛ в плазма-тической мембране, должны способствовать значительной активации тимидин-киназы и, следовательно, биосинтеза ДНК.
На мышах с трансплантированной саркомой MCG101 обнаружено дистан-ционное влияние её на синтез ДНК в клетках печени. В последних уровень этого синтеза повышен, что связывают с увеличением на 30-80 % активностей РНК-полимераз I и II, ассоциированных с хроматином (Ternell et al., 1985). Явная зависимость этих изменений от нарушений энергетического обмена здесь не просматривается. Следует, однако, учесть, что глобализация процесса ПОЛ, распространение его на различные мембранные структуры и органеллы клетки не минуют ядро и внутриядерные компоненты. В этом аспекте интересны све-дения о липидной зависимости РНК-полимераз, об изменении их активности при модификации фосфолипидного состава ядер (Бабенко, 1984). Трудность здесь состоит в том, что обычно липидозависимые ферменты инактивируются при ПОЛ, а в случае РНК-полимераз, согласно изложенному, наблюдается обратное явление. Каким образом в такой системе регуляции знак эффекта изменяется на противоположный, пока неизвестно.
В тканях, не вовлечённых в опухолевый процесс, происходит частичное перепрограммирование работы генетического аппарата и как следствие – нару-шение ими специфических функций. Нескоординированные переключения на уровне транскрипции ведут к синтезу белков «не по назначению» или, напро-тив, к прекращению синтеза предусмотренных нормой белков. Наиболее извес-тны сдвиги в спектре изоферментов, например, гексокиназы и лактатдегид-рогеназы. Подобные факты получены, в частности, Шелеповым и соавт. (1988). По их данным, развивающаяся в организме опухоль (в особенности быстрорас-тущая) индуцирует изменения генной активности в отдалённых тканях живот-ного-опухоленосителя, причём эти изменения в случае некоторых органов разнонаправленные. Однако вопрос о механизме влияния неоплазмы на экс-прессию генов в отдалённых от неё тканях практически не исследован. Полагая, что процесс нормальной дифференцировки клеток регулируется каким-то эпи-генетическим механизмом, нарушение регуляции генетической программы сле-дует искать прежде всего в системе этой регуляции.
Важными, в частности, представляются данные об участии фосфолипидов в образовании ДНК-мембранного комплекса, способности их оказывать регуля-торное действие на функциональную активность хроматина за счёт изменения конформации ДНК, гистонов и негистоновых белков, а также о гидрофобных взаимодействиях между ДНК и белками хроматина (Алесенко и др., 1982). В последующем факты такого рода были обобщены в ряде обзорных работ пос-ледних лет. В них подтверждено участие фосфолипидов в экспрессии генов на уровне регуляции активности ферментов матричного синтеза (см. Кувичкин, 2000). Показано, что ДНК-связанные липиды участвуют в петлевой укладке ДНК, в её контактах с ядерным матриксом. Наряду с негистоновыми белками эти липиды причастны к регуляции процессов репликации, репарации и транс-крипции ДНК, легко же окисляемый кардиолипин, в частности, – к ингиби-рованию ДНК-полимераз и репликации ДНК. В ядре обнаружены почти все виды фосфолипаз, а липидозависимая PKC фосфорилирует ДНК- и РНК-поли-меразы, ДНК-топоизомеразы, ДНК-метилазы и другие регуляторные белки (см. Стручков, Стражевская, 2000). Очевидно, при избыточном ПОЛ в ядерных структурах регуляторное действие липидов будет извращено, но ввиду недос-таточной «мощности» дестабилизирующего процесса пероксидации в незатро-нутых опухолью тканях опасной модификации самого генома с участием АФК и продуктов ПОЛ, по-видимому, не происходит.
Рассмотренные в данной главе эффекты воздействия неоплазм на организм опухоленосителя представлены в обобщённом виде на рис. 27. Почти все они так или иначе интерпретируются как результат интоксикации нормальных тканей продуктами, вырабатываемыми опухолями в процессе их развития по достаточно обоснованному нами (см. главы 2-5) кислородно-перекисному механизму.
Дистанционное системное действие
злокачественного новообразования на
организм путем генерации активных
оксидантов и косвенных прооксидантов,
с одной стороны, и исполнения неоплазмой
роли «ловушки» антиоксидантов, глюкозы,
липидов и азотистых соединений – с
другой, т.е. за счет достаточно заметного
возрастания в нормальных клетках
опухоленосителя прежде всего дисбаланса
(ПО-АО)
Сдвиги в структуре и функции форменных
элементов крови и лимфы, расстойство
гомеостатических систем организма и
ареактивность микро-циркуляторного
русла, ведущие к эхи-ноцитозу, тромбозу,
геморрагии, иммуно-депрессии,
вазоконс-трикции и к другим характерным
для опухолего организма «системным»
дефектам
мембраны микро-сом (снижение ак-тивности
моноок-сигеназной ферме-нтной системы,
по-вышение чувстви-тельности организ-ма
к различным ксенобиотикам; изменение
соотно-шения в синтезе белков различного
назначения)
Дестабилизация в них:
мембраны и дру-гих структур ядра
(частичное пере-программирование работы
генома, из-менение специфи-ческих
функций некоторых тканей)
Постепенные деспециализация и уменьшение
управляемости клеток тканей, не
пораженных непосредственно опухолью,
установление в них сходного с «раковым»
метаболизма



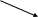




плазматической мембраны (снижение
чувстви-тельности рецеп-торов к
соответству-ющим лигандам; нарушение
нормаль-ной работы сигналь-ных систем
по прои-зводству и передаче вторичных
мессенд-жеров и сигнальных молекул)
мембран митохондрий (ослабление
тканевого дыхания, повышение
внутриклеточных рО2 и ПОЛ;
деградация части митохондрий как
реак-ция на гипоксию при вазоконстрикции
пери-ферических сосудов)
Рис.27. Наиболее известные виды
расстраивающихся в
организме
опухоленосителя обменов и регуляций,
их
связь с кислородно-перекисной
концепцией онкогенеза
* * *
Различные и, на первый взгляд, разрозненные факты изменения клеток крови и нарушения гомеостаза в организме-опухоленосителе получают объяс-нение в рамках кислородно-перекисной концепции онкогенеза и такого важного её следствия, как мембранотоксическое действие окисляющих агентов, секрети-руемых клетками активно растущих участков неоплазмы. С этой позиции понятны непосредственное эхиноцитогенное влияние последних, повышенная наклонность к тромбозу и геморрагическим осложнениям, столь характерные для опухолевого организма. Правда, на изменение свойств эритроцитов и тром-боцитов опухоль может оказывать влияние и косвенно, например, за счёт уве-личения количества моноцитов в периферической крови, наблюдающееся, по-видимому, как следствие защитной реакции организма при развитии опухоли. Указанные моноциты секретируют цитотоксические метаболиты кислорода, что определяется по значительному увеличению стимулированной люцигенином хемилюминесценции крови больных раком (Trulson et al., 1989).
Те же агенты ответственны за дефектность и (или) снижение активности эффекторных механизмов специфического и неспецифического противоопухо-левого иммунитета. Например, образование О опухолеассоциированными ма-крофагами может нарушаться вследствие недостаточной активации NADPH-оксидазы фосфолипидозависимой PKC в плазматической мембране. Дополни-тельно подавление оксидативной составляющей цитотоксического действия эффекторов достигается стимуляцией в них относительно слабого митохонд-риального дыхания и соответственно снижением уровня рО2 простагландинами группы Е, которые продуцируются клетками активно растущих участков опу-холи, в частности периферийных. Результатом депрессии иммунологического ответа являются успешное противодействие опухолевых клеток разрушению и повышенная чувствительность организма-опухоленосителя к инфекционным воздействиям. Такому печальному исходу, мы считаем, способствует и сама иммунная система, которая в противоборстве с гетерогенной популяцией транс-формированных (опухолевых) клеток действует как фактор отбора наиболее злокачественных вариантов опухолевой клетки и как фактор прогрессии опухо-лей. Именно такие «отобранные» клетки более всего и способны не только активно противостоять, но и, по-видимому, самостоятельно наносить ответные цитотоксические воздействия, ведущие к иммунодепрессии.
Возможности для селективного отбора опухолевых клеток in vivo и резис-тентность их вариантов возрастают при секреции этими клетками PGE (Deich-man, 1988), ослабляющих, как неоднократно отмечалось выше, противоопу-холевую реакцию со стороны NK-клеток, макрофагов и нейтрофилов. Кроме того, возможны случаи, когда предопухолевые и только ещё обозначающиеся опухолевые клетки под влиянием главным образом оксидантов из эффекторных клеток повышают свой кислородно-перекисный «тонус» до уровня агрессивных истинно опухолевых клеток. Такие иммуностимулированные клетки в порядке отрицательной обратной связи теперь уже сами могут противодействовать эффекторным по рассмотренным выше механизмам. Вообще же, плейотропное оксидативное действие, например, макрофагов определяется состоянием не только их собственных функциональных систем, но и тех в атакуемых клетках, от которых зависит в них уровень гипероксии и пероксидации – один из самых существенных обобщённых показателей, детерминирующих чувствительность клеток к различным возмущающим воздействиям (оксидативному, лучевому, тепловому и др.).
При анализе взаимоотношения опухолевых и иммунных клеток основное внимание нами уделено выработке противоборствующими сторонами мощных биологических оксидантов. В действительности же эти две клеточные системы, особенно иммунная, продуцируют и другие агенты цитотоксического, деструк-тивного назначения, а также для реализации ряда иных специальных функций в организме. Фактически указанные взаимоотношения намного сложнее и свиде-тельствуют о более общем предназначении иммунной системы. В этой связи небезосновательно, например, следующее утверждение Феля (1987): «Нет спе-циализированной противоопухолевой реакции, а есть гомеостатические по своей сути реакции, предназначение которых – поддержание генетически детер-минированного постоянства клеточного состава тканей и соответствующей схемы биосинтетических процессов. Противоопухолевые иммунные реакции – не более как частный случай этой генерализованной функции иммунной сис-темы, справедливо обозначаемой в качестве иммунного надзора».
В аспекте взаимоотношения организма и опухоли весьма актуально пони-мание механизма метастазирования. Мы полагаем, что этот механизм в немалой степени предопределяется особенностями канцерогенеза, отражёнными в его кислородно-перекисной модели. В частности, способность гипероксических бесконтрольно пролиферирующих клеток периферийных участков опухоли продуцировать АФК, продукты ПОЛ, PGEs и другие соединения обеспечивает части этих клеток резистентность к цитотоксическому действию NK-клеток, макрофагов и нейтрофилов. Причём известна следующая корреляция: чем выше указанная резистентность опухолевых клеток, тем больше их метастатическая активность (Yamamura et al., 1984). Такие клетки, эмигрировав в орган – ми-шень метастазирования, сохраняют статус резистентности к атакующим их там эффекторам, что является одной из предпосылок для формирования метаста-тических очагов. Более того, осевшие в другом органе раковые клетки, продол-жая генерировать реактивные радикалы О2, могут повреждать в ближайшем своём окружении клетки нормальных тканей. Например, с помощью ИК-спек-троскопии установлено, что метастазирующая в лёгкие мышей карцинома Льюис интенсифицирует ПОЛ и перераспределяет фосфолипидный состав кро-веносных сосудов лёгких. Показан антиметастатический эффект фармакологи-ческой коррекции липидного обмена в этих сосудах эндогенными антиокси-дантами при метастазировании опухоли (Смирнов и др., 1989). Возможная роль в метастазировании неоплазм других «пероксидативных» сдвигов в организме была обсуждена нами в п. 2.4.
Материалы глав 2 и 6 могут вызвать у читателя следующие вопросы: почему столь сходные расстройства метаболических и регуляторных процессов в опухолях и в отдалённых от неё нормальных тканях не нашли равного приз-нания?; почему все рассмотренные выше устойчивые изменения в этих тканях приняты соответствующими специалистами сразу, а идентичные им первичные эффекты в самих опухолевых клетках всё ещё подвергаются сомнению или даже вовсе отвергаются? Прежде всего эти вопросы затрагивают нарушение митохондриального дыхания, так или иначе вызываемого различными канце-рогенными факторами, и его далеко идущие последствия.
Возникновению такой ситуации способствуют, в частности, некоторые ставшие догмой взгляды и ряд других причин. Одна из них состоит, по нашему мнению, в ошибочности научных выводов, формулируемых иногда на основе усреднённой информации. Неоплазма – образование весьма гетерогенное с неполноценной сосудистой системой внутри неё, благоприятными условиями для роста в периферийных зонах, особенно в связи с ангиогенным эффектом опухолей, и множеством других промежуточных состояний. Усреднение физи-ко-химических показателей состояния биоэнергетики, данных о концентрации АФК, продуктов ПОЛ, различных ферментов и других молекулярных компо-нентов для определённой популяции клеток, «выхваченной» из злокачествен-ной опухоли, неизбежно приводит к искажению информации о конкретных категориях клеток, из которых составлена исследованная популяция. В этом отношении не представляют исключения и интересующие нас бесконтрольно размножающиеся гипероксические клетки в активно растущих периферийных зонах неоплазмы ввиду их относительной малочисленности и трудностей селек-тивного выделения. Усреднённые сведения в целом для популяции из гетеро-генных клеток опухоли, скорее всего, не будут отражать реальные характерис-тики указанных автономно растущих клеток. Информация о них затеряется среди другой, касающейся остальной массы клеток новообразования. Отсюда понятна противоречивость мнений в отношении ряда черт «ракового» обмена, в том числе о состоянии окислительного фосфорилирования и антиоксидантной системы, содержании митохондрий, ATP, cAMP, свободных радикалов и пере-кисей липидов в опухолевой клетке.
В тканях, непосредственно не затронутых неоплазмой, опухолевой инток-сикации более или менее равномерно подвергается, по-видимому, абсолютное большинство клеток. Этому способствуют высокая степень васкуляризации и целостность сосудистой системы, отсутствие резкого контраста в кровоснабже-нии разных участков нормальной ткани. Характеристики её клеток, очевидно, не будут существенно разбросанными, Это относится и к таким внутриклеточ-ным изменениям, как сниженные уровни дыхания, ATP и cAMP, уменьшенное число митохондрий, повышенные уровни ПОЛ мембран и его продуктов, а также связанные с ними многие эффекты в цитоплазме и ядре (изменение акти-вности ферментов, перепрограммирование ядерного генома, диспропорции в синтезе белков и др.). Усреднение указанных показателей для однородной популяции клеток не может заметно исказить их характерные изменения, что сразу же и однозначно фиксируется исследователями в эксперименте. Правда, определённый вклад в разброс характеристик может вносить феномен мозаич-ности при росте опухолей, т. е. неравномерное распределение активности ферментов цикла Кребса, гликолиза, пентозофосфатного пути, обмена амино-кислот, дыхательной цепи в различных клетках конкретной нормальной ткани (Морозкина, 1989).
Закономерен также давний вопрос (Шапот, 1979): почему отдалённые ткани не приобретают свойство неуправляемого роста, если неоплазма вызывает в них подобные в ней самой изменения биохимических и иных характеристик? Пока этот принципиальный вопрос не имеет ответа. В порядке обсуждения можно всё же отметить, что степень всех вторичных изменений в нормальных тканях опухолевого организма (по отношению к первичным в самой неоплазме) недос-таточна для относительно быстрого злокачественного перерождения. Однако сама возникшая в них ситуация может рассматриваться как про- и пренеоплас-тическая: при дополнительных канцерогенных воздействиях наиболее «подго-товленные» из них, вероятно, могли бы сравнительно легко малигнизиро-ваться; то же самое, возможно, произойдёт без всяких внешних воздействий на те ткани, но при более длительных сроках наблюдения (эти сроки могут не «согласовываться» с продолжительностью жизни животного-опухоленосителя, и тогда факт ожидаемой малигнизации так и не будет зафиксирован до их гибели). Сведений по данному вопросу практически нет в литературе, так как специалистам он, по-видимому, не представляется проблемным на фоне основ-ного заболевания и вызываемых им многих более ранних осложений.
Некоторым исключением в вопросе относительной «безопасности» отда-лённых от новообразования органов является тимус, который при развитии многих опухолей человека и животных подвергается прогрессиующей инволю-ции. Это явление ещё раз подтверждено на примере мышей с перевитыми им подкожно клетками сингенной гепатомы 22а (Киселева и др., 1998). В данной работе показаны: снижение синтеза ДНК в тимоцитах; увеличение числа пикно-тических ядер в коре тимуса в 2-3 раза по сравнению с контролем; наличие или отсутствие апоптоза тимоцитов в зависимости от того, находились ли они предварительно, до анализа их ДНК, в среде инкубации или нет. Авторы дан-ного исследования причиной инволюции тимуса при опухолевом росте счита-ют действие на тимоциты цитокинов, выделяемых нелимфоидными клетками самого тимуса.
Логично, однако, было бы полагать, что рассматриваемый феномен может определяться совсем иными событиями, связанными с фактом начала инволю-ции и атрофии тимуса у человека и животных уже на ранних стадиях их нор-мального роста и развития. При обсуждении возможных принципов старения органов иммунной системы (см. п. 1.5.3) мы предположили, что внутритимус-ные тимоциты могут погибать вследствие ускоренной реализации в них кис-лородно-перекисного механизма старения, начинающегося с деградации мито-хондрий. Находясь в состоянии ощутимого окислительного стресса уже в нормальном, «доопухолевом» организме, эти тимоциты после возникновения и развития в нём неоплазии испытывают со стороны последней дополнительное дистантное воздействие (см. выше), усугубляющее в клетках тимуса состояние окислительного разрушения. Таким образом, если для других органов и тканей организма-опухоленосителя влияние неоплазмы имеет проканцерогенезную направленность, то для тимуса оно должно оказаться фактором, ускоряющим и усиливающим инволюцию. После же удаления опухолей это негативное их влияние, скорее всего, исчезнет.
Мы обсудили эффекты в основном дистанционного взаимодействия опухо-ли с отдалёнными от неё нормальными тканями. Однако в связи с известной концепцией так называемого «опухолевого поля» представляется возможным выразить своё понимание своеобразного состояния также и ткани, непосред-ственно окружающей зону опухолевого роста. Термином «опухолевое поле» Ивашкин с соавт. (1987) обозначают «тканевый регион, пространственно окру-жающий злокачественную опухоль, не имеющий цитологических (морфологи-ческих) признаков злокачественной перестройки, но обладающий определён-ными биохимическими признаками, присущими и самой опухоли». Изменения такой направленности в этом регионе происходили и происходят, очевидно, значительно быстрее и интенсивнее, чем в удалённых от новообразования частях организма. Этому способствует комплекс неслучайных обстоятельств и, прежде всего, опухолевый ангиогенез как необходимое условие для поддержа-ния в периферийных клетках опухоли гипероксического и пероксидантного состояний, её развития вдоль заранее подготовленных сосудистых путей и внутриорганного метастазирования отдельных опухолевых клеток.
Кроме того, соседствующие с опухолью ткани первыми обедняются анти-оксидантами, транспортируемыми из нормальных тканей в неоплазму, и пер-выми же воспринимают ещё не ослабленное расстоянием воздействие секрети-руемых ею продуктов, в том числе способствующих трансформации клеток. Среди таких продуктов особого внимания заслуживают различные факторы роста (эпидермальный и др.). Они способны вызывать отдельные признаки опу-холевого фенотипа, исчезающие в случае прекращения продукции этих мито-генов (Дубинина, 1989). Но если опухоль секретирует фактор роста непрерыв-но и продолжительное время, то в нормальных клетках с соответствующими этому фактору рецепторами могут устойчиво индуцироваться определённый пролиферативный фон и связанные с ним изменения. Наряду с АФК и другими агентами из неоплазмы они, очевидно, вносят свой вклад в становление опу-холевого поля. Кстати, часть эпителиальных клеток опухоли и клетки погра-ничного с нею эпителия, возможно, трансформированы лишь фенотипически (см. Дубинина, 1989).
Таким образом, инвазия клеток опухоли в соседствующие ткани в принципе не исключается, но не менее обоснованной мы считаем следующую позицию: опухолевое поле отражает прежде всего природу самих клеток, формирующих это поле и ставших таковыми под воздействием продуктов новообразования. Более того, опухолевое поле как своеобразное предопухолевое состояние с несомненными биохимическими признаками неопластического процесса пред-лагается именовать онкогенным, вызывающим опухоли (Ивашкин и др., 1987). Данное представление совпадает с нашим в отношении подобных перестроек в отдалённых тканях опухолевого организма. Различие состоит в основном лишь в интенсивности и скорости указанных изменений, которые, естественно, мак-симальны в тканевом регионе, пространственно окружающим неоплазму.
Представленные в данной главе факты и суждения существенно дополняют и усиливают нашу аргументацию в пользу кислородно-перекисной модели кан-церогенеза, объясняют с её позиций важные моменты механизма взаимодей-ствия опухоли и организма. Они же, можно надеяться, позволят восполнить в какой-то мере пробел в поиске для лечения неоплазм новых подходов, выте-кающих из понимания указанного механизма.
