
- •1. Предметы и методы химической термодинамики. Термодинамические системы, параметры, функции.
- •2. Первое начало термодинамики. Внутренняя энергия. Энтальпия. Закон Гесса и термохимические расчеты.
- •3. Второе начало термодинамики. Энтропия. Энергия Гиббса.
- •4. Химический потенциал. Термодинамические условия равновесия, прогнозирование направления самопроизвольных процессов. Энтальпийный и энтропийный факторы.
- •Внутренняя энергия
- •Энтальпия
- •Энергия Гельмгольца
- •Энергия Гиббса
- •5. Обратимые и необратимые по направлению реакции. Понятие о химическом равновесии. Константа химического равновесия и способы ее выражения. Принцип Ле-Шателье.
- •6. Роль растворов в жизнедеятельности организмов. Термодинамика растворения: энтропийный и энтальпийный факторы растворения, их связь с механизмом растворения.
- •7. Растворимость газов в жидкостях. Законы Дальтона, Генри, Сеченова. Растворимость газов в крови.
- •Роль диффузии в процессах переноса веществ в биологических системах
- •8. Слабые электролиты. Константа и степень диссоциации. Закон разведения Оствальда.
- •9. Основные положения теории сильных электролитов. Активность и коэффициент активности. Ионная сила раствора. Электролиты в организме человека.
- •10. Коллигативные свойства растворов. Закон Рауля. Осмос и осмотическое давление. Закон Вант-Гоффа.
- •Температура кипения разбавленных растворов
- •Криоскопическая и эбулиоскопическая константы
- •Осмос. Осмотическое давление разбавленных растворов
- •11. Коллигативные свойства растворов электролитов. Изотонический коэффициент, его физический смысл. Гипо-, гипер- и изотонические растворы. Роль осмоса в биосистемах. Плазмолиз и гемолиз.
- •12. Ионное произведение воды. Водородный показатель рН.
- •13. Буферные системы, их классификация и механизм действия. Уравнение Гендерсона-Гассельбаха. Буферная емкость.
- •I и II типы буферных систем
- •14. Буферные системы крови и сравнительная величина их буферной емкости. Понятие о кислотно-щелочном равновесии.
- •Кислотно-щелочное состояние.
- •15. Комплексные соединения, их изомерия, классификация и номенклатура.
- •1)По заряду комплекса: катионные, анионные и нейтральные комплексы.
- •2)По количеству комплексообразователей
- •3)По типу лиганда
- •4)По химическим свойствам: кислоты, основания, соли, неэлектролиты:
- •5)По количеству мест, занимаемых лигандом в координационной сфере
- •17. Предмет и методы химической кинетики. Скорость и константа скорости химической реакции. Закон действующих масс. Зависимость скорости реакции от температуры.
- •18. Простые и сложные реакции. Виды сложных реакций. Цепные фотохимические реакции. Роль фотохимических реакций в биологии и медицине.
- •19. Молекулярность и порядок химической реакции. Кинетические уравнения для реакции 0- и 1-го порядка. Энергия активации. Уравнение Аррениуса и энергетическая диаграмма реакции.
- •20. Основные положение теории активных соударений и теории переходного комплекса.
- •21. Гомогенный и гетерогенный катализ. Кислотно-основный катализ и роль в процессах метаболизма. Стадии гетерогенного катализа.
- •22. Ферментативный катализ.
- •23. Электродные потенциалы и механизм их возникновения. Строение двойного электрического слоя.
- •24. Уравнение Нернста для электродного потенциала и гальванического элемента.
- •25. Гальванический элемент Даниэля-Якоби. Принцип действия, эдс.
- •26. Классификация электродов. Электроды сравнения и определения. Водородный, хлорсеребряный и ионоселективные (стеклянные) электроды. Принцип их действия и электродные реакции.
- •27. Окислительно-восстановительный потенциал. Уравнение Нернста-Петерса.
- •28. Диффузный и мембранный потенциалы. Механизм действия и их роль в генерации биопотенциалов в организме.
- •29. Потенциометрия. Сущность метода и области применения в химических и медико-биологических исследованиях.
- •30. Вольтамперометрия (полярография), сущность метода и области применения в медико-биологических исследованиях.
- •31. Электропроводность растворов. Скорость движения ионов. Закон Кольрауша. Удельная и эквивалентная электропроводность.
- •32. Кондуктометрия, основные положения и область применения. Электропроводность тканей, применение в физиотерапии.
- •Органическая химия
- •33. Теория строения органических соединений а.М. Бутлерова.
- •34. Электронное строение атома углерода и виды гибридизации.
- •35. Классификация и номенклатура органических соединений.
9. Основные положения теории сильных электролитов. Активность и коэффициент активности. Ионная сила раствора. Электролиты в организме человека.
Сильные электролиты — химические соединения, молекулы которых в разбавленных растворах практически полностью диссоциированы на ионы. Степень диссоциации таких электролитов близка к 1. К сильным электролитам относятся многие неорганические соли, некоторые неорганические кислоты и основания в водных растворах, а также в растворителях, обладающих высокой диссоциирующей способностью (спирты, амиды и др.).

 Коэффициент
активности – коэффициент, связывающий
реальную концертрацию электролита с
его термодинамической активностью в
уравнении a = γc (a – активность; с –
концентрация; γ – коэффициент активности).
Коэффициент
активности – коэффициент, связывающий
реальную концертрацию электролита с
его термодинамической активностью в
уравнении a = γc (a – активность; с –
концентрация; γ – коэффициент активности).

10. Коллигативные свойства растворов. Закон Рауля. Осмос и осмотическое давление. Закон Вант-Гоффа.
Свойства растворов, которые зависят только от концентрации компонентов, но не зависят от их природы, называются коллигативными.
К коллигативным свойствам растворов относят:
1) понижение давления насыщенного пара растворителя над раствором;
2) повышение температуры кипения и понижение температуры замерзания (кристаллизации) растворов по сравнению с чистым растворителем;
3) осмотическое давление раствора.
Изучение коллигативных свойств разбавленных растворов служит одним из наиболее распространенных способов, определения молярной массы растворенного вещества, а также его степени диссоциации или показателя ассоциации.
Пар, находящийся в динамическом равновесии со своей жидкостью, называется насыщенным.
Давление пара над раствором нелетучего вещества в каком-либо растворителе всегда ниже, чем над чистым растворителем при одной и той же температуре. Согласно I закону Рауля, относительное понижение давления насыщенного пара растворителя над раствором нелетучего вещества равно мольной доле растворенного вещества:
![]()
где PA – давление насыщенного пара растворителя над раствором (атм; Па;
мм. рт. ст.);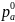 – давление
насыщенного пара над чистым растворителем
– давление
насыщенного пара над чистым растворителем
(атм; Па; мм. рт. ст.); ‒ абсолютное понижение давления пара над
раствором (атм; Па; мм. рт. ст.); ‒ относительное понижение давления пара над раствором; B n – количество растворенного вещества (моль);
A n – количество растворителя (моль); B N ‒ мольная доля растворенного
вещества.
Когда оба компонента идеального раствора летучие, то закон Рауля справедлив для каждого из них. Кроме того, для парциальных давлений компонентов пара и концентраций компонентов в жидкости справедливы следующие соотношения:
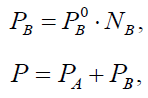 где
P –
общее давление над раствором.
где
P –
общее давление над раствором.
Закон Рауля точно соблюдается только для идеальных растворов и приближенно для разбавленных реальных растворов: чем разбавленнее раствор, тем более он приближается к идеальному.
Любая жидкость
при температуре ниже критической может
находиться в трех разных агрегатных
состояниях: твердом, жидком и парообразном.
Между этими состояниями наблюдаются
сложные фазовые равновесия, которые
включают взаимные фазовые
переходы.
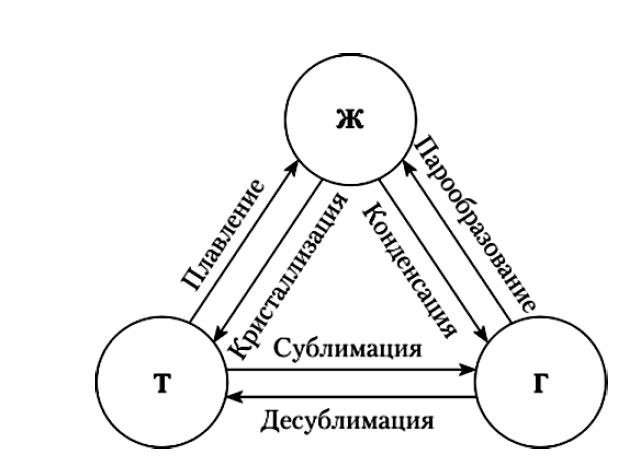
Положение этих фазовых равновесий зависит от температуры и внешнего давления. Переходы жидкости в другие фазовые состояния – парообразное и твердое – характеризуется соответственно температурами кипения и замерзания.
Тот факт, что давление паров над раствором отличается от давления паров над чистым растворителем, существенно влияет на процессы кристаллизации и кипения. Из первого закона Рауля выводятся два следствия, касающиеся понижения температуры замерзания и повышения температуры кипения растворов, которые в объединённом виде известны как второй закон Рауля.
Температура замерзания (кристаллизации) разбавленных растворов
Условием кристаллизации является равенство давления насыщенного пара растворителя над раствором давлению пара над твёрдым растворителем.
Поскольку давление пара растворителя над раствором всегда ниже, чем над чистым растворителем, это равенство всегда будет достигаться при температуре более низкой, чем температура замерзания растворителя.
Разность между температурой кристаллизации растворителя T°зам и температурой начала кристаллизации раствора Tзам есть понижение температуры кристаллизации.
Понижение температуры кристаллизации бесконечно разбавленных растворов не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора.
![]()
Поскольку по мере кристаллизации растворителя из раствора концентрация последнего возрастает, растворы не имеют определённой температуры замерзания и кристаллизуются в некотором интервале температур.
