
- •1. Предметы и методы химической термодинамики. Термодинамические системы, параметры, функции.
- •2. Первое начало термодинамики. Внутренняя энергия. Энтальпия. Закон Гесса и термохимические расчеты.
- •3. Второе начало термодинамики. Энтропия. Энергия Гиббса.
- •4. Химический потенциал. Термодинамические условия равновесия, прогнозирование направления самопроизвольных процессов. Энтальпийный и энтропийный факторы.
- •Внутренняя энергия
- •Энтальпия
- •Энергия Гельмгольца
- •Энергия Гиббса
- •5. Обратимые и необратимые по направлению реакции. Понятие о химическом равновесии. Константа химического равновесия и способы ее выражения. Принцип Ле-Шателье.
- •6. Роль растворов в жизнедеятельности организмов. Термодинамика растворения: энтропийный и энтальпийный факторы растворения, их связь с механизмом растворения.
- •7. Растворимость газов в жидкостях. Законы Дальтона, Генри, Сеченова. Растворимость газов в крови.
- •Роль диффузии в процессах переноса веществ в биологических системах
- •8. Слабые электролиты. Константа и степень диссоциации. Закон разведения Оствальда.
- •9. Основные положения теории сильных электролитов. Активность и коэффициент активности. Ионная сила раствора. Электролиты в организме человека.
- •10. Коллигативные свойства растворов. Закон Рауля. Осмос и осмотическое давление. Закон Вант-Гоффа.
- •Температура кипения разбавленных растворов
- •Криоскопическая и эбулиоскопическая константы
- •Осмос. Осмотическое давление разбавленных растворов
- •11. Коллигативные свойства растворов электролитов. Изотонический коэффициент, его физический смысл. Гипо-, гипер- и изотонические растворы. Роль осмоса в биосистемах. Плазмолиз и гемолиз.
- •12. Ионное произведение воды. Водородный показатель рН.
- •13. Буферные системы, их классификация и механизм действия. Уравнение Гендерсона-Гассельбаха. Буферная емкость.
- •I и II типы буферных систем
- •14. Буферные системы крови и сравнительная величина их буферной емкости. Понятие о кислотно-щелочном равновесии.
- •Кислотно-щелочное состояние.
- •15. Комплексные соединения, их изомерия, классификация и номенклатура.
- •1)По заряду комплекса: катионные, анионные и нейтральные комплексы.
- •2)По количеству комплексообразователей
- •3)По типу лиганда
- •4)По химическим свойствам: кислоты, основания, соли, неэлектролиты:
- •5)По количеству мест, занимаемых лигандом в координационной сфере
- •17. Предмет и методы химической кинетики. Скорость и константа скорости химической реакции. Закон действующих масс. Зависимость скорости реакции от температуры.
- •18. Простые и сложные реакции. Виды сложных реакций. Цепные фотохимические реакции. Роль фотохимических реакций в биологии и медицине.
- •19. Молекулярность и порядок химической реакции. Кинетические уравнения для реакции 0- и 1-го порядка. Энергия активации. Уравнение Аррениуса и энергетическая диаграмма реакции.
- •20. Основные положение теории активных соударений и теории переходного комплекса.
- •21. Гомогенный и гетерогенный катализ. Кислотно-основный катализ и роль в процессах метаболизма. Стадии гетерогенного катализа.
- •22. Ферментативный катализ.
- •23. Электродные потенциалы и механизм их возникновения. Строение двойного электрического слоя.
- •24. Уравнение Нернста для электродного потенциала и гальванического элемента.
- •25. Гальванический элемент Даниэля-Якоби. Принцип действия, эдс.
- •26. Классификация электродов. Электроды сравнения и определения. Водородный, хлорсеребряный и ионоселективные (стеклянные) электроды. Принцип их действия и электродные реакции.
- •27. Окислительно-восстановительный потенциал. Уравнение Нернста-Петерса.
- •28. Диффузный и мембранный потенциалы. Механизм действия и их роль в генерации биопотенциалов в организме.
- •29. Потенциометрия. Сущность метода и области применения в химических и медико-биологических исследованиях.
- •30. Вольтамперометрия (полярография), сущность метода и области применения в медико-биологических исследованиях.
- •31. Электропроводность растворов. Скорость движения ионов. Закон Кольрауша. Удельная и эквивалентная электропроводность.
- •32. Кондуктометрия, основные положения и область применения. Электропроводность тканей, применение в физиотерапии.
- •Органическая химия
- •33. Теория строения органических соединений а.М. Бутлерова.
- •34. Электронное строение атома углерода и виды гибридизации.
- •35. Классификация и номенклатура органических соединений.
22. Ферментативный катализ.
Ферментативный катализ – каталитические реакции, протекающие с участием ферментов – биологических катализаторов белковой природы.
Ферментативный катализ имеет характерные особенности:
1. Высокая активность.
2. Высокая специфичность.
3. Характерной особенностью действия ферментов является также высокая чувствительность активности ферментов к внешним условиям – рН среды и температуре.
По своей каталитической активности биологические катализаторы в тысячи раз превышают неорганические.
Согласно общепринятым
представлениям о механизме ферментативного
катализа, субстрат S
и фермент Е
находятся
в равновесии с очень быстро образующимся
фермент-субстратным комплексом ЕS,
который сравнительно медленно распадается
на продукт реакции P
с выделением
свободного фермента; таким образом,
стадия распада фермент-субстратного
комплекса на продукты реакции является
лимитирующей:
![]()
где E, S – фермент и субстрат; P – продукт реакции; ES – фермент-субстратный комплекс.
Такой химический механизм иногда называют механизмом «замок- ключ», так как он требует точного геометрического соответствия между молекулой субстрата и активным центром.
Скорость ферментативного процесса можно рассчитать по уравнению Михаэлиса-Ментен:
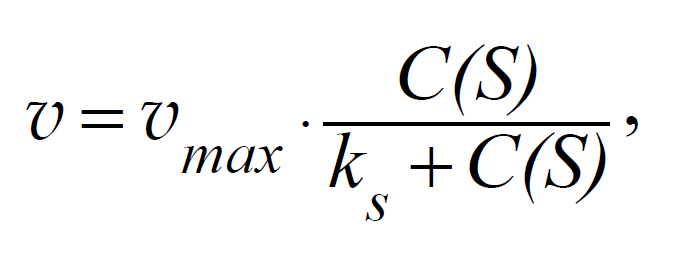
где С(S) – концентрация субстрата; v max – максимальная скорость реакции, то есть скорость, когда весь фермент находится в составе фермент-субстратного комплекса.
Здесь kS – константа Михаэлиса, по физическому смыслу численно равная концентрации субстрата, при которой стационарная скорость равна половине максимальной
![]()
Константа Михаэлиса служит мерой сродства между субстратом и ферментом: чем меньше kS, тем больше их способность к образованию фермент-субстратного комплекса.
Ферментативный катализ играет огромную роль в жизнедеятельности организма. Широкое применение получили ферментные препараты при нарушениях функции желудочно-кишечного тракта, связанных с недостаточной выработкой пищеварительных ферментов (пепсин, панкреатин). При ожогах, гнойных ранах, гнойно-воспалительных заболеваниях легких, когда необходимо разрушить накопившиеся в большом количестве белковые образования, применяются протолитические ферменты, приводящие к быстрому гидролизу белков и способствующие рассасыванию гнойных скоплений.
Для лечения инфекционных заболеваний используются препараты лизоцина, которые разрушают оболочку некоторых болезнетворных бактерий. Очень важные ферменты, которые рассасывают тромбы (сгустки крови внутри кровеносных сосудов) – плазмин, трипсин, химотрипсин, на их основе с разными добавками созданы различные лекарственные препараты – стрептокиназа, стрептаза и т.п., широко применяемые в медицине.
23. Электродные потенциалы и механизм их возникновения. Строение двойного электрического слоя.
Электрод – система, состоящая из контактирующих проводников первого рода и второго рода, на межфазной границе которых возникает двойной электрический слой.
Потенциалы, возникающие на металлах, погруженных в растворы собственных солей, называются электродными потенциалами.
Причиной возникновения электродного потенциала является переход некоторого количества металла в раствор в виде положительно заряженных ионов как результат взаимодействия металла с диполями воды:
![]()
Величина электродного
потенциала металлического электрода
зависит от температуры и активности
(концентрации) иона металла в растворе,
в который опущен электрод; математически
эта зависимсть выражается уравнением
Нернста (здесь
F –
постоянная Фарадея, Кл/моль,
n –
заряд иона,
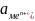 – активность
потенциалопределяющих ионов металла
в растворе, моль/л):
– активность
потенциалопределяющих ионов металла
в растворе, моль/л):
![]()
В уравнении Нернста φ0 – стандартный электродный потенциал, равный потенциалу электрода при активности иона металла, равной 1 моль/л. Стандартные электродные потенциалы электродов в водных растворах составляют ряд напряжений. Величина φ0 есть мера способности окисленной формы элемента или иона принимать электроны, то есть восстанавливаться. Иногда различием между концентрацией и активностью иона в растворе пренебрегают, и в уравнении Нернста под знаком логарифма находится концентрация ионов в растворе.
Для того чтобы, можно было сравнить электродные потенциалы, возникающие в различных электродах, необходимо выбрать точку отсчета. За такую точку приняли потенциал водородного электрода, величину которого считают равной 0. На основе этого, построен ряд стандартных электродных потенциалов металлов (ряд активности металлов).
В качестве условно-нулевого потенциала выбран потенциал стандартного водородного электрода: Н+ | (H2)Pt, в котором давление продуваемого водорода равно 1 атм, а активность ионов водорода в растворе равна 1.
Электродная
реакция:
![]()
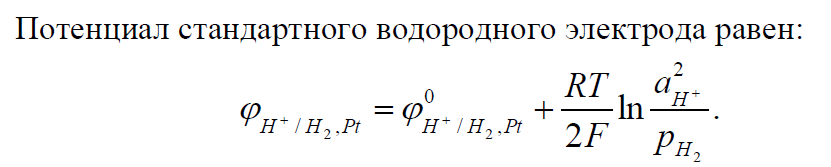
Строение ЭДС
Если две фазы имеют заряженные частицы, то при контакте этих двух фаз на границе раздела происходит переход или перераспределение заряженных частиц. В результате каждая из фаз приобретает заряд определенного знака или свой электрический потенциал φ, а на границе раздела фаз возникает двойной электрический слой – ДЭС, в котором есть две обкладки из противоположных зарядов. Появление ДЭС характеризуется наличием определенного скачка, или разности, электрических потенциалов в двух фазах.
Двойной электрический слой образуется в результате обмена ионами при погружении металлов и других материалов в воду или водные растворы.
Согласно современной теории структуру ДЭС составляют два слоя:
• Слой Гельмгольца или адсорбционный слой имеет толщину δ. Ионы, переход которых через границу раздела фаз обеспечивает образование двойного электрического слоя, называются потенциалопределяющими ионами.
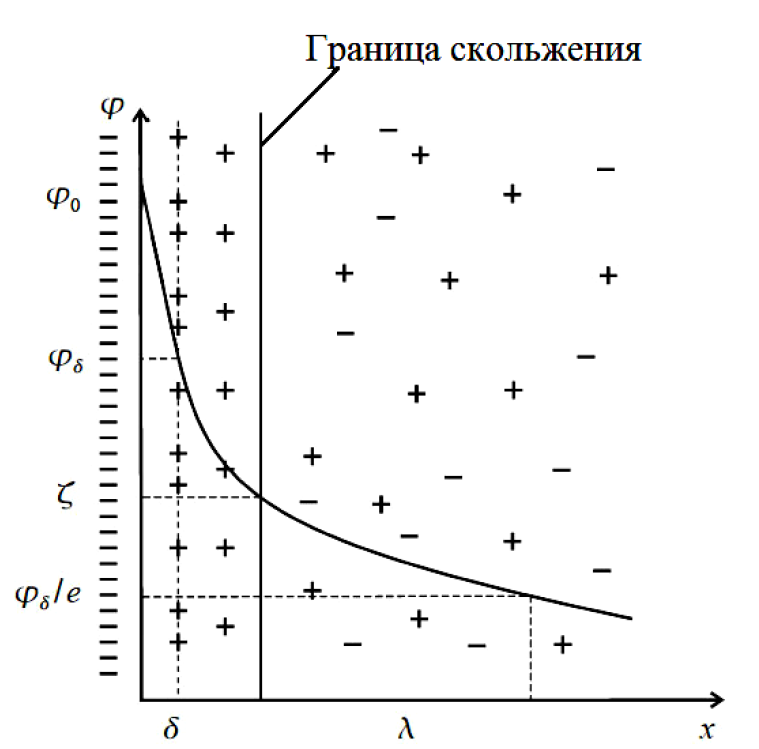
• Диффузный слой или слой Гуи содержит противоионы. Диффузный слой имеет толщину λ. Возникновение двойного электрического слоя приводит к тому, что поверхностные слои каждой из соприкасающихся фаз приобретают определенный заряд. Он характеризуется некоторым электрическим потенциалом φ.
Существует несколько характеристических потенциалов:
• Потенциал диффузного слоя φδ, соответствующий границе адсорбционного и диффузного слоёв.
• Потенциал φx=λ, меньший, чем φδ в e раз и характеризующий толщину диффузного слоя.
• Электрокинетический потенциал или дзета-потенциал ζ. Этот потенциал соответствует плоскости скольжения и является частью потенциала диффузного слоя. Дзета-потенциал является одной из важнейших характеристик двойного электрического слоя.
