
- •1. Предметы и методы химической термодинамики. Термодинамические системы, параметры, функции.
- •2. Первое начало термодинамики. Внутренняя энергия. Энтальпия. Закон Гесса и термохимические расчеты.
- •3. Второе начало термодинамики. Энтропия. Энергия Гиббса.
- •4. Химический потенциал. Термодинамические условия равновесия, прогнозирование направления самопроизвольных процессов. Энтальпийный и энтропийный факторы.
- •Внутренняя энергия
- •Энтальпия
- •Энергия Гельмгольца
- •Энергия Гиббса
- •5. Обратимые и необратимые по направлению реакции. Понятие о химическом равновесии. Константа химического равновесия и способы ее выражения. Принцип Ле-Шателье.
- •6. Роль растворов в жизнедеятельности организмов. Термодинамика растворения: энтропийный и энтальпийный факторы растворения, их связь с механизмом растворения.
- •7. Растворимость газов в жидкостях. Законы Дальтона, Генри, Сеченова. Растворимость газов в крови.
- •Роль диффузии в процессах переноса веществ в биологических системах
- •8. Слабые электролиты. Константа и степень диссоциации. Закон разведения Оствальда.
- •9. Основные положения теории сильных электролитов. Активность и коэффициент активности. Ионная сила раствора. Электролиты в организме человека.
- •10. Коллигативные свойства растворов. Закон Рауля. Осмос и осмотическое давление. Закон Вант-Гоффа.
- •Температура кипения разбавленных растворов
- •Криоскопическая и эбулиоскопическая константы
- •Осмос. Осмотическое давление разбавленных растворов
- •11. Коллигативные свойства растворов электролитов. Изотонический коэффициент, его физический смысл. Гипо-, гипер- и изотонические растворы. Роль осмоса в биосистемах. Плазмолиз и гемолиз.
- •12. Ионное произведение воды. Водородный показатель рН.
- •13. Буферные системы, их классификация и механизм действия. Уравнение Гендерсона-Гассельбаха. Буферная емкость.
- •I и II типы буферных систем
- •14. Буферные системы крови и сравнительная величина их буферной емкости. Понятие о кислотно-щелочном равновесии.
- •Кислотно-щелочное состояние.
- •15. Комплексные соединения, их изомерия, классификация и номенклатура.
- •1)По заряду комплекса: катионные, анионные и нейтральные комплексы.
- •2)По количеству комплексообразователей
- •3)По типу лиганда
- •4)По химическим свойствам: кислоты, основания, соли, неэлектролиты:
- •5)По количеству мест, занимаемых лигандом в координационной сфере
- •17. Предмет и методы химической кинетики. Скорость и константа скорости химической реакции. Закон действующих масс. Зависимость скорости реакции от температуры.
- •18. Простые и сложные реакции. Виды сложных реакций. Цепные фотохимические реакции. Роль фотохимических реакций в биологии и медицине.
- •19. Молекулярность и порядок химической реакции. Кинетические уравнения для реакции 0- и 1-го порядка. Энергия активации. Уравнение Аррениуса и энергетическая диаграмма реакции.
- •20. Основные положение теории активных соударений и теории переходного комплекса.
- •21. Гомогенный и гетерогенный катализ. Кислотно-основный катализ и роль в процессах метаболизма. Стадии гетерогенного катализа.
- •22. Ферментативный катализ.
- •23. Электродные потенциалы и механизм их возникновения. Строение двойного электрического слоя.
- •24. Уравнение Нернста для электродного потенциала и гальванического элемента.
- •25. Гальванический элемент Даниэля-Якоби. Принцип действия, эдс.
- •26. Классификация электродов. Электроды сравнения и определения. Водородный, хлорсеребряный и ионоселективные (стеклянные) электроды. Принцип их действия и электродные реакции.
- •27. Окислительно-восстановительный потенциал. Уравнение Нернста-Петерса.
- •28. Диффузный и мембранный потенциалы. Механизм действия и их роль в генерации биопотенциалов в организме.
- •29. Потенциометрия. Сущность метода и области применения в химических и медико-биологических исследованиях.
- •30. Вольтамперометрия (полярография), сущность метода и области применения в медико-биологических исследованиях.
- •31. Электропроводность растворов. Скорость движения ионов. Закон Кольрауша. Удельная и эквивалентная электропроводность.
- •32. Кондуктометрия, основные положения и область применения. Электропроводность тканей, применение в физиотерапии.
- •Органическая химия
- •33. Теория строения органических соединений а.М. Бутлерова.
- •34. Электронное строение атома углерода и виды гибридизации.
- •35. Классификация и номенклатура органических соединений.
Температура кипения разбавленных растворов
Жидкость кипит при той температуре, при которой общее давление насыщенного пара становится равным внешнему давлению. Если растворённое вещество нелетуче, то общее давление насыщенного пара над раствором равно парциальному давлению паров растворителя.
В этом случае давление насыщенных паров над раствором при любой температуре будет меньше, чем над чистым растворителем, и равенство его внешнему давлению будет достигаться при более высокой температуре.
Таким образом, температура кипения раствора нелетучего вещества Tкип всегда выше, чем температура кипения чистого растворителя при том же давлении T°кип.
Повышение температуры кипения бесконечно разбавленных растворов нелетучих веществ не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора
![]()
Криоскопическая и эбулиоскопическая константы
Коэффициенты пропорциональности К и Е в приведённых выше уравнениях – соответственно, криоскопическая и эбулиоскопическая постоянные растворителя, имеющие физический смысл понижения температуры кристаллизации и повышения температуры кипения раствора с концентрацией 1 моль/кг.
Осмос. Осмотическое давление разбавленных растворов
Осмос – это самопроизвольный процесс перехода растворителя через полупроницаемую мембрану из менее концентрированного раствора в более концентрированный раствор. Осмотические свойства раствора количественно характеризуются величиной осмотического давления.
Осмотическое давление (Росм) − это то давление, которое надо приложить к раствору, чтобы осмос прекратился.
Осмотическое давление идеальных растворов линейно зависит от температуры и молярной концентрации раствора M С и может быть рассчитано по уравнению:
![]()
Это уравнение представляет собой принцип Я. Х. Вант-Гоффа: осмотическое давление идеального раствора равно тому давлению, которое оказывало бы растворенное вещество, если бы оно, находясь в газообразном.
11. Коллигативные свойства растворов электролитов. Изотонический коэффициент, его физический смысл. Гипо-, гипер- и изотонические растворы. Роль осмоса в биосистемах. Плазмолиз и гемолиз.
Растворы электролитов, содержат в заметных концентрациях катионы и анионы, образующиеся в результате электролитической диссоциации молекул растворенного вещества. Благодаря увеличению общего числа частиц коллигативные свойства бесконечно разбавленных растворов электролитов существенно отличаются от тех же свойств растворов неэлектролитов. Этим, в частности, объясняется увеличение осмотического давления в сравнении со значением, предсказываемым законом Вант-Гоффа, понижение давления пара растворителя над раствором в сравнении с предсказываемым законом Рауля и др.
Если в результате диссоциации общее число частиц в растворе электролита возросло в i раз по сравнению с числом его молекул, то это должно быть учтено при расчете коллигативных свойств:
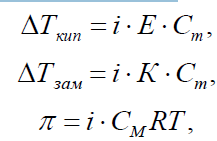
где i – изотонический коэффициент (коэффициент Вант-Гоффа).
Изотонический коэффициент i связан со степенью диссоциации электролита a следующим соотношением:
![]()
где n – число ионов, на которые при диссоциации распадается электролит.
Изотонический коэффициент показывает во сколько раз концентрация частиц в растворе больше числа растворенных молекул.
Изотонический раствор – раствор, имеющий осмотическое давление, равное внутриклеточному. Изотонические растворы – водные растворы, изотоничные плазме крови.
Гипертонический раствор – раствор, имеющий большую концентрацию вещества по отношению к внутриклеточной.
Гипотонический раствор – раствор, имеющий меньшее осмотическое давление по отношению к другому, то есть обладающий меньшей концентрацией вещества, не проникающего через мембрану.
При введении большого количества гипертонического раствора (Рраствора>Рвнутри клетки) вода через полупроницаемую клеточную оболочку выходит из клетки. Клетка теряет воду, эритроциты сморщиваются. Это явление называется плазмолиз. Гипертонические растворы иногда вводят для снятия отеков.
При введении большого количества гипотонического раствора в результате разности давлений (Р раствора < Р внутри клетки) вода пойдет в клетку. Клетка разбухает, клеточная оболочка лопается и клетка гибнет. Это явление называется лизис. Если лопаются эритроциты – гемолиз. Поэтому воду и гипотонические растворы нельзя вводить внутривенно. Такие растворы необходимо изотонировать. Внутримышечное и подкожное введение неизотонических растворов вызывает боль. Требование изотоничности предъявляется также к глазным растворам и каплям.
Если поместить растительную клетку в гипотонический раствор, вода путём осмоса поступает в клетку; протопласт при этом увеличивается в объёме и оказывает давление на сравнительно жёсткую клеточную стенку.
Этот процесс называется тургором. Тургорное давление препятствует дальнейшему поступлению воды в клетку. Именно тургорное давление поддерживает стебли растений в вертикальном положении, придаёт растениям прочность и устойчивость.
