- •1. Предметы и методы химической термодинамики. Термодинамические системы, параметры, функции.
- •2. Первое начало термодинамики. Внутренняя энергия. Энтальпия. Закон Гесса и термохимические расчеты.
- •3. Второе начало термодинамики. Энтропия. Энергия Гиббса.
- •4. Химический потенциал. Термодинамические условия равновесия, прогнозирование направления самопроизвольных процессов. Энтальпийный и энтропийный факторы.
- •Внутренняя энергия
- •Энтальпия
- •Энергия Гельмгольца
- •Энергия Гиббса
- •5. Обратимые и необратимые по направлению реакции. Понятие о химическом равновесии. Константа химического равновесия и способы ее выражения. Принцип Ле-Шателье.
- •6. Роль растворов в жизнедеятельности организмов. Термодинамика растворения: энтропийный и энтальпийный факторы растворения, их связь с механизмом растворения.
- •7. Растворимость газов в жидкостях. Законы Дальтона, Генри, Сеченова. Растворимость газов в крови.
- •Роль диффузии в процессах переноса веществ в биологических системах
- •8. Слабые электролиты. Константа и степень диссоциации. Закон разведения Оствальда.
- •9. Основные положения теории сильных электролитов. Активность и коэффициент активности. Ионная сила раствора. Электролиты в организме человека.
- •10. Коллигативные свойства растворов. Закон Рауля. Осмос и осмотическое давление. Закон Вант-Гоффа.
- •Температура кипения разбавленных растворов
- •Криоскопическая и эбулиоскопическая константы
- •Осмос. Осмотическое давление разбавленных растворов
- •11. Коллигативные свойства растворов электролитов. Изотонический коэффициент, его физический смысл. Гипо-, гипер- и изотонические растворы. Роль осмоса в биосистемах. Плазмолиз и гемолиз.
- •12. Ионное произведение воды. Водородный показатель рН.
- •13. Буферные системы, их классификация и механизм действия. Уравнение Гендерсона-Гассельбаха. Буферная емкость.
- •I и II типы буферных систем
- •14. Буферные системы крови и сравнительная величина их буферной емкости. Понятие о кислотно-щелочном равновесии.
- •Кислотно-щелочное состояние.
- •15. Комплексные соединения, их изомерия, классификация и номенклатура.
- •1)По заряду комплекса: катионные, анионные и нейтральные комплексы.
- •2)По количеству комплексообразователей
- •3)По типу лиганда
- •4)По химическим свойствам: кислоты, основания, соли, неэлектролиты:
- •5)По количеству мест, занимаемых лигандом в координационной сфере
- •17. Предмет и методы химической кинетики. Скорость и константа скорости химической реакции. Закон действующих масс. Зависимость скорости реакции от температуры.
- •18. Простые и сложные реакции. Виды сложных реакций. Цепные фотохимические реакции. Роль фотохимических реакций в биологии и медицине.
- •19. Молекулярность и порядок химической реакции. Кинетические уравнения для реакции 0- и 1-го порядка. Энергия активации. Уравнение Аррениуса и энергетическая диаграмма реакции.
- •20. Основные положение теории активных соударений и теории переходного комплекса.
- •21. Гомогенный и гетерогенный катализ. Кислотно-основный катализ и роль в процессах метаболизма. Стадии гетерогенного катализа.
- •22. Ферментативный катализ.
- •23. Электродные потенциалы и механизм их возникновения. Строение двойного электрического слоя.
- •24. Уравнение Нернста для электродного потенциала и гальванического элемента.
- •25. Гальванический элемент Даниэля-Якоби. Принцип действия, эдс.
- •26. Классификация электродов. Электроды сравнения и определения. Водородный, хлорсеребряный и ионоселективные (стеклянные) электроды. Принцип их действия и электродные реакции.
- •27. Окислительно-восстановительный потенциал. Уравнение Нернста-Петерса.
- •28. Диффузный и мембранный потенциалы. Механизм действия и их роль в генерации биопотенциалов в организме.
- •29. Потенциометрия. Сущность метода и области применения в химических и медико-биологических исследованиях.
- •30. Вольтамперометрия (полярография), сущность метода и области применения в медико-биологических исследованиях.
- •31. Электропроводность растворов. Скорость движения ионов. Закон Кольрауша. Удельная и эквивалентная электропроводность.
- •32. Кондуктометрия, основные положения и область применения. Электропроводность тканей, применение в физиотерапии.
- •Органическая химия
- •33. Теория строения органических соединений а.М. Бутлерова.
- •34. Электронное строение атома углерода и виды гибридизации.
- •35. Классификация и номенклатура органических соединений.
3. Второе начало термодинамики. Энтропия. Энергия Гиббса.
Закон сохранения энергии утверждает, что количество энергии при любых процессах остается неизменным. Но он ничего не говорит о том, какие энергетические превращения возможны.
Самопроизвольный процесс – процесс, который может протекать без затраты работы извне. Причем в результате может быть получена работа в количестве, пропорциональном произошедшему изменению состояния системы. Самопроизвольный процесс может протекать или обратимо, или необратимо. Все процессы в природе необратимы.
Вынужденный процесс – процесс, для протекания которого требуется затрата работы извне в количестве, пропорциональном производимому изменению состояния системы.
Второе начало термодинамики дает возможность определить, какой из процессов будет протекать самопроизвольно, какое количество работы может быть при этом получено, каков предел самопроизвольного течения процесса. Далее, второе начало термодинамики дает возможность определить, какими должны быть условия, чтобы нужный процесс протекал в необходимом направлении и в требуемой степени, что особенно важно для решения различных задач прикладного характера. Подобно первому, второе начало термодинамики выведено непосредственно из опыта.
Постулаты II закона термодинамики:
1. Теплота не может самопроизвольно переходить от менее нагретого
тела к более нагретому (Р. Клаузиус).
2. Невозможно построить вечный двигатель второго рода, то есть
невозможно теплоту полностью превратить в работу (В. Томсон).
3. Все самопроизвольные процессы в макроскопических системах
протекают в направлении от менее вероятного состояния к более вероятному состоянию системы (Л. Больцман).
Значение энтропии
реакции может быть найдено с использованием
следствия из закона Гесса, по формуле:
![]()
S– значения стандартной энтропии образования продуктов реакции и исходных веществ, νj ,νi – соответствующие продуктам и реагентам стехиометрические коэффициенты в уравнении химической реакции.
С учетом понятия энтропии второе начало термодинамики можно сформулировать так: энтропия изолированной системы возрастает в необратимых реакциях и остается неизменной в обратимых термодинамических процессах. Математическое выражение второго закона термодинамики:
![]()
где Q – теплота изотермического процесса, отнесенная к абсолютной температуре Т процесса.
Знак неравенства относится к необратимым процессам, а знак равенства – к обратимым процессам.
Энтропия при стандартных условиях обозначается S°298 и называется стандартной энтропией S°298 (Дж/моль·К). Часто пользуются и условным названием энтропийная единица (э.е.): 1 э.е. = 1 кал/моль·К. Значение энтропии для стандартных состояний веществ приведены в справочниках.
На рис. 2 показан характер зависимости энтропии вещества от температуры. Как видно из рисунка, при фазовом переходе вещества (из твердого состояния в жидкое, из жидкого в газообразное состояние) энтропия вещества скачкообразно возрастает, что связано с переходом в состояние с большей неупорядоченностью.
Действительно, температура повышается за счет подвода теплоты (по мере увеличения температуры становится возможным все большее число состояний, так как молекулы могут переходить в состояние со все более высокими значениями энергии, что приводит к увеличению термодинамической вероятности.
Процессы, для которых ΔS>0:
1) нагревание;
2) расширение газов;
3) фазовые переходы от твердого к жидкому и газообразному;
4) растворение
кристаллических веществ.
Процессы, для которых ΔS<0:
1) охлаждение;
2) сжатие газов;
3) конденсация и кристаллизация веществ.
Объяснение необратимости процессов в природе имеет статистическое (вероятностное) истолкование.
Макросостояние – это состояние вещества, характеризуемое его термодинамическими параметрами (температура, давление, объем, внутренняя энергия и т.д.).
Состояние же системы, характеризуемое состоянием каждой входящей в систему молекулы, называют микросостоянием, то есть это конкретное расположение отдельных частиц (молекул, атомов и т.д.) в данный момент времени, их скорости и взаимодействия.
Так как молекулы движутся хаотически, то имеется много микросостояний, соответствующих одному макросостоянию. Обозначим W – число микросостояний, соответствующее данному макросостоянию (как правило, W >> 1).
Термодинамической вероятностью или статистическим весом макросостояния W называется число микросостояний, осуществляющих данное макросостояние.
В состоянии равновесия и термодинамическая вероятность максимальна, и энтропия максимальна. Из этого можно сделать вывод, что междуними существует связь.
Молекулярную природу энтропии раскрыл австрийский физик Людвиг Больцман. Связь энтропии с молекулярным хаосом он описал уравнением: S к lnW,
где к – постоянная величина, названная константой Больцмана, которая
связана с газовой
постоянной соотношением:
![]() .
.
С этой точки зрения энтропия выступает, как мера беспорядочности, хаотичности состояния.
Связь между S и W позволяет несколько иначе сформулировать второе начало термодинамики: наиболее вероятным изменением энтропии является ее возрастание.
Энтропия замкнутой системы максимальна, при достижении системой равновесного состояния.
Постулат Планка (3 закон термодинамики) энтропия идеального кристалла чистого вещества при абсолютном нуле равна нулю.
Для характеристики процессов, протекающих в закрытых системах, применяют термодинамические функции состояния, одной из которых является изобарно-изотермический потенциал (свободная энергия Гиббса).
Изменение энергии Гиббса для биохимических процессов в условиях, отличных от стандартных, можно рассчитать на основе экспериментальных значений ΔН и ΔS для этих процессов по уравнению:
G H T S,
где ΔН – характеризует полное изменение энергии системы при p,T = const и отражает стремление системы к минимуму энергии (энтальпийный фактор);
ТΔS – характеризует ту часть энергии, которую нельзя превратить в работу, и отражает стремление системы к максимуму неупорядоченности (энтропийный фактор);
ΔG – характеризует ту часть энергии, которую можно перевести в работу, и является термодинамическим критерием самопроизвольного протекания процессов в прямом направлении при p,T = const.
Формула для расчета
ΔG реакции, протекающей в стандартных
условиях:
![]()
где ΔG°f,прод, ΔG°f,исх – значения стандартной энергии Гиббса продуктов реакции и исходных веществ, νj ,νi – соответствующие продуктам и реагентам стехиометрические коэффициенты в уравнении химической реакции.
В термодинамических расчетах используют значения энергии Гиббса, измеренные при стандартных условиях (ΔG°, кДж/моль). Данные величины приведены в справочниках термодинамических величин.
Для простых веществ в термодинамически устойчивой форме стандартная энергия Гиббса их образования принята равной 0.
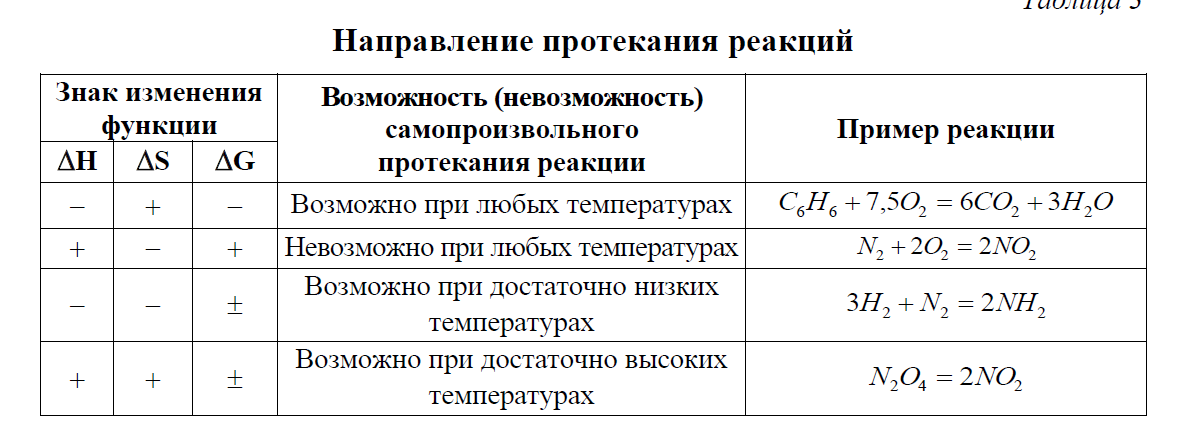
Рассчитав ΔG химической реакции, можно не производя экспериментов, дать ответ о принципиальной (термодинамической) возможности (или невозможности) ее протекания:
ΔG<0 – реакция протекает самопроизвольно в прямом направлении;
ΔG=0 – реакция находится в состоянии равновесия;
ΔG>0 – реакция протекать самопроизвольно в прямом направлении не может.