
- •1. Предметы и методы химической термодинамики. Термодинамические системы, параметры, функции.
- •2. Первое начало термодинамики. Внутренняя энергия. Энтальпия. Закон Гесса и термохимические расчеты.
- •3. Второе начало термодинамики. Энтропия. Энергия Гиббса.
- •4. Химический потенциал. Термодинамические условия равновесия, прогнозирование направления самопроизвольных процессов. Энтальпийный и энтропийный факторы.
- •Внутренняя энергия
- •Энтальпия
- •Энергия Гельмгольца
- •Энергия Гиббса
- •5. Обратимые и необратимые по направлению реакции. Понятие о химическом равновесии. Константа химического равновесия и способы ее выражения. Принцип Ле-Шателье.
- •6. Роль растворов в жизнедеятельности организмов. Термодинамика растворения: энтропийный и энтальпийный факторы растворения, их связь с механизмом растворения.
- •7. Растворимость газов в жидкостях. Законы Дальтона, Генри, Сеченова. Растворимость газов в крови.
- •Роль диффузии в процессах переноса веществ в биологических системах
- •8. Слабые электролиты. Константа и степень диссоциации. Закон разведения Оствальда.
- •9. Основные положения теории сильных электролитов. Активность и коэффициент активности. Ионная сила раствора. Электролиты в организме человека.
- •10. Коллигативные свойства растворов. Закон Рауля. Осмос и осмотическое давление. Закон Вант-Гоффа.
- •Температура кипения разбавленных растворов
- •Криоскопическая и эбулиоскопическая константы
- •Осмос. Осмотическое давление разбавленных растворов
- •11. Коллигативные свойства растворов электролитов. Изотонический коэффициент, его физический смысл. Гипо-, гипер- и изотонические растворы. Роль осмоса в биосистемах. Плазмолиз и гемолиз.
- •12. Ионное произведение воды. Водородный показатель рН.
- •13. Буферные системы, их классификация и механизм действия. Уравнение Гендерсона-Гассельбаха. Буферная емкость.
- •I и II типы буферных систем
- •14. Буферные системы крови и сравнительная величина их буферной емкости. Понятие о кислотно-щелочном равновесии.
- •Кислотно-щелочное состояние.
- •15. Комплексные соединения, их изомерия, классификация и номенклатура.
- •1)По заряду комплекса: катионные, анионные и нейтральные комплексы.
- •2)По количеству комплексообразователей
- •3)По типу лиганда
- •4)По химическим свойствам: кислоты, основания, соли, неэлектролиты:
- •5)По количеству мест, занимаемых лигандом в координационной сфере
- •17. Предмет и методы химической кинетики. Скорость и константа скорости химической реакции. Закон действующих масс. Зависимость скорости реакции от температуры.
- •18. Простые и сложные реакции. Виды сложных реакций. Цепные фотохимические реакции. Роль фотохимических реакций в биологии и медицине.
- •19. Молекулярность и порядок химической реакции. Кинетические уравнения для реакции 0- и 1-го порядка. Энергия активации. Уравнение Аррениуса и энергетическая диаграмма реакции.
- •20. Основные положение теории активных соударений и теории переходного комплекса.
- •21. Гомогенный и гетерогенный катализ. Кислотно-основный катализ и роль в процессах метаболизма. Стадии гетерогенного катализа.
- •22. Ферментативный катализ.
- •23. Электродные потенциалы и механизм их возникновения. Строение двойного электрического слоя.
- •24. Уравнение Нернста для электродного потенциала и гальванического элемента.
- •25. Гальванический элемент Даниэля-Якоби. Принцип действия, эдс.
- •26. Классификация электродов. Электроды сравнения и определения. Водородный, хлорсеребряный и ионоселективные (стеклянные) электроды. Принцип их действия и электродные реакции.
- •27. Окислительно-восстановительный потенциал. Уравнение Нернста-Петерса.
- •28. Диффузный и мембранный потенциалы. Механизм действия и их роль в генерации биопотенциалов в организме.
- •29. Потенциометрия. Сущность метода и области применения в химических и медико-биологических исследованиях.
- •30. Вольтамперометрия (полярография), сущность метода и области применения в медико-биологических исследованиях.
- •31. Электропроводность растворов. Скорость движения ионов. Закон Кольрауша. Удельная и эквивалентная электропроводность.
- •32. Кондуктометрия, основные положения и область применения. Электропроводность тканей, применение в физиотерапии.
- •Органическая химия
- •33. Теория строения органических соединений а.М. Бутлерова.
- •34. Электронное строение атома углерода и виды гибридизации.
- •35. Классификация и номенклатура органических соединений.
26. Классификация электродов. Электроды сравнения и определения. Водородный, хлорсеребряный и ионоселективные (стеклянные) электроды. Принцип их действия и электродные реакции.
Существует два основных вида классификации электродов.
По химическому составу:
• Электроды 1 рода – это электроды, электродная реакция которых, обратима только лишь по катиону или по аниону. Например, электроды, образующие элемент Даниэля-Якоби – медный и цинковый.
• Электроды 2 рода – это электроды, электродная реакция которых обратима для двух видов ионов: и катионов и анионов.
• Окислительно-восстановительные электроды (Red – Ox). Под термином «Red – Ox – электрод» понимают такой электрод, где все элементы полуреакции (и окисленная и восстановленная форма) находятся в растворе. Металлические же электроды, погруженные в раствор, в реакции не участвуют, а служат лишь переносчиком электронов.
По назначению:
• Электроды сравнения – это такие электроды, потенциал которых точно известен, устойчив во времени и не зависит от концентрации ионов в растворе. К таким электродам можно отнести: стандартный водородный электрод, каломельный электрод и хлорсеребряный электрод.
• Электроды определения – это такие электроды, потенциал которых зависит от концентрации каких-либо ионов в растворе, поэтому по величине электродного потенциала можно определить концентрацию этих ионов. Наиболее часто в качестве индикаторных электродов используют стеклянный и хингидронный электроды.
Стеклянные электроды – распространенные, удобные в обращении, ионоселективные электроды. С их помощью определяют рН растворов, концентрацию ионов Na+, K+.
Стеклянный электрод для измерения рН растворов. В зависимости от целевого назначения электрод может иметь разную форму и размер. В аналитическом контроле для потенциометрических определений часто применяют стеклянный электрод с шариком диаметром 10-15 мм на конце стеклянной трубки (шарообразная часть – мембрана). Главной частью электрода является тонкая, чувствительная к иону Н+, мембрана. Её изготавливают обычно из стекла, содержащего 22 % оксида натрия, 6% оксида кальция и 72 % оксида кремния. Внутренним раствором служит 0,1 М раствор соляной кислоты, насыщенный хлоридом серебра.
Стеклянные электроды нуждаются в предварительной подготовке перед использованием при определенных условиях. Чувствительностью к ионам водорода обладает только хорошо вымоченная мембрана электрода в 0,1 М растворе соляной кислоты. При длительном хранении электрода в воде на обеих сторонах мембраны образуется тонкий (~ 10-4 мм) слой гидратированного геля и все пустоты в трехмерной сетке из атомов Si и O, составляющей структуру стекла, на поверхности занимают ионы Н+, вытесняя находившиеся там ионы натрия. При движении внутрь мембраны уменьшается число пустот, занятых протонами, и увеличивается число пустот, занятых ионами натрия. Специальными измерениями с изотопами доказано, что ионы Н+ через слой сухого стекла (~ 10-1 мм) не проходят. Внутри этого слоя ток переносится ионами натрия, способными перемещаться внутри пустот на расстоянии, равное нескольким радиусам, и передавать энергию соседним ионам натрия.

Рисунок - 5 Стеклянный электрод для измерения рН
1 – стеклянная Н+ - чувствительная мембрана
2 – насыщенный раствор AgCl, 0,1 М по HCl
3 – серебряная проволока (внутренний электрод сравнения)
4 – стеклянная трубка
Потенциал хорошо вымоченного стеклянного электрода описывается уравнением:
Е = К + 0,058.lg[H+] (36)
где К – постоянная, зависящая от сорта стекла и устройства электрода
(справочные данные)
[H+] - концентрация ионов водорода в анализируемом растворе, в который
погружен стеклянный электрод
При погружении стеклянного электрода в анализируемый раствор на границе двух фаз – тонкой стеклянной мембраны и анализируемого раствора – возникает разность потенциалов, обусловленная обменом ионов щелочных металлов, находящихся в стекле, с ионами водорода из раствора.
Стеклянный электрод используют для измерения рН в интервале, зависящем от состава стекла. Он пригоден для определения рН в интервале от 0 до 12. Для разных участков этого интервала рН применяют стеклянные электроды из разных стекол.
При определении рН для сильнокислых (рН ~ 1 – 2) растворов возможно получение неправильных результатов, обусловленных, как полагают, разрушением стекла под действием таких растворов. В сильнощелочных (рН ≥ 12) растворах нарушается линейная зависимость потенциала электрода от рН анализируемого раствора, поскольку электрод реагирует на ионы щелочных металлов.
Недостатком стеклянного электрода является хрупкость стеклянной мембраны, а также возможность избирательной адсорбции некоторых ионов стеклянной поверхностью электрода, вследствие чего возникают ошибки при измерении. Для защиты от повреждений стеклянный электрод помещают внутрь открытой снизу стеклянной толстостенной трубки большего диаметра.
Используя стекла различного состава, можно получать стеклянные мембраны, обладающие пониженной селективностью к ионам Н+ и высокой селективностью к однозарядным ионам металлов. Электроды с такими мембранами используют для определения ионов натрия, калия и т.п.
Стеклянные электроды для измерения рН применяют в приборах, называемых рН - метрами. Шкалы рН - метров градуированы в единицах рН.
Водородный электрод. Поскольку водород не является проводником электричества, то в качестве водородного электрода используют платинированный платиновый электрод (платинированный - покрытый платиновой чернью, которая обладает свойством поглощать в больших количествах водород и хорошо проводить электрический ток) в виде пластинки. Покрытие поверхности платины платиновой чернью ("платинирование") производится электролизом раствора, содержащего 3% раствор платинохлористоводородной кислоты и небольшое количество ацетата свинца. К платиновой пластинке, впаянной в стеклянную трубочку диаметром 4 – 5 мм и длиной 10 см , находящейся внутри трубки, припаивают медную проволоку, идущую к клемме потенциометра. Трубочка с платиной помещается внутри более широкой стеклянной трубки с ответвлением в верхней ее части, куда поступает очень чистый водород, и отверстиями в нижней части для удаления избытка водорода (рис. 6).
Для этого электрода скачок потенциала отвечает установлению равновесия (Pt) Н2(газ) ↔ 2Н+ + 2е между катионами H+ в растворе и молекулами H2 через посредство платиновой поверхности, имеющей свободные электроны и адсорбирующей водород. Потенциал водородного электрода (H2,Pt|2H+) зависит от концентрации ионов водорода в соответствии с уравнением Нернста:
E = E0 + 0,058.lg[H+] (37)
Водородный электрод при давленииводорода рН2 равном 1 атм (1,01 х 105 Па), [H+] равной 1, называют стандартным водородным электродом, а его потенциал (Е0) условно принимают равным нулю. Потенциалы других электродов, отнесенные к стандартному водородному электроду, составляют шкалу стандартных электродных потенциалов.
Таким образом, если -lg[H+] = pH, то из (37) Е = -0,058.рН и, следовательно,
![]() (38)
(38)
Водородный электрод может служить электродом сравнения, если величина его потенциала (Е) сохраняется постоянной. Это возможно, если электрод погружен в раствор сильно концентрированной кислоты. Если потенциал водородного электрода обратимо зависит от концентрации ионов водорода, то он может служить индикаторным электродом.
Водородный электрод следует хранить в дистиллированной воде в закрытом сосуде.
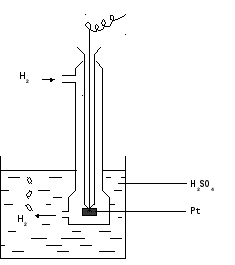
Рисунок - 6 Водородный электрод
Главным преимуществом водородного электрода является возможность измерения концентрации водородных ионов в широких пределах, в кислых и щелочных растворах, интервал рН от 0 до 14. Однако водородный электрод имеет недостатки: 1) необходимость тщательной очистки водорода, 2) невозможность использования электрода в растворах, содержащих сильные окислители или восстановители, 3) медленное установление потенциала, особенно в щелочных растворах.
Хингидронный электрод применяют в ряде случаев при потенциометрических измерениях для определения рН раствора. Он представляет собой платиновую проволоку или пластинку, впаянную в стекло. Такой электрод погружают в раствор, значение рН которого определяют. В исследуемый раствор добавляют небольшое количество хингидрона, который в растворе диссоциирует на хинон и гидрохинон
(С6Н4)2О2(ОН)2 ↔ С6Н4О2 + С6Н4(ОН)2 (39)
Между хиноном и гидрохиноном устанавливается равновесие
С6Н4О2 + 2Н+ + 2е ↔ С6Н4(ОН)2 (40)
Это равновесие зависит от концентрации ионов водорода в растворе. Константа равновесия этого процесса
![]() (41)
(41)
Потенциал платинового электрода, погруженного в такую систему, определяется уравнением:
![]() (42)
(42)
Так как хинон и гидрохинон образуются при диссоциации хингидрона в эквивалентном количестве, то соотношение
![]() (43)
(43)
и зависимость потенциала электрода будет тогда определяться следующим уравнением:
Е = Е0 + 0,058.lg[H+] (44)
или ![]() (45)
(45)
Таким образом, измеряя потенциал хингидронного электрода, можно вычислить рН или концентрацию водородных ионов в растворе. Нормальный потенциал системы хинон-гидрохинон Е0 = 0,699 В.
Для определения рН раствора или при потенциометрическом титровании кислот достаточно внести небольшое количество хингидрона в исследуемый раствор, перемешать его и опустить в него чистый платиновый электрод. Потенциал хингидронного электрода устанавливается быстро и обратимо реагирует на изменение концентрации ионов водорода. Основное его преимущество - простота устройства и способность работать в сильнокислых средах. Хингидронный электрод используется для определения рН от 0 до 8, однако, его нельзя применять для определения рН в присутствии сильных окислителей или восстановителей.
