
- •1. Предметы и методы химической термодинамики. Термодинамические системы, параметры, функции.
- •2. Первое начало термодинамики. Внутренняя энергия. Энтальпия. Закон Гесса и термохимические расчеты.
- •3. Второе начало термодинамики. Энтропия. Энергия Гиббса.
- •4. Химический потенциал. Термодинамические условия равновесия, прогнозирование направления самопроизвольных процессов. Энтальпийный и энтропийный факторы.
- •Внутренняя энергия
- •Энтальпия
- •Энергия Гельмгольца
- •Энергия Гиббса
- •5. Обратимые и необратимые по направлению реакции. Понятие о химическом равновесии. Константа химического равновесия и способы ее выражения. Принцип Ле-Шателье.
- •6. Роль растворов в жизнедеятельности организмов. Термодинамика растворения: энтропийный и энтальпийный факторы растворения, их связь с механизмом растворения.
- •7. Растворимость газов в жидкостях. Законы Дальтона, Генри, Сеченова. Растворимость газов в крови.
- •Роль диффузии в процессах переноса веществ в биологических системах
- •8. Слабые электролиты. Константа и степень диссоциации. Закон разведения Оствальда.
- •9. Основные положения теории сильных электролитов. Активность и коэффициент активности. Ионная сила раствора. Электролиты в организме человека.
- •10. Коллигативные свойства растворов. Закон Рауля. Осмос и осмотическое давление. Закон Вант-Гоффа.
- •Температура кипения разбавленных растворов
- •Криоскопическая и эбулиоскопическая константы
- •Осмос. Осмотическое давление разбавленных растворов
- •11. Коллигативные свойства растворов электролитов. Изотонический коэффициент, его физический смысл. Гипо-, гипер- и изотонические растворы. Роль осмоса в биосистемах. Плазмолиз и гемолиз.
- •12. Ионное произведение воды. Водородный показатель рН.
- •13. Буферные системы, их классификация и механизм действия. Уравнение Гендерсона-Гассельбаха. Буферная емкость.
- •I и II типы буферных систем
- •14. Буферные системы крови и сравнительная величина их буферной емкости. Понятие о кислотно-щелочном равновесии.
- •Кислотно-щелочное состояние.
- •15. Комплексные соединения, их изомерия, классификация и номенклатура.
- •1)По заряду комплекса: катионные, анионные и нейтральные комплексы.
- •2)По количеству комплексообразователей
- •3)По типу лиганда
- •4)По химическим свойствам: кислоты, основания, соли, неэлектролиты:
- •5)По количеству мест, занимаемых лигандом в координационной сфере
- •17. Предмет и методы химической кинетики. Скорость и константа скорости химической реакции. Закон действующих масс. Зависимость скорости реакции от температуры.
- •18. Простые и сложные реакции. Виды сложных реакций. Цепные фотохимические реакции. Роль фотохимических реакций в биологии и медицине.
- •19. Молекулярность и порядок химической реакции. Кинетические уравнения для реакции 0- и 1-го порядка. Энергия активации. Уравнение Аррениуса и энергетическая диаграмма реакции.
- •20. Основные положение теории активных соударений и теории переходного комплекса.
- •21. Гомогенный и гетерогенный катализ. Кислотно-основный катализ и роль в процессах метаболизма. Стадии гетерогенного катализа.
- •22. Ферментативный катализ.
- •23. Электродные потенциалы и механизм их возникновения. Строение двойного электрического слоя.
- •24. Уравнение Нернста для электродного потенциала и гальванического элемента.
- •25. Гальванический элемент Даниэля-Якоби. Принцип действия, эдс.
- •26. Классификация электродов. Электроды сравнения и определения. Водородный, хлорсеребряный и ионоселективные (стеклянные) электроды. Принцип их действия и электродные реакции.
- •27. Окислительно-восстановительный потенциал. Уравнение Нернста-Петерса.
- •28. Диффузный и мембранный потенциалы. Механизм действия и их роль в генерации биопотенциалов в организме.
- •29. Потенциометрия. Сущность метода и области применения в химических и медико-биологических исследованиях.
- •30. Вольтамперометрия (полярография), сущность метода и области применения в медико-биологических исследованиях.
- •31. Электропроводность растворов. Скорость движения ионов. Закон Кольрауша. Удельная и эквивалентная электропроводность.
- •32. Кондуктометрия, основные положения и область применения. Электропроводность тканей, применение в физиотерапии.
- •Органическая химия
- •33. Теория строения органических соединений а.М. Бутлерова.
- •34. Электронное строение атома углерода и виды гибридизации.
- •35. Классификация и номенклатура органических соединений.
15. Комплексные соединения, их изомерия, классификация и номенклатура.
16. Координационная теория Вернера. Комплексообразующая способность s, p, d, f-элементов. Характер связи в комплексных соединениях с точки зрения метода валентных связей. Константа устойчивости комплексных ионов. Комплексы в медицине.
Основные положения теории Вернера
Все вещества в природе делятся на соединения:
1) I-го порядка – соединения, образование которых можно объяснить с позиций классической теории валентности. Например: KCl, CuCl2, Na2O, CuO.
2) Высшего порядка, которые делятся на:
а) двойные соли (KAl(SO4)2);
б) комплексные соединения (K4[Fe(CN)6]).
Комплексными соединениями называют соединения, в узлах кристаллов которых находятся комплексы (комплексные ионы), способные к самостоятельному существованию.
Комплекс – центральный атом (ион металла), окруженный набором лигандов.
[Co(NH3)6]3+ – комплекс.
[Co(NH3)6]Cl3 – комплексное соединение.
[Fe(CO)5] – комплекс и комплексное соединение.
Особый тип валентных сил, на котором основано образование комплексных соединений, был назван Вернером координационной связью, а теория получила название координационной.
Суть теории можно свести к следующим положениям:
1) центральное место в комплексном соединении занимает комплексообразователь;
2) вокруг комплексообразователя расположены лиганды или адденды;
3) координационное число (КЧ) – число, показывающее, сколько лигандов удерживает комплексообразователь.
Структура комплексных соединений
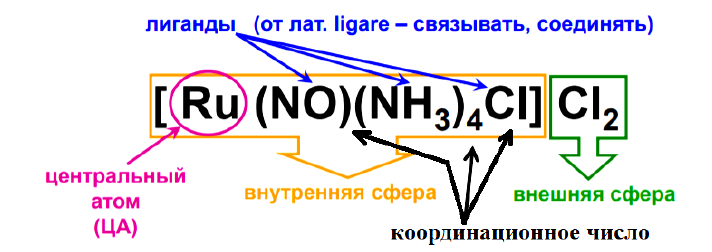
Комплексообразователь – центральный атом комплексной частицы. Обычно комплексообразователь – атом металла. Степень окисления комплексообразователя может быть положительной, отрицательной или равной нулю.
Различают 2 группы комплексообразователей:
1. Катионы d- и f-элементов (Fe2+, Fe3+, Co2+, Co3+, Ni2+); некоторые р-элементы в положительной степени окисления (Р5+, S6+, Cl7+, [BF4]–), а также s-элементы (Na+, K+, Be2+).
2. Нейтральные атомы d-элементов (Fe, Co, Ni, Cr), а также элементы благородных газов.
Чаще всего комплексообразователями являются положительно заряженные ионы d-элементов. Ими также могут быть и ионы р-элементов. f-Элементы редко встречаются сами по себе. s-Элементы в качестве комплексообразователей выступают довольно редко.
Лиганды – атомы или изолированные группы атомов, располагающиеся вокруг комплексообразователя. Лигандами могут быть: нейтральные молекулы (H2O, CO, NH3), анионы (OH-, Cl-, PO43-), а также катион водорода.
Донорный атом – атом в лиганде, который непосредственно связан с центральным атомом.
Координационное число – число σ-связей, образуемых комплексообразователя с лигандами или число донорных атомов, которые связаны с центральным атомом. КЧ зависит от электронного строения центрального атома, от его степени окисления, размеров центрального атома и лигандов, условий образования комплексного соединения, температуры и других факторов. КЧ может принимать значения от 2 до 12. Чаще всего оно равно шести, несколько реже – четырем.
Донорно-акцепторный механизм: лиганд предоставляет электронную пару (основание Льюиса), а центральный атом вакантную орбиталь (кислота Льюиса).
Внутренняя сфера комплексного соединения – совокупность центрального атома и лигандов.
Внешняя сфера – ионы, не входящие во внутреннюю сферу и связанные с комплексным ионом ионной связью.
Молекула комплексного соединения всегда электронейтральна, поэтому суммарный заряд ионов внешней сферы равен по значению и противоположен по знаку заряду внутренней сферы.
Номенклатура комплексных соединений
Названия комплексных соединений строятся по общим правилам систематической номенклатуры – справа налево.
Если комплекс катионный (внутренняя сфера заряжена положительно), название всегда! начинается с аниона: сульфат, хлорид, гидроксид и т. д.
Если комплекс анионный (внутренняя сфера заряжена отрицательно) или нейтральный название начинается с комплексного иона. Первыми перечисляются лиганды с обязательным указанием их количества, если число данного лиганда больше 1, затем название комплексообразователя. Количество лигандов указывают греческими числительными: 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса.
Лиганды перечисляются в следующем порядке: первыми перечисляются лиганды, имеющие заряд, в алфавитном порядке: во внутренней сфере анионы называют, прибавляя к их названию окончание -о. Например: Cl– (хлоро-), CN– (циано-), OH– (гидроксо-) и т.д. Последними перечисляются нейтральные молекулы. К нейтральным молекулам окончание -о не добавляется.
Теперь разберемся с названиями комплексообразователей. Если комплекс катионный, то используется просто название металла в родительном падеже с указанием валентности в скобках римской цифрой. Если металл имеет только одну валентность, то тогда она не указывается.
Если комплекс нейтральный, то название комплексообразователя дается в именительном падеже.
Если комплекс анионный, то название комплексообразователя дается как солеобразующего металла, то есть берется название металла и обычно добавляется суффикс «ат»
Название комплексного иона дается слитно, то есть в одно слово записываем лиганды и их число + комплексообразователь. Название внешней сферы идет отдельным словом.
Между внутренней и внешней сферами – связь ионная. Комплексные ионы образуются в основном вследствие ковалентной связи, образованной по донорно-акцепторному механизму (координационная связь). Природа координационной связи описывается следующими методами: метод валентных связей (МВС), теория кристаллического поля (ТКП) и метод молекулярных орбиталей (ММО).
Метод валентных связей. Химическая связь в комплексных соединениях
Одним из наиболее удовлетворительных методов описания строения комплексных соединений является метод валентных связей.
Основные положения метода валентных связей:
1. Между комплексообразователем и лигандами в комплексе возникает донорно-акцепторная связь, на образование которой лиганды (доноры) предоставляют свои неподеленные электронные пары, а комплексообразователь (акцептор) – вакантные орбитали. Прочность связей зависит от величины области перекрывания орбиталей: чем она больше, тем устойчивее комплекс.
2. Атомные орбитали, принимающие участие в образовании связей, подвергаются гибридизации, тип которой определяется количеством, природой и электронной структурой лигандов и которая, в свою очередь, определяет геометрическое строение комплекса.
3. Магнитные свойства комплекса объясняются характером застройки орбиталей комплексообразователя. При наличии неспаренных электронов комплекс проявляет парамагнитные свойства, а если все электроны спарены, то комплекс диамагнитен.
Классификация комплексных соединений
