
- •1. Предметы и методы химической термодинамики. Термодинамические системы, параметры, функции.
- •2. Первое начало термодинамики. Внутренняя энергия. Энтальпия. Закон Гесса и термохимические расчеты.
- •3. Второе начало термодинамики. Энтропия. Энергия Гиббса.
- •4. Химический потенциал. Термодинамические условия равновесия, прогнозирование направления самопроизвольных процессов. Энтальпийный и энтропийный факторы.
- •Внутренняя энергия
- •Энтальпия
- •Энергия Гельмгольца
- •Энергия Гиббса
- •5. Обратимые и необратимые по направлению реакции. Понятие о химическом равновесии. Константа химического равновесия и способы ее выражения. Принцип Ле-Шателье.
- •6. Роль растворов в жизнедеятельности организмов. Термодинамика растворения: энтропийный и энтальпийный факторы растворения, их связь с механизмом растворения.
- •7. Растворимость газов в жидкостях. Законы Дальтона, Генри, Сеченова. Растворимость газов в крови.
- •Роль диффузии в процессах переноса веществ в биологических системах
- •8. Слабые электролиты. Константа и степень диссоциации. Закон разведения Оствальда.
- •9. Основные положения теории сильных электролитов. Активность и коэффициент активности. Ионная сила раствора. Электролиты в организме человека.
- •10. Коллигативные свойства растворов. Закон Рауля. Осмос и осмотическое давление. Закон Вант-Гоффа.
- •Температура кипения разбавленных растворов
- •Криоскопическая и эбулиоскопическая константы
- •Осмос. Осмотическое давление разбавленных растворов
- •11. Коллигативные свойства растворов электролитов. Изотонический коэффициент, его физический смысл. Гипо-, гипер- и изотонические растворы. Роль осмоса в биосистемах. Плазмолиз и гемолиз.
- •12. Ионное произведение воды. Водородный показатель рН.
- •13. Буферные системы, их классификация и механизм действия. Уравнение Гендерсона-Гассельбаха. Буферная емкость.
- •I и II типы буферных систем
- •14. Буферные системы крови и сравнительная величина их буферной емкости. Понятие о кислотно-щелочном равновесии.
- •Кислотно-щелочное состояние.
- •15. Комплексные соединения, их изомерия, классификация и номенклатура.
- •1)По заряду комплекса: катионные, анионные и нейтральные комплексы.
- •2)По количеству комплексообразователей
- •3)По типу лиганда
- •4)По химическим свойствам: кислоты, основания, соли, неэлектролиты:
- •5)По количеству мест, занимаемых лигандом в координационной сфере
- •17. Предмет и методы химической кинетики. Скорость и константа скорости химической реакции. Закон действующих масс. Зависимость скорости реакции от температуры.
- •18. Простые и сложные реакции. Виды сложных реакций. Цепные фотохимические реакции. Роль фотохимических реакций в биологии и медицине.
- •19. Молекулярность и порядок химической реакции. Кинетические уравнения для реакции 0- и 1-го порядка. Энергия активации. Уравнение Аррениуса и энергетическая диаграмма реакции.
- •20. Основные положение теории активных соударений и теории переходного комплекса.
- •21. Гомогенный и гетерогенный катализ. Кислотно-основный катализ и роль в процессах метаболизма. Стадии гетерогенного катализа.
- •22. Ферментативный катализ.
- •23. Электродные потенциалы и механизм их возникновения. Строение двойного электрического слоя.
- •24. Уравнение Нернста для электродного потенциала и гальванического элемента.
- •25. Гальванический элемент Даниэля-Якоби. Принцип действия, эдс.
- •26. Классификация электродов. Электроды сравнения и определения. Водородный, хлорсеребряный и ионоселективные (стеклянные) электроды. Принцип их действия и электродные реакции.
- •27. Окислительно-восстановительный потенциал. Уравнение Нернста-Петерса.
- •28. Диффузный и мембранный потенциалы. Механизм действия и их роль в генерации биопотенциалов в организме.
- •29. Потенциометрия. Сущность метода и области применения в химических и медико-биологических исследованиях.
- •30. Вольтамперометрия (полярография), сущность метода и области применения в медико-биологических исследованиях.
- •31. Электропроводность растворов. Скорость движения ионов. Закон Кольрауша. Удельная и эквивалентная электропроводность.
- •32. Кондуктометрия, основные положения и область применения. Электропроводность тканей, применение в физиотерапии.
- •Органическая химия
- •33. Теория строения органических соединений а.М. Бутлерова.
- •34. Электронное строение атома углерода и виды гибридизации.
- •35. Классификация и номенклатура органических соединений.
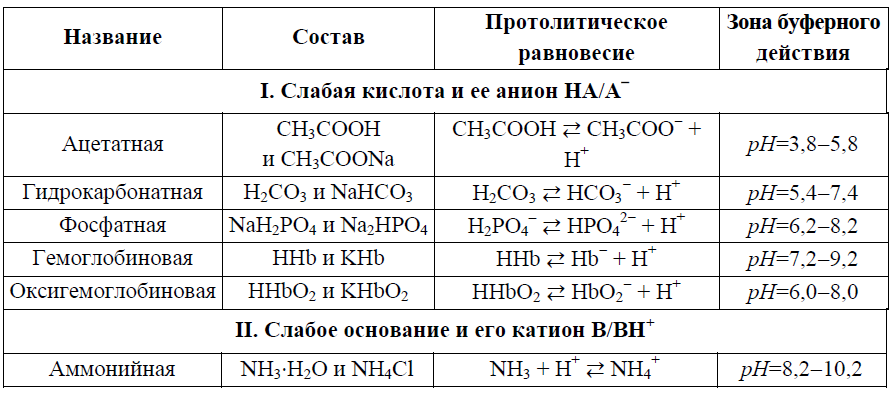
13. Буферные системы, их классификация и механизм действия. Уравнение Гендерсона-Гассельбаха. Буферная емкость.
Буферные системы – это равновесные системы, способные поддерживать постоянство рН при разбавлении раствора или при добавлении к нему небольшого количества сильной кислоты или щелочи. Эта способность буферных систем называется буферным действием. Растворы, содержащие одну или несколько буферных систем, называются буферными растворами.
Буферные растворы применяются для сохранения активной реакции среды на определенном уровне, если тот или иной процесс должен быть проведен при постоянном значении рН.
Буферные растворы в зависимости от своего состава делятся на 2 основных типа: кислотные и основные.
I и II типы буферных систем
III. Аминокислотные и белковые буферные системы.
Если аминокислоты или белки находятся в изоэлектрическом состоянии (суммарный заряд молекулы равен нулю), то растворы этих соединений не являются буферными. Они начинают проявлять буферное действие, когда к ним добавляют некоторое количество кислоты или щелочи. Тогда часть белка переходит из изоэлектрического состояния в форму «белок-кислота» (катионная форма аминокислоты) или в форму «белок-основание» (анионная форма аминокислоты):
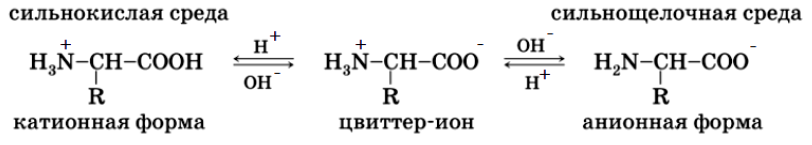
Существует три буферные системы жидкостей организма – бикарбонатная, фосфатная, белковая (включая гемоглобиновую).
Механизм действия буферных систем
С точки зрения протолитической теории буферное действие растворов обусловлено наличием кислотно-основного равновесия общего типа:

Сопряженные кислотно-основные пары А-/НА и В/ВН+ составляют буферные системы.
Сущность буферного действия смеси слабой кислоты с ее солью можно рассмотреть на примере ацетатного буферного раствора.
При добавлении к нему сильной кислоты (например, HCl) проис-
ходит реакция:
CH3COONa + HCl = NaCl + CH3COOH – молекулярное уравнение
H+ + CH3COO- = CH3COOH – сокращенное ионное уравнение
В результате этого воздействия сильная кислота замещается на эквивалентное количество плохо диссоциированной слабой кислоты буферной системы, поэтому концентрация ионов Н+ (активная кислотность) в растворе существенно не изменяется.
При добавлении к буферной смеси сильного основания (например, NaOH) происходит реакция:
CH3COOH + NaOH = CH3COONa + H2O – молекулярное уравнение
CH3COOН + OH– = CH3COO– + H2O – сокращенное ионное уравнение
В результате сильное основание замещается на эквивалентное количество нейтральной соли буферной системы, поэтому концентрация ионов водорода в ней опять изменится незначительно.
Таким образом, для буферных растворов I типа справедливы заключения:
• Чем больше концентрация соли, тем большее количество кислоты
можно добавлять к буферу без существенного понижения рН.
• Чем больше концентрация кислоты, тем большее количество щелочи
можно добавлять к буферу без существенного повышения рН.
Механизм действия основных буферных систем рассмотрим на примере аммиачного буфера.
Добавленная к нему сильная кислота провзаимодействует со слабым основанием и заместится на эквивалентное количество солевой компоненты буфера:
NH3 × H2О + HCl = NH4Cl + H2О – молекулярное уравнение
NH3 × H2О + H+ = NH4++ H2О – сокращенное ионное уравнение
Щелочь вступит в реакцию с солью буферной системы и вместо нее образуется эквивалентное количество слабого основания:
NH4Cl + NaOH = NH3 + H2О + NaCl – молекулярное уравнение
NH4+ + OH- = NH3 + H2О – сокращенное ионное уравнение
Таким образом, буферное действие осуществляется за счет связывания добавляемых в раствор ионов Н+ или ОН- в малодиссоциированные соединения в результате реакций этих ионов с соответствующими компонентами буферной системы.
Зона буферного действия – интервал pH, в котором буферная система способна поддерживать постоянное значение pH.
Для буферных систем
I типа:
![]()
Для буферных систем
II типа:
![]()
Ацидоз – типовая форма нарушения КОС (кислотно-основного состояния), характеризующаяся относительным или абсолютным избытком в организме кислот.
Алкалоз – типовая форма нарушения КОС, характеризующаяся относительным или абсолютным избытком в организме оснований.
Расчет рН буферных систем
Расчет рН буферных систем производят в соотвествии с уравнениями Гендерсона-Гассельбаха.
Для буферной системы I типа НА/A- концентрацию ионов Н+ в растворе легко вычислить, исходя из константы диссоциации слабой кислоты:
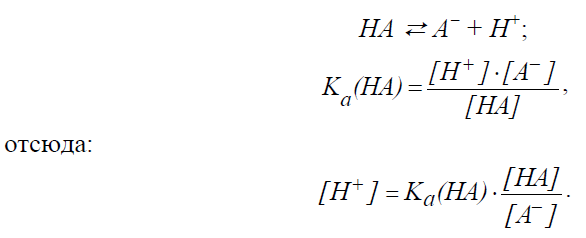
В присутствии второго компонента буферного раствора – сильного электролита – равновесие диссоциации слабой кислоты НA, согласно принципу Ле-Шателье, смещено влево. Поэтому можно считать, что концентрация недиссоциированных молекул НA практически равна концентрации кислоты в буферном растворе, а концентрация ионов А+ равна концентрации соли.
В таком случае
можно записать:
![]()
где С(кислоты) и С(соли) – молярные
концентрации кислоты и соли. Если
равенство прологарифмировать (взять
отрицательный десятичный логарифм
левой и правой частей уравнения), то
получим:
![]()
Так, рН фосфатной буферной системы
состава NaH2PO4/Na2HPO4 можно рассчитать по
уравнению:
![]()
где pКа (H2PO4- ) – показатель константы диссоциации фосфорной кислоты по второй ступени.
В случаях, когда требуется получить буферный раствор с заданным значением pH, используют уравнение:
![]()
где индексом «0» обозначены характеристики исходных растворов кислоты и соли, смешиванием которых получают требуемую буферную смесь.
Для буферной системы II типа В/ВН+, например
аммонийной, гидроксидный и водородный
показатели вычисляют по уравнениям:

где pKb – показатель константы диссоциации основания.
Буферная емкость
Прибавлять кислоту или щелочь, существенно не меняя рН буферного раствора, можно лишь в относительно небольших количествах, так как способность буферных растворов сохранять постоянство рН ограничена.
• Величина, характеризующая способность буферного раствора противодействовать смещению реакции среды при добавлении кислот и щелочей, называется буферной емкостью (В).
Различают буферную емкость по кислоте (Вк) и по щелочи (Вщ).
• Буферная емкость (В) измеряется количеством кислоты или щелочи (моль или ммоль эквивалента), добавление которого к 1 л буферного раствора изменяет рН на единицу.
Математически
буферная емкость определяется следующим
образом:
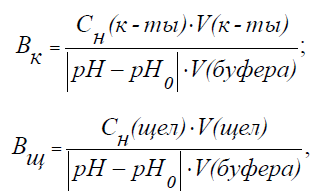
где Сн(к-ты), Сн(щел) - молярные концентрации эквивалента кислоты и щелочи (моль/л); V(к-ты ), V(щел) - объемы добавленных растворов кислоты или щелочи (л; мл); V(буфера) - объем буферного раствора (л; мл); pH0 и pH - значения рН буферного раствора до и после титрования кислотой или щелочью (изменение рН берется по абсолютной величине).
Буферную емкость выражают в [моль/л] или в [ммоль/л].
Из буферных растворов с равной концентрацией наибольшей емкостью обладают те, которые составлены из равного количества компонентов, то есть соотношение С(кислота) /С(соли) должно быть равно единице.
