
- •1. Предметы и методы химической термодинамики. Термодинамические системы, параметры, функции.
- •2. Первое начало термодинамики. Внутренняя энергия. Энтальпия. Закон Гесса и термохимические расчеты.
- •3. Второе начало термодинамики. Энтропия. Энергия Гиббса.
- •4. Химический потенциал. Термодинамические условия равновесия, прогнозирование направления самопроизвольных процессов. Энтальпийный и энтропийный факторы.
- •Внутренняя энергия
- •Энтальпия
- •Энергия Гельмгольца
- •Энергия Гиббса
- •5. Обратимые и необратимые по направлению реакции. Понятие о химическом равновесии. Константа химического равновесия и способы ее выражения. Принцип Ле-Шателье.
- •6. Роль растворов в жизнедеятельности организмов. Термодинамика растворения: энтропийный и энтальпийный факторы растворения, их связь с механизмом растворения.
- •7. Растворимость газов в жидкостях. Законы Дальтона, Генри, Сеченова. Растворимость газов в крови.
- •Роль диффузии в процессах переноса веществ в биологических системах
- •8. Слабые электролиты. Константа и степень диссоциации. Закон разведения Оствальда.
- •9. Основные положения теории сильных электролитов. Активность и коэффициент активности. Ионная сила раствора. Электролиты в организме человека.
- •10. Коллигативные свойства растворов. Закон Рауля. Осмос и осмотическое давление. Закон Вант-Гоффа.
- •Температура кипения разбавленных растворов
- •Криоскопическая и эбулиоскопическая константы
- •Осмос. Осмотическое давление разбавленных растворов
- •11. Коллигативные свойства растворов электролитов. Изотонический коэффициент, его физический смысл. Гипо-, гипер- и изотонические растворы. Роль осмоса в биосистемах. Плазмолиз и гемолиз.
- •12. Ионное произведение воды. Водородный показатель рН.
- •13. Буферные системы, их классификация и механизм действия. Уравнение Гендерсона-Гассельбаха. Буферная емкость.
- •I и II типы буферных систем
- •14. Буферные системы крови и сравнительная величина их буферной емкости. Понятие о кислотно-щелочном равновесии.
- •Кислотно-щелочное состояние.
- •15. Комплексные соединения, их изомерия, классификация и номенклатура.
- •1)По заряду комплекса: катионные, анионные и нейтральные комплексы.
- •2)По количеству комплексообразователей
- •3)По типу лиганда
- •4)По химическим свойствам: кислоты, основания, соли, неэлектролиты:
- •5)По количеству мест, занимаемых лигандом в координационной сфере
- •17. Предмет и методы химической кинетики. Скорость и константа скорости химической реакции. Закон действующих масс. Зависимость скорости реакции от температуры.
- •18. Простые и сложные реакции. Виды сложных реакций. Цепные фотохимические реакции. Роль фотохимических реакций в биологии и медицине.
- •19. Молекулярность и порядок химической реакции. Кинетические уравнения для реакции 0- и 1-го порядка. Энергия активации. Уравнение Аррениуса и энергетическая диаграмма реакции.
- •20. Основные положение теории активных соударений и теории переходного комплекса.
- •21. Гомогенный и гетерогенный катализ. Кислотно-основный катализ и роль в процессах метаболизма. Стадии гетерогенного катализа.
- •22. Ферментативный катализ.
- •23. Электродные потенциалы и механизм их возникновения. Строение двойного электрического слоя.
- •24. Уравнение Нернста для электродного потенциала и гальванического элемента.
- •25. Гальванический элемент Даниэля-Якоби. Принцип действия, эдс.
- •26. Классификация электродов. Электроды сравнения и определения. Водородный, хлорсеребряный и ионоселективные (стеклянные) электроды. Принцип их действия и электродные реакции.
- •27. Окислительно-восстановительный потенциал. Уравнение Нернста-Петерса.
- •28. Диффузный и мембранный потенциалы. Механизм действия и их роль в генерации биопотенциалов в организме.
- •29. Потенциометрия. Сущность метода и области применения в химических и медико-биологических исследованиях.
- •30. Вольтамперометрия (полярография), сущность метода и области применения в медико-биологических исследованиях.
- •31. Электропроводность растворов. Скорость движения ионов. Закон Кольрауша. Удельная и эквивалентная электропроводность.
- •32. Кондуктометрия, основные положения и область применения. Электропроводность тканей, применение в физиотерапии.
- •Органическая химия
- •33. Теория строения органических соединений а.М. Бутлерова.
- •34. Электронное строение атома углерода и виды гибридизации.
- •35. Классификация и номенклатура органических соединений.
2. Первое начало термодинамики. Внутренняя энергия. Энтальпия. Закон Гесса и термохимические расчеты.
Первое начало термодинамики представляет собой закон сохранения энергии.
Постулаты первого закона термодинамики:
1.Энергия неуничтожаема и несотворяема; она может только переходить из одной формы в другую в эквивалентных соотношениях.
2. Полная энергия изолированной системы постоянна.
3. Невозможен вечный двигатель первого рода (двигатель, совершающий работу без затраты энергии).
Согласно I закону термодинамики:
Изменение внутренней энергии системы U равно сумме количества теплоты Q, переданного системе, и работы А, совершенной внешними телами над системой:
U Q A,
С другой стороны, количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы А’ над внешними телами:
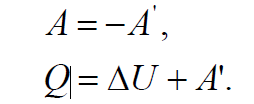
Внутренняя энергия системы U – полная энергия системы, состоящая из кинетической энергии и потенциальной энергии всех частиц системы как целого. Определить можно лишь изменение внутренней энергии U U2 U1 (U2 и U1 внутренняя энергия системы в конечном (2) и начальном (1) состоянии соответственно).
Работа А – сумма всех видов работы внешних сил, действующих на систему со стороны среды:
A pV p (V2 V1)
следовательно, при постоянном давлении:
![]()
Функция U + p *V = H называется энтальпией.
Непосредственно энтальпию измерить нельзя, можно измерить только изменение энтальпии в результате протекания процесса Н:
H = H2 (конечное состояние)- Н1 (начальное состояние).
Стандартное изменение энтальпии – это изменение энтальпии для процесса, в котором исходные вещества и продукты находятся в стандартном состоянии.
Стандартные условия:
давление – 760 мм рт. ст.= 101325 Па = 1 атм,
температура – 298 К ≈ 25 °С.
Химические уравнения реакции, для которых указано значение энтальпии реакции, называют термохимическими уравнениями.Например:
![]()
В термодинамических расчетах для оценки энергетического состояния веществ используют понятие стандартных энтальпий образования этих веществ.
Стандартная энтальпия образования простых веществ (ΔН°298) при стандартных условиях принимается равной 0.
Стандартная энтальпия образования сложного вещества (ΔН°298) ‒ теплота, которая поглощается или выделяется при образовании 1 моль химического соединения из простых веществ при заданных условиях, ΔН°298, (кДж/моль).
Числовые значения стандартных энтальпий образования являются справочными величинами.
Важнейшим постулатом термохимии является закон Гесса, или закон постоянства сумм тепловых эффектов реакций, установленный русским химиком Германом Ивановичем Гессом.
Тепловой эффект химической реакции зависит только от природы и состояния исходных веществ и конечных продуктов реакции и не зависит от пути реализации процесса, то есть от пути перехода от начального состояния к конечному.
Наглядное представление «треугольника Гесса»:
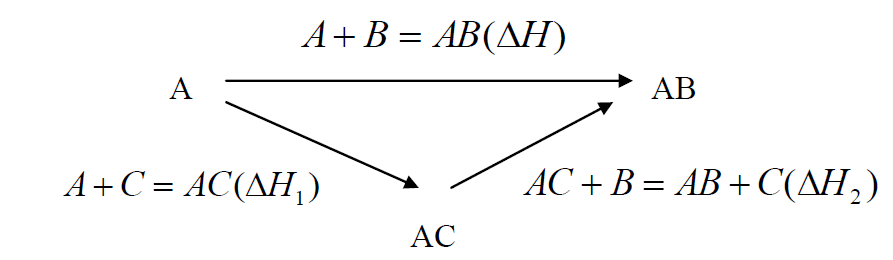
Образование соединения АВ представлено двумя путями: непосредственным синтезом из компонентов (ΔН) или через стадию образования промежуточного соединения АС (ΔН1), которое, реагируя с В, (ΔН2) дает тот же конечный продукт. В соответствии с законом Гесса тепловой эффект прямого синтеза АВ равен сумме тепловых эффектов реакций с участием
промежуточного продукта АС, то есть: ΔH = ΔН1 + ΔН2
Тепловой эффект – количество теплоты, выделившееся или поглощенное химической системой при протекании в ней химической реакции.
Тепловой эффект обозначается символами Q или ΔH (Q = –ΔH).
Для экзотермической реакции (теплота выделяется): Qp>0, ΔН<0.
Для эндотермическойреакции (теплота поглощается): Qp<0, ΔН>0.
Практическое значение закона Гесса состоит в том, что он позволяет рассчитывать тепловые эффекты химических процессов. В термохимических расчетах обычно используют ряд следствий из закона Гесса.
1) Энтальпия реакции образования равна разности алгебраической суммы энтальпий образования всех продуктов реакции и алгебраической суммы энтальпий образования всех исходных веществ:
![]()
где ΔН°f,прод, ΔН°f,исх – значения стандартной энтальпии образования продуктов реакции и исходных веществ, νj, νi – соответствующие продуктам и реагентам стехиометрические коэффициенты в уравнении химической реакции.
Здесь индекс f означает formation (образование), а знак «0» в верхнем индексе указывает, что величина относится к стандартному состоянию вещества: один моль индивидуального химического соединения, взятого в чистом виде при стандартных условиях в том агрегатном состоянии, которое устойчиво в этих условиях.
2) Энтальпия реакции сгорания равна разности алгебраической суммы теплот сгорания исходных веществ и алгебраической суммы теплот сгорания продуктов реакции:
![]() где
ΔН°сг,исх, ΔН°сг,прод – теплоты сгорания
исходных веществ и продуктов реакции,
νi,νj – соответствующие реагентам и
продуктам стехиометрические коэффициенты
в уравнении химической реакции. Причем
следует учесть, что теплота сгорания
высших оксидов (например, Н2О, СО2)
принимается равной нулю.
где
ΔН°сг,исх, ΔН°сг,прод – теплоты сгорания
исходных веществ и продуктов реакции,
νi,νj – соответствующие реагентам и
продуктам стехиометрические коэффициенты
в уравнении химической реакции. Причем
следует учесть, что теплота сгорания
высших оксидов (например, Н2О, СО2)
принимается равной нулю.
