
- •1. Предметы и методы химической термодинамики. Термодинамические системы, параметры, функции.
- •2. Первое начало термодинамики. Внутренняя энергия. Энтальпия. Закон Гесса и термохимические расчеты.
- •3. Второе начало термодинамики. Энтропия. Энергия Гиббса.
- •4. Химический потенциал. Термодинамические условия равновесия, прогнозирование направления самопроизвольных процессов. Энтальпийный и энтропийный факторы.
- •Внутренняя энергия
- •Энтальпия
- •Энергия Гельмгольца
- •Энергия Гиббса
- •5. Обратимые и необратимые по направлению реакции. Понятие о химическом равновесии. Константа химического равновесия и способы ее выражения. Принцип Ле-Шателье.
- •6. Роль растворов в жизнедеятельности организмов. Термодинамика растворения: энтропийный и энтальпийный факторы растворения, их связь с механизмом растворения.
- •7. Растворимость газов в жидкостях. Законы Дальтона, Генри, Сеченова. Растворимость газов в крови.
- •Роль диффузии в процессах переноса веществ в биологических системах
- •8. Слабые электролиты. Константа и степень диссоциации. Закон разведения Оствальда.
- •9. Основные положения теории сильных электролитов. Активность и коэффициент активности. Ионная сила раствора. Электролиты в организме человека.
- •10. Коллигативные свойства растворов. Закон Рауля. Осмос и осмотическое давление. Закон Вант-Гоффа.
- •Температура кипения разбавленных растворов
- •Криоскопическая и эбулиоскопическая константы
- •Осмос. Осмотическое давление разбавленных растворов
- •11. Коллигативные свойства растворов электролитов. Изотонический коэффициент, его физический смысл. Гипо-, гипер- и изотонические растворы. Роль осмоса в биосистемах. Плазмолиз и гемолиз.
- •12. Ионное произведение воды. Водородный показатель рН.
- •13. Буферные системы, их классификация и механизм действия. Уравнение Гендерсона-Гассельбаха. Буферная емкость.
- •I и II типы буферных систем
- •14. Буферные системы крови и сравнительная величина их буферной емкости. Понятие о кислотно-щелочном равновесии.
- •Кислотно-щелочное состояние.
- •15. Комплексные соединения, их изомерия, классификация и номенклатура.
- •1)По заряду комплекса: катионные, анионные и нейтральные комплексы.
- •2)По количеству комплексообразователей
- •3)По типу лиганда
- •4)По химическим свойствам: кислоты, основания, соли, неэлектролиты:
- •5)По количеству мест, занимаемых лигандом в координационной сфере
- •17. Предмет и методы химической кинетики. Скорость и константа скорости химической реакции. Закон действующих масс. Зависимость скорости реакции от температуры.
- •18. Простые и сложные реакции. Виды сложных реакций. Цепные фотохимические реакции. Роль фотохимических реакций в биологии и медицине.
- •19. Молекулярность и порядок химической реакции. Кинетические уравнения для реакции 0- и 1-го порядка. Энергия активации. Уравнение Аррениуса и энергетическая диаграмма реакции.
- •20. Основные положение теории активных соударений и теории переходного комплекса.
- •21. Гомогенный и гетерогенный катализ. Кислотно-основный катализ и роль в процессах метаболизма. Стадии гетерогенного катализа.
- •22. Ферментативный катализ.
- •23. Электродные потенциалы и механизм их возникновения. Строение двойного электрического слоя.
- •24. Уравнение Нернста для электродного потенциала и гальванического элемента.
- •25. Гальванический элемент Даниэля-Якоби. Принцип действия, эдс.
- •26. Классификация электродов. Электроды сравнения и определения. Водородный, хлорсеребряный и ионоселективные (стеклянные) электроды. Принцип их действия и электродные реакции.
- •27. Окислительно-восстановительный потенциал. Уравнение Нернста-Петерса.
- •28. Диффузный и мембранный потенциалы. Механизм действия и их роль в генерации биопотенциалов в организме.
- •29. Потенциометрия. Сущность метода и области применения в химических и медико-биологических исследованиях.
- •30. Вольтамперометрия (полярография), сущность метода и области применения в медико-биологических исследованиях.
- •31. Электропроводность растворов. Скорость движения ионов. Закон Кольрауша. Удельная и эквивалентная электропроводность.
- •32. Кондуктометрия, основные положения и область применения. Электропроводность тканей, применение в физиотерапии.
- •Органическая химия
- •33. Теория строения органических соединений а.М. Бутлерова.
- •34. Электронное строение атома углерода и виды гибридизации.
- •35. Классификация и номенклатура органических соединений.
8. Слабые электролиты. Константа и степень диссоциации. Закон разведения Оствальда.
Константа
диссоциации —
вид константы
равновесия,
которая показывает склонность большого
объекта диссоциировать (разделяться)
обратимым образом на маленькие объекты,
как например, когда комплекс распадается
на составляющие молекулы,
или когда соль разделяется
в водном растворе на ионы.
Константа диссоциации обычно
обозначается ![]() и
обратна константе
ассоциации.
В случае с солями, константу диссоциации
иногда называют константой
ионизации.
и
обратна константе
ассоциации.
В случае с солями, константу диссоциации
иногда называют константой
ионизации.
В общей реакции
![]()
где
комплекс ![]() разбивается
на x единиц
A и y единиц
B, константа диссоциации определяется
так:
разбивается
на x единиц
A и y единиц
B, константа диссоциации определяется
так:
![]()
где [A], [B] и [AxBy] — концентрации A, B и комплекса AxBy соответственно.
Исходя из определения степени диссоциации, для электролита КА в реакции диссоциации [A−] = [K+] = α·c, [KA] = c — α·c = c·(1 — α), где α — степени диссоциации электролита.
Тогда:
![]()
Это выражение называют законом разбавления Оствальда. При очень малых α (α<<1) K=cα² и
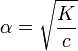 ,
,
таким образом, при увеличении концентрации электролита степень диссоциации уменьшается, при уменьшении — возрастает. Подробнее связь константы диссоциации и степени диссоциации описана в статье.
Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных (однородных) системах.
"Степень диссоциации это есть отношения числа продиссоциируемых молекул к общему числу молекул и умноженному на 100%":
![]()
числа распавшихся на ионымолекулк общему числу растворенных молекул.
Степень
диссоциации ![]() равна
отношению числа диссоциированных
молекул
равна
отношению числа диссоциированных
молекул![]() к
сумме
к
сумме![]() ,
где
,
где![]() —
число недиссоциированных молекул.
Часто
выражают
в процентах. Степень диссоциации зависит
как от природы растворённого электролита,
так и от концентрации раствора.
—
число недиссоциированных молекул.
Часто
выражают
в процентах. Степень диссоциации зависит
как от природы растворённого электролита,
так и от концентрации раствора.
Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:
![]()
Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием закона действующих масс и равенства
![]()
где α — степень диссоциации.
Закон разбавления Оствальда выведен В.Оствальдом в 1888 и им же подтвержден опытным путём. Экспериментальное установление правильности закона разбавления Оствальда имело большое значение для обоснования теории электролитической диссоциации.
Ступенчатая диссоциция аобусловливает возможность образования кислых и основных солей.
Ступенчатая диссоциация сильных кислот не оказывает влияния на характер кривых титрования, которые имеют такой же вид, как и кривые одноосновных кислот. Так, на кривых титрования НС1 и H2SO4 наблюдается только одна точка эквивалентности.
Соответственно ступенчатой диссоциации двух - и многоосновных кислот нейтрализация их протекает также по ступеням.
Подобно ступенчатой диссоциации электролитов, первые ступени сольватационного равновесия и отвечающего ему кислотно-основного равновесия более резко выражены, чем последующие.
Ступенчатой диссоциацией кислот объясняется образование кислых солей.
Их ступенчатая диссоциация обусловливает образование кислых и основных солей.
Продукты ступенчатой диссоциации следует рассматривать как комплексы. В растворе эти комплексы координационно насыщены за счет присоединения к центральному атому молекул растворителя.
Продукты ступенчатой диссоциации координационно-насыщенных по данному лиганду соединений как комплексы были рассмотрены А. К. Бабко и Силленом.
При ступенчатой диссоциации каждая ступень имеет свою константу электролитической диссоциации
При ступенчатой диссоциации электролитов каждая ступень характеризуется своей константой диссоциации. Так как константы диссоциации последующих ступеней очень малы сравнительно с константой диссоциации первой ступени, то обычно ведут расчет по константе диссоциации первой ступени.
Примером ступенчатой диссоциации основания, содержащего в молекуле более одной гидроксильной группы, может служить гидроокись кальция.
При ступенчатой диссоциации многоосновных кислот отщепление последующих ионов водорода затрудняется вследствие увеличения отрицательного заряда аниона и энергии связи иона водорода с анионом. Аналогичное явление наблюдается также при диссоциации солей.
При такой ступенчатой диссоциации наиболее далеко идет в случае слабых электролитов обычно диссоциация в первой ступени. Каждой ступени отвечает своя соль (например К3Р04; К2НР04)
В результате ступенчатой диссоциации в не слишком разбавленном растворе Н3РО4 содержится довольно много анионов Н2РО4, меньше НРО.
