
- •1.Общие вопросы
- •1.Цикл Кребса, его биологическая роль
- •2.Метаболизм пвк в клетке.
- •3.Метаболизм Ацетил-Коа в клетке
- •2.Биохимия белков
- •4.Классификация белков. Характеристика важнейших представителей простых белков
- •5.Современное представление о биосинтезе белков и их регуляции.
- •6.Понятие о нативном и денатурированном белке. Виды денатурации, практическое использование
- •7.Физико-химические свойства белков.
- •8.Структура и функции сложных белков
- •9.Переваривание и всасывание белков в жкт. Судьба всосавшихся аминокислот
- •2.Механизм активации пепсина
- •1. Активация панкреатических ферментов
- •2. Специфичность действия протеаз
- •11. Синтез и биологическая роль креатинина
- •12. Окисление аминокислот в тканях. Прямое и непрямое дезаминирование
- •13. Аминокислоты как источники биологически активных веществ: гистамин, гамк, серотонин, адреналин
- •14.Гликолиз и его биологическая роль
- •17.Роль "ключевых" ферментов в углеводном обмене.
- •18. Регуляция концентрации глюкозы крови.
- •19.Пентозный путь окисления глюкозы и его биологическая роль.
- •20. Биохимические механизмы возникновения гипогликемий.
- •21.Глюконеогенез и его биологическая роль.
- •5. Фосфоенол пируват превращается в глюкозу
- •22. Синтез и распад гликогена.
- •23. Переваривание и всасывание углеводов в жкт.
- •28.Внутриклеточный липолиз.Окисление глицерина до co2 и h2o
- •29. Окисление жирных кислот в клетке.
- •30. Метаболизм кетоновых тел.
- •31) Перекисное окисление липидов (пол). Про- и антиоксидантные системы организма.
- •32) Уровни организации структуры ферментов. Мультиферментные системы.
- •33) Множественные формы ферментов. Изоферменты и их клинико-диагностическое значение.
- •34) Классификация и номенклатура ферментов. Единицы измерения ферментативной активности.
- •36) Регуляция активности ферментов.
- •37) Активаторы и ингибиторы ферментов.
- •39) Химическая природа и функциональные участки молекул ферментов.
- •40) Структура и биологическая роль днк и рнк.
- •41. Распад нуклеиновых кислот в тканях. Метаболизм мочевой кислоты.
- •42. Пути биосинтеза пуриновых и пиримидиновых оснований.
- •43. Современное представление о биологическом окислении. Типы биологического окисления.
- •44. Микросомальное окисление.
- •45.Окислительное фосфорилирование. Теория сопряжения. Влияние ядов на тканевое дыхание и окислительное фосфорилирование
- •46. Оксидазный путь биологического окисления. Субстраты, ферменты и коферменты биологического окисления.
- •47. Строение хромопртеинов .Важнейшие представители и их био. Роль.
- •49.Распад гемоглобина. Основные продукты распада, место их образования и пути выведения.
- •9. Биохимия витаминов.
- •51. Классификация витаминов, общие свойства .Суточная потребность и групповая характристика витаминов.
- •53. Строение, функции и биологическая роль витамина d в организме .Гипо-и гипервитаминоз.
- •54. Структура, функции и биологическая роль витамина к.Понятие об антивитаминах.
- •55. Витамины ,фолиевая кислота и никотиновая кислота, химическая природа , коферментные функции ,влияние на обмен веществ , пищевые источники.
- •56. Структура, коферментные функции и биологическая роль антидерматитных витаминов в6,н,пантотеновой кислоты.
- •Биохимия гормонов и биологически активных веществ
- •57.Роль посредников в гормональной регуляции обмена веществ.
- •1.Передача гормональных сигналов через мембранные рецепторы
- •2. Передача сигналов через внутриклеточные рецепторы
- •3.Передача сигналов через рецепторы, сопряжённые с ионными каналами
- •58.Гормоны гипоталамуса и гипофиза, их строение и механизм действия.
- •2. Кортиколиберин
- •3. Гонадолиберин
- •4. Соматолиберин
- •5.Соматостатин
- •1. Гормон роста, пролактин
- •2.Тиреотропин, лютеинизирующий гормон и фолликулостимулирующий гормон
- •3.Группа гормонов,образующихся из проопиомеланокортина
- •4. Гормоны задней доли гипофиза
- •59. Гормоны коркового вещества надпочечников.
- •1. Синтез и секреция катехоламинов
- •2. Механизм действия и биологическая роль катехоламинов
- •3. Патология мозгового вещества надпочечников
- •2. Биологические функции инсулина
- •3. Механизм действия инсулина
- •2. Передача сигналов через внутриклеточные рецепторы
- •1. Регуляция секреции фсг и лг
- •2. Механизм действия и эффекты фсг и лг
- •1. Синтез андрогенов
- •2. Регуляция синтеза и секреции андрогенов
- •3. Мишени для андрогенов
- •4. Эффекты андрогенов
- •1. Образование эстрогенов
- •2.Регуляция секреции эстрогенов
- •3.Механизм действия и биологические эффекты эстрогенов
- •4. Образование прогестерона
- •5. Биологические эффекты прогестерона
- •64. Современные представления о механизме действия гормонов белковой природы.
- •65.Метаболизм арахидоновой кислоты:простагландины,тромбоксаны,простациклины,лейкотриены.
- •66.Гормоны щитовидной железы и их влияние на обмен веществ.
- •1. Биосинтез йодтиронинов
- •2. Регуляция синтеза и секреции йодтиронинов
- •3. Механизм действия и биологические функции йодтиронинов
- •4. Заболевания щитовидной железы
- •67. Роль цикла трикарбоновых кислот во взаимосвязи обмена белков, липидов, углеводов.
- •69. Роль важнейших макроэргических соединений в обмене веществ.
- •70. Дыхательная функция крови. Основные типы гипоксий.
- •72. Нарушения кислотно-основного состояния и клинико-биохимические показатели кос.
- •73. Роль почек и легких в поддержании кислотно-основного равновесия.
- •74. Электролитный состав плазмы крови.
- •88. Обезвреживающая функция печень. Механизмы конъюгации.
- •89. Тесты лабораторной диагностики при заболеваниях печени
- •90.Белки соединительной ткани: строение,биологическая роль.Особенности метаболизма соединительной ткани.
- •91.Особенности состава и метаболизма нервной ткани.Роль медиаторов в возникновении и проведении нервных импульсов.
- •3.Синтез гормонов(эритропоэтин,кальцитриол)
- •95.Сосудисто-тромбоцитарный гемостаз,компоненты и их функции.
- •96.Плазменно-коагуляционный гемостаз .Компоненты и их функции.
- •97.Система антикоагулянтов. Основные эндогенные антикоагулянты и их функции.
- •98.Система фибринолиза .Компоненты и их функции в системе гемостаза
70. Дыхательная функция крови. Основные типы гипоксий.
Перенос кислорода кровью
Сущность
дыхательной функции крови состоит в
доставке кислорода от легких к тканям
и углекислого газа от тканей к легким
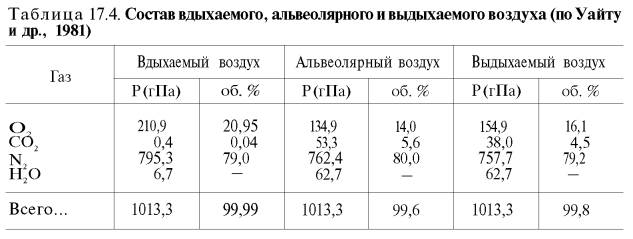
(табл. 17.4).
Кровь
осуществляет дыхательную функцию прежде
всего благодаря наличию в ней гемоглобина.
Физиологическая функция гемоглобина
как переносчика кислорода основана на
способности обратимо связывать кислород.
Поэтому в легочных капиллярах происходит
насыщение крови кислородом, а в тканевых
капиллярах, где парциальное давление
кислорода резко снижено, осуществляется
отдача кислорода тканям.
 В состоянии покоя ткани и органы человека
потребляют около 200 мл кислорода в
минуту. При тяжелой физической работе
количество потребляемого тканями
кислорода возрастает в 10 раз и более
(до 2–3 л/мин). Доставка от легких к тканям
такого количества кислорода в виде
газа, физически растворенного в плазме,
невозможна вследствие малой растворимости
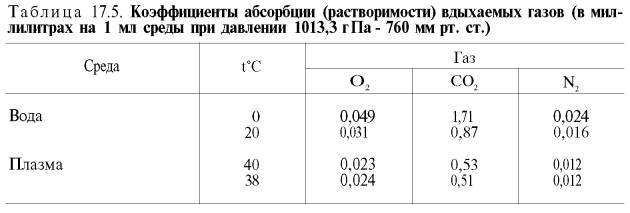
кислорода в воде и плазме крови (табл.
17.5).
В состоянии покоя ткани и органы человека
потребляют около 200 мл кислорода в
минуту. При тяжелой физической работе
количество потребляемого тканями
кислорода возрастает в 10 раз и более
(до 2–3 л/мин). Доставка от легких к тканям
такого количества кислорода в виде
газа, физически растворенного в плазме,
невозможна вследствие малой растворимости
кислорода в воде и плазме крови (табл.
17.5).
 Итак, функцию переносчика кислорода в
организме выполняет гемоглобин. Напомним,
что молекула гемоглобина построена из
4 субъединиц (полипептидных цепей),
каждая из которых связана с гемом (см.
главу 2). Следовательно, молекула
гемоглобина имеет 4 гема, к которым может
присоединяться кислород, при этом
гемоглобин переходит в оксигемо-глобин.
Итак, функцию переносчика кислорода в
организме выполняет гемоглобин. Напомним,
что молекула гемоглобина построена из
4 субъединиц (полипептидных цепей),
каждая из которых связана с гемом (см.
главу 2). Следовательно, молекула
гемоглобина имеет 4 гема, к которым может
присоединяться кислород, при этом
гемоглобин переходит в оксигемо-глобин.
Гемоглобин человека содержит 0,335% железа. Каждый грамм-атом железа (55,84 г) в составе гемоглобина при полном насыщении кислородом связывает 1 грамм-молекулу кислорода (22400 мл). Таким образом, 100 г гемоглобина могут связывать, а каждый грамм гемоглобина – 1,34 мл кислорода. Содержание гемоглобина в крови здорового человека составляет 13–16%, т.е. в 100 мл крови 13–16 г гемоглобина. При РО2 в артериальной крови 107–120 гПа гемоглобин насыщен кислородом на 96%. Следовательно, в этих условиях 100 мл крови содержит 19–20 об. % кислорода
Возрастание
интенсивности окислительных процессов
в тканях, например при усиленной мышечной
работе всегда связано с более полным
извлечением кислорода из крови. Кроме
того, при физической работе резко
увеличивается скорость кровотока.
Зависимость между степенью насыщения
гемоглобина кислородом и РО2, можно
выразить в виде кривой насыщения
гемоглобина кислородом, или кривой
диссоциации оксигемоглобина, которая
имеет S-образную форму и характеризует
сродство гемоглобина к кислороду (рис.
17.6).
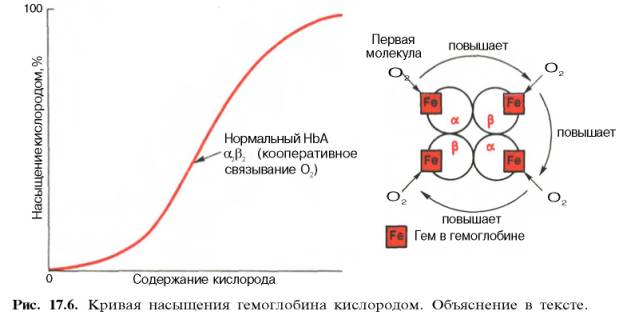 Характерная для гемоглобина S-образная
кривая насыщения кислородом свидетельствует,
что связывание первой молекулы кислорода
одним из гемов гемоглобина облегчает
связывание последующих молекул кислорода
тремя другими оставшимися гемами. Долгое
время механизм, лежащий в основе этого
эффекта, оставался загадкой, так как,
по данным рентгено-структурного анализа,
4 гема в молекуле гемоглобина довольно
далеко отстоят друг от друга и вряд ли
могут оказывать взаимное влияние. В
последнее время принято следующее
объяснение происхождения S-образ-ной
кривой. Считают, что тетрамерная молекула
гемоглобина способна обратимо распадаться
на две половинки, каждая из которых
содержит одну α-цепь и одну β-цепь:
Характерная для гемоглобина S-образная
кривая насыщения кислородом свидетельствует,
что связывание первой молекулы кислорода
одним из гемов гемоглобина облегчает
связывание последующих молекул кислорода
тремя другими оставшимися гемами. Долгое
время механизм, лежащий в основе этого
эффекта, оставался загадкой, так как,
по данным рентгено-структурного анализа,
4 гема в молекуле гемоглобина довольно
далеко отстоят друг от друга и вряд ли
могут оказывать взаимное влияние. В
последнее время принято следующее
объяснение происхождения S-образ-ной
кривой. Считают, что тетрамерная молекула
гемоглобина способна обратимо распадаться
на две половинки, каждая из которых
содержит одну α-цепь и одну β-цепь:
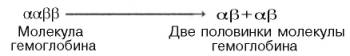
При взаимодействии молекулы кислорода с одним из четырех гемов гемоглобина кислород присоединяется к одной из половинок молекулы гемоглобина (допустим, к α-цепи этой половинки). Как только такое присоединение произойдет, α-полипептидная цепь претерпевает конформа-ционные изменения, которые передаются на тесно связанную с ней β-цепь; последняя также подвергается конформационным сдвигам. β-Цепь присоединяет кислород, имея уже большее сродство к нему. Таким путем связывание одной молекулы кислорода благоприятствует связыванию второй молекулы (так называемое кооперативное взаимодействие). После насыщения кислородом одной половины молекулы гемоглобина возникает новое, внутреннее, напряженное состояние молекулы гемоглобина, которое вынуждает и вторую половину гемоглобина изменить конформацию. Теперь еще две молекулы кислорода, по-видимому, по очереди связываются со второй половинкой молекулы гемоглобина, образуя оксигемоглобин.
S-образная форма кривой насыщения гемоглобина кислородом имеет большое физиологическое значение. При такой форме кривой обеспечивается возможность насыщения крови кислородом при изменении РО2 в довольно широких пределах. Например, дыхательная функция крови существенно не нарушается при снижении РО2 в альвеолярном воздухе со 133,3 до 80–93,3 гПа. Поэтому подъем на высоту до 3,0–3,5 км над уровнем моря не сопровождается развитием выраженной гипоксемии.
Численно сродство гемоглобина к кислороду принято выражать величиной Р50 – парциальное напряжение кислорода, при котором 50% гемоглобина связано с кислородом (рН 7,4 температура 37°С). Нормальная величина Р50 около 34,67 гПа (см. рис. 17.6). Смещение кривой насыщения гемоглобина кислородом вправо означает уменьшение способности гемоглобина связывать кислород и, следовательно, сопровождается повышением Р50. Напротив, смещение кривой влево свидетельствует о повышенном сродстве гемоглобина к кислороду, величина Р50 снижена.
Ход кривой насыщения гемоглобина кислородом или диссоциации оксигемоглобина зависит от ряда факторов. Сродство гемоглобина к кислороду в первую очередь связано с рН. Чем ниже рН, тем меньше способность гемоглобина связывать кислород и тем выше Р50. В тканевых капиллярах рН ниже (поступает большое количество СО2), в связи с чем гемоглобин легко отдает кислород. В легких СО2 выделяется, рН повышается и гемоглобин активно присоединяет кислород. Способность гемоглобина связывать кислород зависит также от температуры. Чем выше температура (в тканях температура выше, чем в легких), тем меньше сродство гемоглобина к кислороду. Напротив, снижение температуры вызывает обратные явления.
Количество гемоглобина в крови, а также в какой-то мере его способность связывать кислород (характер кривой диссоциации оксигемоглобина) несколько меняются с возрастом. Например, у новорожденных содержание гемоглобина доходит до 20–21% (вместо обычных для взрослого 13–16%). У человека имеется несколько гемоглобинов, которые образуются в различном количестве в разные стадии онтогенеза и различаются по своему сродству к кислороду.
Перенос углекислого газа кровью от тканей к легким
Организм располагает несколькими механизмами переноса СО2 от тканей к легким. Часть его переносится в физически растворенном виде. Растворимость СО2 в плазме крови в 40 раз превышает растворимость в ней кислорода, тем не менее при небольшой артериовенозной разнице РСО2 (напряжение СО2 в венозной крови, притекающей к легким по легочной артерии, равно 60 гПа, а в артериальной крови – 53,3 гПа) в физически растворенном виде может быть перенесено в покое 12–15 мл СО2, что составляет 6–7% от всего количества переносимого углекислого газа.
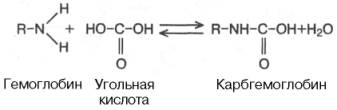
Некоторое
количество СО2 может переноситься в
виде карбаминовой формы. Оказалось, что
СО2 может присоединяться к гемоглобину
посредством карбаминовой связи, образуя
карбгемоглобин, или карбаминогемо-глобин
(впервые мысль о наличии углекислого
газа, непосредственно связанного с
гемоглобином, была высказана И.М.
Сеченовым):
Или
![]()
Карбгемоглобин
– соединение очень нестойкое и чрезвычайно
быстро диссоциирует в легочных капиллярах
с отщеплением СО2.
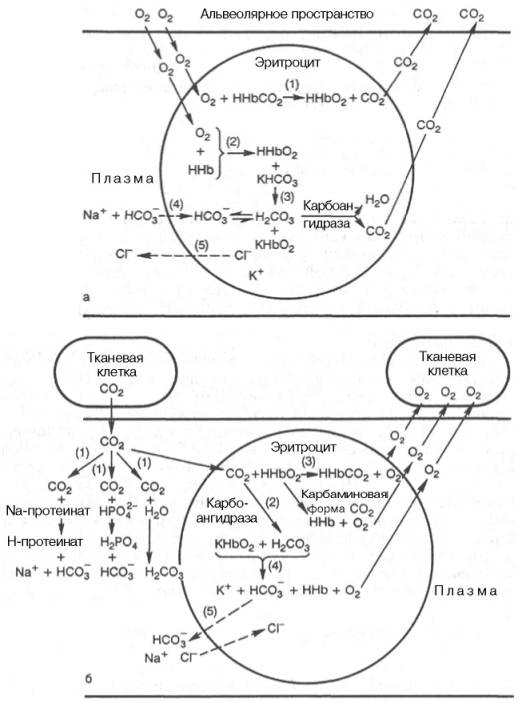
В легочных капиллярах, в эритроцитах, происходит процесс вытеснения угольной кислоты из бикарбоната калия оксигемоглобином: ННbO2 + К+ + НCO3–—> КНbO2 + Н2СO3. Образующаяся угольная кислота быстро расщепляется при участии карбоангидразы на углекислый газ и воду. Низкое РCO2 в просвете альвеол способствует диффузии углекислого газа из эритроцитов в легкие. По мере снижения в эритроцитах концентрации бикарбоната из плазмы крови в них поступают новые порции ионов НСО3–, а в плазму выходит эквивалентное количество ионов Сl–. Концентрация бикарбоната натрия в плазме крови в легочных капиллярах быстро падает, но одновременно в плазме повышается концентрация хлорида натрия, а в эритроцитах свободный гемоглобин превращается в калийную соль оксигемо-глобина. Итак, в форме бикарбоната при участии гемоглобина эритроцитов транспортируется с кровью к легким более 80% от всего количества углекислого газа.
Различные формы гипоксии
Гипоксия (кислородное голодание) – состояние, возникающее при недостаточном снабжении тканей организма кислородом или нарушении его утилизации в процессе биологического окисления. Согласно классификации, предложенной И.Р. Петровым, гипоксии делятся на 2 группы:
1. Гипоксия вследствие понижения РО2 во вдыхаемом воздухе (экзогенная гипоксия).
2. Гипоксия при патологических процессах, нарушающих снабжение тканей кислородом при нормальном содержании его в окружающей среде. Сюда относятся следующие типы: а) дыхательный (легочный); б) сердечнососудистый (циркуляторный); в) кровяной (гемический); г) тканевый (гис-тотоксический); д) смешанный.
Гипоксия вследствие понижения парциального давления кислорода во вдыхаемом воздухе. Этот вид гипоксии возникает главным образом при подъеме на высоту. Может наблюдаться и в тех случаях, когда общее барометрическое давление нормальное, но РО2 понижено: например, при аварии в шахтах, неполадках в системе кислородообеспечения кабины летательного аппарата, в подводных лодках и т.п., а также во время операций при неисправности наркозной аппаратуры. При экзогенной гипоксии развивается гипоксемия, т.е. уменьшается РО2 в артериальной крови и снижается насыщение гемоглобина кислородом.
Гипоксия при патологических процессах, нарушающих снабжение или утилизацию кислорода тканями. Дыхательный (легочный) тип гипоксии возникает в связи с альвеолярной гипервентиляцией, что может быть обусловлено нарушением проходимости дыхательных путей (воспалительный процесс, инородные тела, спазм), уменьшением дыхательной поверхности легких (отек легкого, пневмония и т.д.). В подобных случаях снижаются РО2 в альвеолярном воздухе и напряжение кислорода в крови, в результате чего уменьшается насыщение гемоглобина кислородом. Обычно нарушается также выведение из организма углекислого газа, и к гипоксии присоединяется гиперкапния. Сердечно-сосудистый (циркуляторный) тип гипоксии наблюдается при нарушениях кровообращения, приводящих к недостаточному кровообращению органов и тканей. Для газового состава крови в типичных случаях циркуляторной гипоксии характерны нормальные напряжение и содержание кислорода в артериальной крови, снижение этих показателей в венозной крови и высокая артериовенозная разница по кислороду. Кровяной (гемический) тип гипоксии возникает в результате уменьшения кислородной емкости крови при анемиях, обусловленных значительным уменьшением эритроцитной массы или резким понижением содержания гемоглобина в эритроцитах. В этих случаях РО2 в венозной крови резко снижено. Гемическая гипоксия наблюдается также при отравлении оксидом углерода (образование карбоксигемоглобина) и метгемоглобинообразователя-ми (метгемоглобинемия), а также при некоторых генетически обусловленных аномалиях гемоглобина. При образовании карбоксигемоглобина и метгемоглобина напряжение кислорода в венозной крови и тканях оказывается значительно пониженным, одновременно уменьшается артериовеноз-ная разница содержания кислорода. Тканевый (гистотоксический) тип гипоксии обычно обусловлен нарушением способности тканей поглощать кислород из крови. Утилизация кислорода тканями может затрудняться в результате угнетения биологического окисления различными ингибиторами, нарушения синтеза ферментов или повреждения мембранных структур клетки. Типичным примером тканевой гипоксии может служить отравление цианидами. Попадая в организм, ионы CN–активно взаимодействуют с трехвалентным железом, тем самым блокируя конечный фермент дыхательной цепи – цитохромоксидазу, в результате чего подавляется потребление кислорода клетками. Иными словами, при гистотоксической гипоксии ткани не в состоянии извлекать кислород из тканевых капилляров даже при высоком РО2. 71. Буферные системы крови и их роль в поддержании кислотно-основного равновесия.
Установлено, что состоянию нормы соответствует определенный диапазон колебаний рН крови – от 7,37 до 7,44 со средней величиной 7,40 . Кровь представляет собой взвесь клеток в жидкой среде, поэтому ее кислотно-основное равновесие поддерживается совместным участием буферных систем плазмы и клеток крови. Важнейшими буферными системами крови являются бикарбонатная, фосфатная, белковая и наиболее мощная гемоглобиновая.
Бикарбонатная буферная система – мощная и, пожалуй, самая управляемая система внеклеточной жидкости и крови. На долю бикарбонатного буфера приходится около 10% всей буферной емкости крови. Бикарбонатная система представляет собой сопряженную кислотно-основную пару, состоящую из молекулы угольной кислоты Н2СО3, выполняющую роль донора протона, и бикарбонат-иона НСО3–, выполняющего роль акцептора протона:
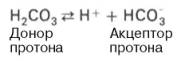
Для данной буферной системы величину рН в растворе можно выразить через константу диссоциации угольной кислоты (рКН2СО3) и логарифм концентрации недиссоциированных молекул Н2СО3 и ионов HCO3–:

Истинная концентрация недиссоциированных молекул Н2СО3 в крови незначительна и находится в прямой зависимости от концентрации растворенного углекислого газа (СО2 + Н2О <=> Н2СО3). Поэтому удобнее пользоваться тем вариантом уравнения, в котором рКH2СО3 заменена «кажущейся» константой диссоциации Н2СО3, учитывающей общую концентрацию растворенного СО2 в крови:
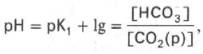
где K1– «кажущаяся» константа диссоциации Н2 С О3 ; [СО2(р)] – концентрация растворенного СО2.
При нормальном значении рН крови (7,4) концентрация ионов бикарбоната НСО3 в плазме крови превышает концентрацию СО2 примерно в 20 раз. Бикарбонатная буферная система функционирует как эффективный регулятор в области рН 7,4.
Механизм действия данной системы заключается в том, что при выделении в кровь относительно больших количеств кислых продуктов водородные ионы Н+ взаимодействуют с ионами бикарбоната НСО3–, что приводит к образованию слабодиссоциирующей угольной кислоты Н2СО3. Последующее снижение концентрации Н2СО3 достигается в результате ускоренного выделения СО2 через легкие в результате их гипервентиляции (напомним, что концентрация Н2СО3 в плазме крови определяется давлением СО2 в альвеолярной газовой смеси).
Если в крови увеличивается количество оснований, то они, взаимодействуя со слабой угольной кислотой, образуют ионы бикарбоната и воду. При этом не происходит сколько-нибудь заметных сдвигов в величине рН. Кроме того, для сохранения нормального соотношения между компонентами буферной системы в этом случае подключаются физиологические механизмы регуляции кислотно-основного равновесия: происходит задержка в плазме крови некоторого количества СО2 в результате гиповентиляции легких . Как будет показано далее, данная буферная система тесно связана с гемоглобиновой системой.
Фосфатная буферная система представляет собой сопряженную кислотно-основную пару, состоящую из иона Н2РО4– (донор протонов) и иона НРО42– (акцептор протонов):
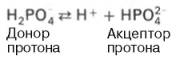
Роль кислоты в этой системе выполняет однозамещенный фосфат NaH2PO4, а роль соли двузамещенный фосфат – Na2HPO4.
Фосфатная буферная система составляет всего лишь 1% от буферной емкости крови. В других тканях эта система является одной из основных. Для фосфатной буферной системы справедливо следующее уравнение:
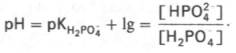
Во внеклеточной жидкости, в том числе в крови, соотношение [НРО42–]: [Н2РО4–] составляет 4:1. Величина рКН2РО4– равна 6,86.
Буферное действие фосфатной системы основано на возможности связывания водородных ионов ионами НРО42– с образованием Н2РО4– (Н+ + + НРО42– —> Н2РО4–), а также ионов ОН– с ионами Н2РО4– (ОН– + + Н2 Р О4– —> HPO42–+ H2O). Буферная пара (Н2РО4––НРО42–) способна оказывать влияние при изменениях рН в интервале от 6,1 до 7,7 и может обеспечивать определенную буферную емкость внутриклеточной жидкости, величина рН которой в пределах 6,9–7,4. В крови максимальная емкость фосфатного буфера проявляется вблизи значения рН 7,2. Фосфатный буфер в крови находится в тесном взаимодействии с бикарбонатной буферной системой. Органические фосфаты также обладают буферными свойствами, но мощность их слабее, чем неорганического фосфатного буфера.
Белковая буферная система имеет меньшее значение для поддержания КОР в плазме крови, чем другие буферные системы. Белки образуют буферную систему благодаря наличию кислотно-основных групп в молекуле белков: белок–Н+ (кислота, донор протонов) и белок (сопряженное основание, акцептор протонов). Белковая буферная система плазмы крови эффективна в области значений рН 7,2–7,4.
Гемоглобиновая буферная система – самая мощная буферная система крови. Она в 9 раз мощнее бикарбонатного буфера; на ее долю приходится 75% от всей буферной емкости крови.
Участие гемоглобина в регуляции рН крови связано с его ролью в транспорте кислорода и углекислого газа. Константа диссоциации кислотных групп гемоглобина меняется в зависимости от его насыщения кислородом. При насыщении кислородом гемоглобин становится более сильной кислотой (ННbО2). Гемоглобин, отдавая кислород, превращается в очень слабую органическую кислоту (ННb).
Итак, гемоглобиновая буферная система состоит из неионизированного гемоглобина ННb (слабая органическая кислота, донор протонов) и калиевой соли гемоглобина КНb (сопряженное основание, акцептор протонов). Точно так же может быть рассмотрена оксигемоглобиновая буферная система. Система гемоглобина и система оксигемоглобина являются вза-имопревращающимися системами и существуют как единое целое. Буферные свойства гемоглобина прежде всего обусловлены возможностью взаимодействия кисло реагирующих соединений с калиевой солью гемоглобина с образованием эквивалентного количества соответствующей калийной соли кислоты и свободного гемоглобина:
КНb + Н2СO3—> КНСO3 + ННb.
Именно таким образом превращение калийной соли гемоглобина эритроцитов в свободный ННb с образованием эквивалентного количества бикарбоната обеспечивает поддержание рН крови в пределах физиологически допустимых величин, несмотря на поступление в венозную кровь огромного количества углекислого газа и других кисло реагирующих продуктов обмена.
Гемоглобин (ННb), попадая в капилляры легких, превращается в окси-гемоглобин (ННbО2), что приводит к некоторому подкислению крови, вытеснению части Н2СО3 из бикарбонатов и понижению щелочного резерва крови . Перечисленные буферные системы крови играют важную роль в регуляции кислотно-основного равновесия. Как отмечалось, в этом процессе, помимо буферных систем крови, активное участие принимают также система дыхания и мочевыделительная система.
