
- •1.Общие вопросы
- •1.Цикл Кребса, его биологическая роль
- •2.Метаболизм пвк в клетке.
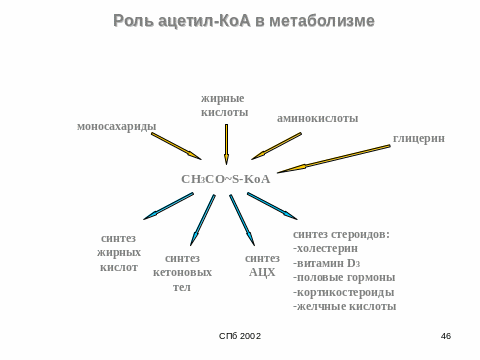
- •3.Метаболизм Ацетил-Коа в клетке
- •2.Биохимия белков
- •4.Классификация белков. Характеристика важнейших представителей простых белков
- •5.Современное представление о биосинтезе белков и их регуляции.
- •6.Понятие о нативном и денатурированном белке. Виды денатурации, практическое использование
- •7.Физико-химические свойства белков.
- •8.Структура и функции сложных белков
- •9.Переваривание и всасывание белков в жкт. Судьба всосавшихся аминокислот
- •2.Механизм активации пепсина
- •1. Активация панкреатических ферментов
- •2. Специфичность действия протеаз
- •11. Синтез и биологическая роль креатинина
- •12. Окисление аминокислот в тканях. Прямое и непрямое дезаминирование
- •13. Аминокислоты как источники биологически активных веществ: гистамин, гамк, серотонин, адреналин
- •14.Гликолиз и его биологическая роль
- •17.Роль "ключевых" ферментов в углеводном обмене.
- •18. Регуляция концентрации глюкозы крови.
- •19.Пентозный путь окисления глюкозы и его биологическая роль.
- •20. Биохимические механизмы возникновения гипогликемий.
- •21.Глюконеогенез и его биологическая роль.
- •5. Фосфоенол пируват превращается в глюкозу
- •22. Синтез и распад гликогена.
- •23. Переваривание и всасывание углеводов в жкт.
- •28.Внутриклеточный липолиз.Окисление глицерина до co2 и h2o
- •29. Окисление жирных кислот в клетке.
- •30. Метаболизм кетоновых тел.
- •31) Перекисное окисление липидов (пол). Про- и антиоксидантные системы организма.
- •32) Уровни организации структуры ферментов. Мультиферментные системы.
- •33) Множественные формы ферментов. Изоферменты и их клинико-диагностическое значение.
- •34) Классификация и номенклатура ферментов. Единицы измерения ферментативной активности.
- •36) Регуляция активности ферментов.
- •37) Активаторы и ингибиторы ферментов.
- •39) Химическая природа и функциональные участки молекул ферментов.
- •40) Структура и биологическая роль днк и рнк.
- •41. Распад нуклеиновых кислот в тканях. Метаболизм мочевой кислоты.
- •42. Пути биосинтеза пуриновых и пиримидиновых оснований.
- •43. Современное представление о биологическом окислении. Типы биологического окисления.
- •44. Микросомальное окисление.
- •45.Окислительное фосфорилирование. Теория сопряжения. Влияние ядов на тканевое дыхание и окислительное фосфорилирование
- •46. Оксидазный путь биологического окисления. Субстраты, ферменты и коферменты биологического окисления.
- •47. Строение хромопртеинов .Важнейшие представители и их био. Роль.
- •49.Распад гемоглобина. Основные продукты распада, место их образования и пути выведения.
- •9. Биохимия витаминов.
- •51. Классификация витаминов, общие свойства .Суточная потребность и групповая характристика витаминов.
- •53. Строение, функции и биологическая роль витамина d в организме .Гипо-и гипервитаминоз.
- •54. Структура, функции и биологическая роль витамина к.Понятие об антивитаминах.
- •55. Витамины ,фолиевая кислота и никотиновая кислота, химическая природа , коферментные функции ,влияние на обмен веществ , пищевые источники.
- •56. Структура, коферментные функции и биологическая роль антидерматитных витаминов в6,н,пантотеновой кислоты.
- •Биохимия гормонов и биологически активных веществ
- •57.Роль посредников в гормональной регуляции обмена веществ.
- •1.Передача гормональных сигналов через мембранные рецепторы
- •2. Передача сигналов через внутриклеточные рецепторы
- •3.Передача сигналов через рецепторы, сопряжённые с ионными каналами
- •58.Гормоны гипоталамуса и гипофиза, их строение и механизм действия.
- •2. Кортиколиберин
- •3. Гонадолиберин
- •4. Соматолиберин
- •5.Соматостатин
- •1. Гормон роста, пролактин
- •2.Тиреотропин, лютеинизирующий гормон и фолликулостимулирующий гормон
- •3.Группа гормонов,образующихся из проопиомеланокортина
- •4. Гормоны задней доли гипофиза
- •59. Гормоны коркового вещества надпочечников.
- •1. Синтез и секреция катехоламинов
- •2. Механизм действия и биологическая роль катехоламинов
- •3. Патология мозгового вещества надпочечников
- •2. Биологические функции инсулина
- •3. Механизм действия инсулина
- •2. Передача сигналов через внутриклеточные рецепторы
- •1. Регуляция секреции фсг и лг
- •2. Механизм действия и эффекты фсг и лг
- •1. Синтез андрогенов
- •2. Регуляция синтеза и секреции андрогенов
- •3. Мишени для андрогенов
- •4. Эффекты андрогенов
- •1. Образование эстрогенов
- •2.Регуляция секреции эстрогенов
- •3.Механизм действия и биологические эффекты эстрогенов
- •4. Образование прогестерона
- •5. Биологические эффекты прогестерона
- •64. Современные представления о механизме действия гормонов белковой природы.
- •65.Метаболизм арахидоновой кислоты:простагландины,тромбоксаны,простациклины,лейкотриены.
- •66.Гормоны щитовидной железы и их влияние на обмен веществ.
- •1. Биосинтез йодтиронинов
- •2. Регуляция синтеза и секреции йодтиронинов
- •3. Механизм действия и биологические функции йодтиронинов
- •4. Заболевания щитовидной железы
- •67. Роль цикла трикарбоновых кислот во взаимосвязи обмена белков, липидов, углеводов.
- •69. Роль важнейших макроэргических соединений в обмене веществ.
- •70. Дыхательная функция крови. Основные типы гипоксий.
- •72. Нарушения кислотно-основного состояния и клинико-биохимические показатели кос.
- •73. Роль почек и легких в поддержании кислотно-основного равновесия.
- •74. Электролитный состав плазмы крови.
- •88. Обезвреживающая функция печень. Механизмы конъюгации.
- •89. Тесты лабораторной диагностики при заболеваниях печени
- •90.Белки соединительной ткани: строение,биологическая роль.Особенности метаболизма соединительной ткани.
- •91.Особенности состава и метаболизма нервной ткани.Роль медиаторов в возникновении и проведении нервных импульсов.
- •3.Синтез гормонов(эритропоэтин,кальцитриол)
- •95.Сосудисто-тромбоцитарный гемостаз,компоненты и их функции.
- •96.Плазменно-коагуляционный гемостаз .Компоненты и их функции.
- •97.Система антикоагулянтов. Основные эндогенные антикоагулянты и их функции.
- •98.Система фибринолиза .Компоненты и их функции в системе гемостаза
3.Метаболизм Ацетил-Коа в клетке
2.Биохимия белков
4.Классификация белков. Характеристика важнейших представителей простых белков
Протамины и гистоны-данная группа белков отличается рядом физ-хим свойств ,своеобразием аминокислотного состава ,и представлена белками с небольшой молек. Массой. Протамины обладают выраженными основными свойствами, т.к. в их составе от 60 до 85% аргинина (например, сальмин из 85 %).Протамины хорошо растворимы в воде, изоэлектрическая точка (ИЭТ) их водных растворов находится в щелочной среде. Протамины больше являются пептидами, а не белками, поскольку их молек масса не превышает 5000. Они составляют белковый компонент в структуре ряда сложных белков. Гистоны также являются белками основного характера. В их состав входят лизин и аргинин ,содержание которых ,однако ,не превышает 20-30 %.Молек. масса (ММ) гистонов намного больше нижнего предела ММ белков. Эти белки сосредоточены в основном в ядрах клеток в составе дезоксирибонуклеопротеинов и играет важную роль в регуляции экспрессии генов.
Проламины и глютелины- это белки растительного происхождения , отличаются своеобразием аминокислотного состава и физико- химических свойств. Они содержатся в основном в семенах злаков ,составляя основную массу клейковины. Характерной особенностью проламинов является растворимость в 60-80% водном растворе этанола, в то время как все остальные белки в этих условиях выпадают в осадок. (Оризенин, глютенин и глиадин, зеин, гордеин и др.) .Проламины содержат 20- 25% глутаминовой кислоты и 10- 15% пролина..
Альбумины и глобулины – глобулярные белки , различающиеся по растворимости. Глобулины растворимы только в разбавленных солевых растворах, в то время как альбумины растворимы почти везде (кроме насыщенного раствора бисульфата аммония ).ММ альбуминов – 40 000 - 70 000, а глобулинов- 150 000 и более. иАльбумин имеет относительно низкую ИЭТ (4,7) и высокий отрицательный заряд при pH 8,6, благодаря чему он мигрирует с большей скоростью в электрическом поле к аноду. 75-805 осмотического давления белков сыворотки крови приходятся на альбумины. Основной их функцией является транспорт жирных кислот. Глобулины α1- фракции содержатся в крови в комплексе с билирубином и с ЛПВП. Глобулины α2-фракции содержат глобулин и неизвестный гликопротеин. Β- Глобулины включают ряд важных в функциональном отношении белков (трансферрин ,ответственный за транспорт железа; церуллоплазмин, транспортирующий медь.; протромбин –предшественник тромбина- белка ,ответственного за превращение фибриногена в фибрин при свертывании крови). γ- Глобулины являются наиболее гетерогенными.
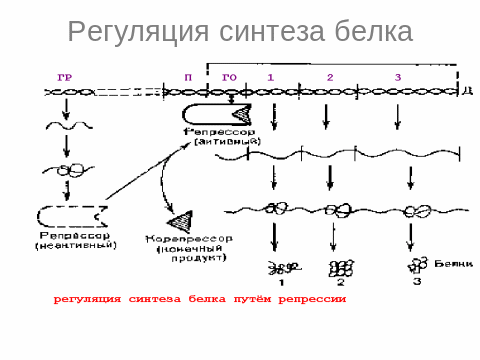
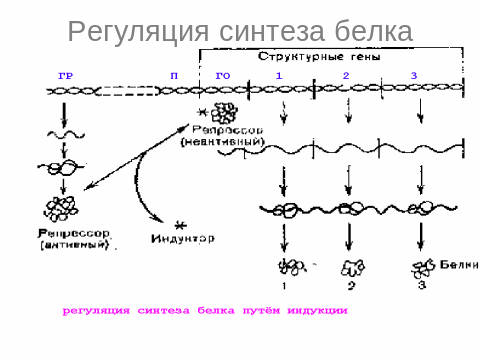
5.Современное представление о биосинтезе белков и их регуляции.
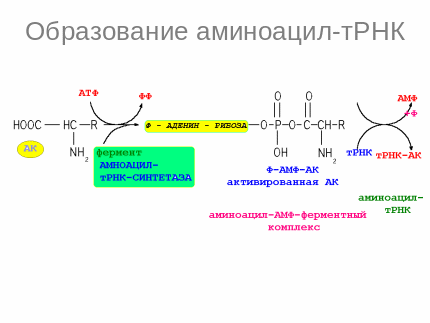
Этапы синтеза белка:
1.активирование АК
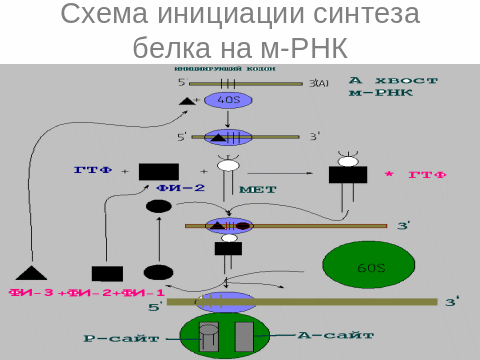
2.инициация трансляции
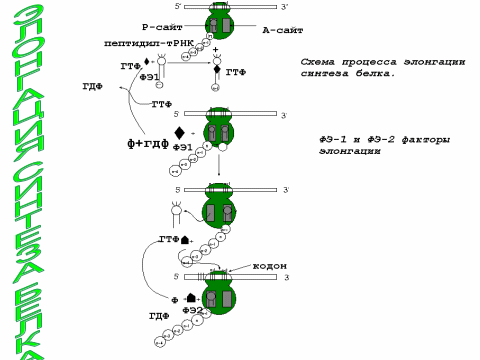
3.элонгация трансляции
4.терминация трансляции
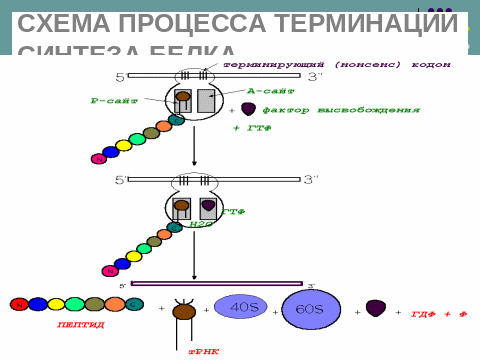
5.постсинтетич модификац белков
6.Понятие о нативном и денатурированном белке. Виды денатурации, практическое использование
Денатурированный белок - Молекула белка, утратившая нативную конформацию вследствие экстремальных воздействий (температура, рН, денатурирующие агенты), что сопровождается потерей его биологической активности.
Денатурация – это процесс нарушения высших уровней организации белковой молекулы (вторичного, третичного, четвертичного) под действием различных факторов.
При этом полипептидная цепь разворачивается и находится в растворе в развернутом виде или в виде беспорядочного клубка.
При денатурации утрачивается гидратная оболочка и белок выпадает в осадок и при этом утрачивает нативные свойства.
Денатурацию вызывают физические факторы: температура, давление, механические воздействия, ультразвуковые и ионизирующие излучения; химические факторы: кислоты, щелочи, органические растворители, алкалоиды, соли тяжелых металлов.
Различают 2 вида денатурации:
Обратимая денатурация – ренатурация или ренактивация – это процесс, при котором денатурированный белок, после удаления денатурирующих веществ вновь самоорганизуется в исходную структуру с восстановлением биологической активности.
необратимая денатурация – это процесс, при котором биологическая активность не восстанавливается после удаления денатурирующих агентов.
Свойства денатурированных белков.
1. Увеличение числа реактивных или функциональных групп по сравнению с нативной молекулой белка (это группы COOH, NH2, SH, OH, группы боковых радикалов аминокислот).
2.Уменьшение растворимости и осаждение белка (связано с потерей гидратной оболочки), развертыванием молекулы белка, с «обнаружением» гидрофобных радикалов и нейтрализации зарядов полярных групп.
3. Изменение конфигурации молекулы белка.
4. Потеря биологической активности, вызванная нарушением нативной структуры.
5.Более легкое расщепление протеолитическими ферментами по сравнению с нативным белком – переход компактной нативной структуры в развернутую рыхлую форму облегчает доступ ферментов к пептидным связям белка, которые они разрушают.
Ферментные методы гидролиза основаны на избирательности действия протеолитических ферментов расщепляющих пептидные связи между определенными аминокислотами.
Пепсин расщепляет связи, образованные остатками фенилаланина, тирозина и глутаминовой кислоты.
Трипсин расщепляет связи между аргинином и лизином.
Химотрипсин гидролизует связи триптофана, тирозина и фенилаланина.
Гидрофобные взаимодействия,а также ионные и водородные связи относятся к числу слабых,тк энергия их лишь ненамного превосходит энергию теплового движения атомов при комнатной температуре(т е уже при данной температуре возможен разрыв связей ).
Поддержание характерной для белка конформации возможно благодаря возникновению множества слабых связей между различными участками полипептидной цепи.
Однако,белки состоят из огромного числа атомов ,находящихся в посттояном (броуновском) движении,что приводит к енбольшим перемещениям отдельных участков полипептидной цепи ,которые обычно не нарушают общую структуру белка и его функции.Следовательно,белки обладают конформационной лабильностью – склонностью к небольшим изменениям конформации за счет разрыва одних и образования других слабых связей.Конформация белка может меняться при изменении химических и физических средств среды,а также при взаимодействии белка с другими молекулами.При этом происходит изменение пространственной структуры не только участка,контактирующего с другой молекулой,но и конформации белка в целом.Конформационные изменения играют огромную роль в функционировании белков в живой клетке . Для практических целей иногда используют процесс денатурации в «мягких» условиях, например при получении ферментов или других биологически активных белковых препаратов в условиях низких температур в присутствии солей и при соответствующем значении рН .При лиофилизации белков (высушивание в вакууме путем возгонки влаги из замороженного состояния) для предотвращения денатурации часто пользуются химическими веществами (простые сахара, глицерин, органические анионы).
