
- •1.Общие вопросы
- •1.Цикл Кребса, его биологическая роль
- •2.Метаболизм пвк в клетке.
- •3.Метаболизм Ацетил-Коа в клетке
- •2.Биохимия белков
- •4.Классификация белков. Характеристика важнейших представителей простых белков
- •5.Современное представление о биосинтезе белков и их регуляции.
- •6.Понятие о нативном и денатурированном белке. Виды денатурации, практическое использование
- •7.Физико-химические свойства белков.
- •8.Структура и функции сложных белков
- •9.Переваривание и всасывание белков в жкт. Судьба всосавшихся аминокислот
- •2.Механизм активации пепсина
- •1. Активация панкреатических ферментов
- •2. Специфичность действия протеаз
- •11. Синтез и биологическая роль креатинина
- •12. Окисление аминокислот в тканях. Прямое и непрямое дезаминирование
- •13. Аминокислоты как источники биологически активных веществ: гистамин, гамк, серотонин, адреналин
- •14.Гликолиз и его биологическая роль
- •17.Роль "ключевых" ферментов в углеводном обмене.
- •18. Регуляция концентрации глюкозы крови.
- •19.Пентозный путь окисления глюкозы и его биологическая роль.
- •20. Биохимические механизмы возникновения гипогликемий.
- •21.Глюконеогенез и его биологическая роль.
- •5. Фосфоенол пируват превращается в глюкозу
- •22. Синтез и распад гликогена.
- •23. Переваривание и всасывание углеводов в жкт.
- •28.Внутриклеточный липолиз.Окисление глицерина до co2 и h2o
- •29. Окисление жирных кислот в клетке.
- •30. Метаболизм кетоновых тел.
- •31) Перекисное окисление липидов (пол). Про- и антиоксидантные системы организма.
- •32) Уровни организации структуры ферментов. Мультиферментные системы.
- •33) Множественные формы ферментов. Изоферменты и их клинико-диагностическое значение.
- •34) Классификация и номенклатура ферментов. Единицы измерения ферментативной активности.
- •36) Регуляция активности ферментов.
- •37) Активаторы и ингибиторы ферментов.
- •39) Химическая природа и функциональные участки молекул ферментов.
- •40) Структура и биологическая роль днк и рнк.
- •41. Распад нуклеиновых кислот в тканях. Метаболизм мочевой кислоты.
- •42. Пути биосинтеза пуриновых и пиримидиновых оснований.
- •43. Современное представление о биологическом окислении. Типы биологического окисления.
- •44. Микросомальное окисление.
- •45.Окислительное фосфорилирование. Теория сопряжения. Влияние ядов на тканевое дыхание и окислительное фосфорилирование
- •46. Оксидазный путь биологического окисления. Субстраты, ферменты и коферменты биологического окисления.
- •47. Строение хромопртеинов .Важнейшие представители и их био. Роль.
- •49.Распад гемоглобина. Основные продукты распада, место их образования и пути выведения.
- •9. Биохимия витаминов.
- •51. Классификация витаминов, общие свойства .Суточная потребность и групповая характристика витаминов.
- •53. Строение, функции и биологическая роль витамина d в организме .Гипо-и гипервитаминоз.
- •54. Структура, функции и биологическая роль витамина к.Понятие об антивитаминах.
- •55. Витамины ,фолиевая кислота и никотиновая кислота, химическая природа , коферментные функции ,влияние на обмен веществ , пищевые источники.
- •56. Структура, коферментные функции и биологическая роль антидерматитных витаминов в6,н,пантотеновой кислоты.
- •Биохимия гормонов и биологически активных веществ
- •57.Роль посредников в гормональной регуляции обмена веществ.
- •1.Передача гормональных сигналов через мембранные рецепторы
- •2. Передача сигналов через внутриклеточные рецепторы
- •3.Передача сигналов через рецепторы, сопряжённые с ионными каналами
- •58.Гормоны гипоталамуса и гипофиза, их строение и механизм действия.
- •2. Кортиколиберин
- •3. Гонадолиберин
- •4. Соматолиберин
- •5.Соматостатин
- •1. Гормон роста, пролактин
- •2.Тиреотропин, лютеинизирующий гормон и фолликулостимулирующий гормон
- •3.Группа гормонов,образующихся из проопиомеланокортина
- •4. Гормоны задней доли гипофиза
- •59. Гормоны коркового вещества надпочечников.
- •1. Синтез и секреция катехоламинов
- •2. Механизм действия и биологическая роль катехоламинов
- •3. Патология мозгового вещества надпочечников
- •2. Биологические функции инсулина
- •3. Механизм действия инсулина
- •2. Передача сигналов через внутриклеточные рецепторы
- •1. Регуляция секреции фсг и лг
- •2. Механизм действия и эффекты фсг и лг
- •1. Синтез андрогенов
- •2. Регуляция синтеза и секреции андрогенов
- •3. Мишени для андрогенов
- •4. Эффекты андрогенов
- •1. Образование эстрогенов
- •2.Регуляция секреции эстрогенов
- •3.Механизм действия и биологические эффекты эстрогенов
- •4. Образование прогестерона
- •5. Биологические эффекты прогестерона
- •64. Современные представления о механизме действия гормонов белковой природы.
- •65.Метаболизм арахидоновой кислоты:простагландины,тромбоксаны,простациклины,лейкотриены.
- •66.Гормоны щитовидной железы и их влияние на обмен веществ.
- •1. Биосинтез йодтиронинов
- •2. Регуляция синтеза и секреции йодтиронинов
- •3. Механизм действия и биологические функции йодтиронинов
- •4. Заболевания щитовидной железы
- •67. Роль цикла трикарбоновых кислот во взаимосвязи обмена белков, липидов, углеводов.
- •69. Роль важнейших макроэргических соединений в обмене веществ.
- •70. Дыхательная функция крови. Основные типы гипоксий.
- •72. Нарушения кислотно-основного состояния и клинико-биохимические показатели кос.
- •73. Роль почек и легких в поддержании кислотно-основного равновесия.
- •74. Электролитный состав плазмы крови.
- •88. Обезвреживающая функция печень. Механизмы конъюгации.
- •89. Тесты лабораторной диагностики при заболеваниях печени
- •90.Белки соединительной ткани: строение,биологическая роль.Особенности метаболизма соединительной ткани.
- •91.Особенности состава и метаболизма нервной ткани.Роль медиаторов в возникновении и проведении нервных импульсов.
- •3.Синтез гормонов(эритропоэтин,кальцитриол)
- •95.Сосудисто-тромбоцитарный гемостаз,компоненты и их функции.
- •96.Плазменно-коагуляционный гемостаз .Компоненты и их функции.
- •97.Система антикоагулянтов. Основные эндогенные антикоагулянты и их функции.
- •98.Система фибринолиза .Компоненты и их функции в системе гемостаза
46. Оксидазный путь биологического окисления. Субстраты, ферменты и коферменты биологического окисления.
Протекает во всех клетках, на внутренней мембране МТХ, создает условия для работы ферментов, способствующих синтезу АТФ.
С субстрата под действием ДГ, е и р передаются на НАДН2. После НАДН2 идет к НАДН2-редуктазе (фермент, кот. Имеет ФМН и FeS б.)
Н+ переходит на ФМН и в межмембр пр , а е в FeS б (засчет изменения валентности). Электроны движутся по ЦПЭ за счет разницы окил-восст потенциала. Передает е на убихинон, далее в матрикс МТХ. Принимает из матрикса Н+, идет к цитохрому В и С, отдает е, идет к межмембр пр и отдает Н+, электроны двигаются по цитохромам до цит аа3 , которое способно присоединять О2. При передачи е на цит аа обр активн форма кислорода, захв Н+ из матрикса и передает к О2 с образованием Н2О. 1 Н+ в межмембр пр. В результате прохождения е по ЦПЭ, созд эл-хим градиент (перезаряжается мембрана)
Субстратами биологического окисления являются продукты превращений жиров, белков и углеводов. Биологическое окисление субстратов до конечных продуктов осуществляется цепью последовательных реакций, в число промежуточных продуктов которых входят трикарбоновые кислоты — лимонная, цисаконитовая и изолимонная кислоты, поэтому вся цепь реакций носит название цикла трикарбоновых кислот, или цикла Кребса (по имени исследователя, установившего этот цикл).
Обмен гемсодержащих хромопротеинов
47. Строение хромопртеинов .Важнейшие представители и их био. Роль.
Хромопротеины (от греч. chroma – краска) состоят из простого белка и связанного с ним окрашенного небелкового компонента. Различают гемопротеины (содержат в качестве простетической группы железо), магнийпорфирины и флавопротеины (содержат производные изоаллоксазина).Хромопротеины наделены рядом уникальных биологических функций: они частвуют в таких фундаментальных процессах жизнедеятельности, как фотосинтез, дыхание клеток и целостного организма, транспорт кислорода
и диоксида углерода, окислительно-восстановительные реакции, светои цветовосприятие и др. Таким образом, хромопротеины играют исключительно важную роль в процессах жизнедеятельности. Например, подавление дыхательной функции гемоглобина путем введения оксида углерода (СО) либо утилизации (потребление) кислорода в тканях путем введения синильной кислоты или ее солей (цианидов), ингибирующих ферментные системы клеточного дыхания, моментально приводит к смерти организма. Хромопротеины являются непременными и активными участниками аккумулирования энергии, начиная от фиксации солнечной энергии в зеленых растениях и утилизации ее до превращений в организме животных и человека. Хлорофилл (магнийпорфирин) вместе с белком обеспечивает фотосинтетическую активность растений, катализируя расщепление молекулы воды на водород и кислород (поглощением солнечной энергии). Гемопротеины (железопорфирины), напротив, катализируют обратную реакцию – образование молекулы воды, связанное с освобождением энергии.
Гемопротеины
К группе гемопротеинов относятся гемоглобин и его производные, миоглобин, хлорофиллсодержащие белки и ферменты (вся цитохромная система,каталаза и пероксидаза). Все они содержат в качестве небелкового компонента структурно сходные железо- (или магний)порфирины, но различные по составу и структуре белки, обеспечивая тем самым разнообразие их биологических функций. Далее более подробно рассмотрено химическое строение гемоглобина, наиболее важного для жизнедеятельности человека и животных соединения. Гемоглобин в качестве белкового компонента содержит глобин, а небелкового – гем. Видовые различия гемоглобина обусловлены глобином, в то время как гем одинаков у всех видов гемоглобина. Основу структуры простетической группы большинства гемосодержащих белков составляет порфириновое кольцо, являющееся в свою очередь производным тетрапиррольного соединения – порфирина. Последний состоит из четырех замещенных пирролов. соединенных между собой метиновыми мостиками (—СН=). Незамещенный порфирин называется порфином. В молекуле гема порфин представлен в виде протопорфирина IX, содержащего четыре метильные группы (—СН3), две винильные группы (—СН=СН2) и два остатка пропионовой кислоты. Протопорфирин, присоединяя железо, превращается в гем.
Флавопротеины
Флавопротеины содержат прочно связанные с белком простетические группы, представленные изоаллоксазиновыми производными – окисленными флавинмононуклеотидом (ФМН) и флавинадениндинуклеотидом (ФАД). Флавопротеины входят в состав оксидоредуктаз – ферментов, катализирующих окислительно-восстановительные реакции в клетке. Некоторые Флавопротеины содержат ионы металлов. Типичными представителями флавопротеинов, содержащих также негемовое железо, являются ксантиноксидаза, альдегидоксидаза, СДГ, дигидрооротатдегидрогеназа, ацил-КоА-дегидрогеназа и транспортирующий электроны флавопротеин. На долю двух последних приходится до 80% митохондриальных флавопротеинов, выполняющих важную роль в биоэнергетике клетки. Негемовое железо связывается с белковым компонентом, отличающимся от гемсодержащих хромопротеинов. Железо ковалентно связано с атомом серы остатка цистеина в белке. При кислотном гидролизе такого белка освобождается железо и H2S. Несмотря на структурные отличия от цитохромов, негемовые флавопротеины выполняют аналогичную функцию в транспорте электронов благодаря способности переходить из окисленного в восстановленное состояние.
48.основные онтогенетические формы гемоглобина. Произодные гемоглобина и его патологические формы.
Гемоглобин. Его белковая часть представлена глобином, небелковая – гемом. Это олигомерный белок, т.е. имеет четвертичную структуру, состоящую из 4 субъединиц.
цепи построены из 141 АК-остатка.
цепи из 146 АК-остатков [рис. 4-х субъединиц, в каждой нарисована точка - гем].
Каждая из субъединиц связана с гемом:
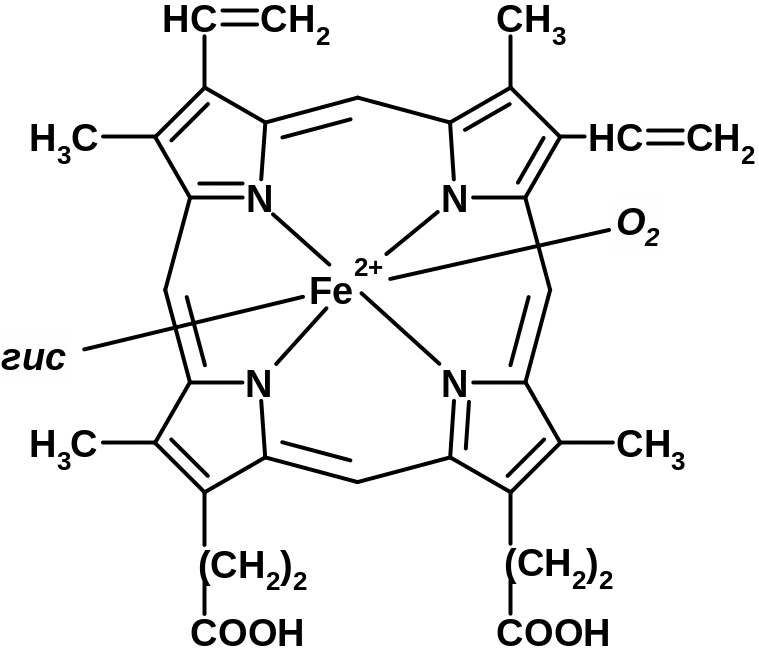 [гем]
[гем]
Основная функция гемоглобина – транспортная (кислород, углекислый газ). Также он представляет собой основную буферную систему крови (75% от всей буферной емкости крови).
Различают:
- HbO2 – оксигемоглобин (связан с молекулой O2);
- HbCO – карбоксигемоглобин;
- HbCO2 – карбгемоглобин;
- HbOH – метгемоглобин (образуется при соединении с нитросоединениями, не способен связывать кислород).
Типы гемоглобина. Всего известно более 100 типов, но их все делят на 2 группы:
1) Физиологические гемоглобины;
2) Патологические (аномальные).
К физиологическим гемоглобинам относятся:
- Hb P – примитивный гемоглобин, имеет место быть у 1-2 недельного эмбриона;
- Hb F – фетальный или гемоглобин плода, к моменту рождения составляет около 70% всего гемоглобина в крови;
- Hb A, Hb A2, Hb A3 – это гемоглобины взрослого организма. На Hb A приходится около 90-96%.
Физиологические типы гемоглобинов отличаются глобулиновой частью (АК-составом). Например Hb A содержит 2 и 2b субъединицы, а Hb F – 2 и 2 субъединицы.
К аномальным (возникающих при наследственных заболеваниях) гемоглобинам относятся:
- HbS – гемоглобин, сопутствующий серповидно-клеточной анемии. Отличается от нормального тем, что с N-конца в 6 положении b–цепи глутамин заменен на валин.
Болезни гемоглобинов (их насчитывают более 200) называют гемоглобинозами. Принято делить их на гемоглобинопатии, в основе развития которых лежит наследственное изменение структуры какой-либо цепи нормального гемоглобина (часто их относят также к «молекулярным болезням»), и талассемии, обусловленные наследственным нарушением синтеза какой-либо нормальной цепи гемоглобина. Различают также железодефицитные анемии. Классическим примером наследственной гемоглобинопатии является
серповидно-клеточная анемия, широко распространенная в странах Южной Америки, Африки и Юго-Восточной Азии. Гемоглобин S, как показали Л. Полинг и др., отличается рядом свойств от нормального гемоглобина: в частности, после отдачи кислорода в тканях он превращается в плохо растворимую дезокси-форму и начинает выпадать в осадок в виде веретенообразных кристаллоидов, названных тактоидами. Последние деформируют клетку и приводят к массивному гемолизу. Талассемии, строго говоря, не являются гемоглобинопатиями. Это генетически обусловленное нарушение синтеза одной из нормальных цепей
гемоглобина. Болезнь характеризуется гиперплазией и разрушением костного мозга, поражением печени, селезенки, деформацией черепа и сопровождается тяжелой гемолитической анемией. Эритроциты при талассемии приобретают мишеневидную форму.
