
- •1.Общие вопросы
- •1.Цикл Кребса, его биологическая роль
- •2.Метаболизм пвк в клетке.
- •3.Метаболизм Ацетил-Коа в клетке
- •2.Биохимия белков
- •4.Классификация белков. Характеристика важнейших представителей простых белков
- •5.Современное представление о биосинтезе белков и их регуляции.
- •6.Понятие о нативном и денатурированном белке. Виды денатурации, практическое использование
- •7.Физико-химические свойства белков.
- •8.Структура и функции сложных белков
- •9.Переваривание и всасывание белков в жкт. Судьба всосавшихся аминокислот
- •2.Механизм активации пепсина
- •1. Активация панкреатических ферментов
- •2. Специфичность действия протеаз
- •11. Синтез и биологическая роль креатинина
- •12. Окисление аминокислот в тканях. Прямое и непрямое дезаминирование
- •13. Аминокислоты как источники биологически активных веществ: гистамин, гамк, серотонин, адреналин
- •14.Гликолиз и его биологическая роль
- •17.Роль "ключевых" ферментов в углеводном обмене.
- •18. Регуляция концентрации глюкозы крови.
- •19.Пентозный путь окисления глюкозы и его биологическая роль.
- •20. Биохимические механизмы возникновения гипогликемий.
- •21.Глюконеогенез и его биологическая роль.
- •5. Фосфоенол пируват превращается в глюкозу
- •22. Синтез и распад гликогена.
- •23. Переваривание и всасывание углеводов в жкт.
- •28.Внутриклеточный липолиз.Окисление глицерина до co2 и h2o
- •29. Окисление жирных кислот в клетке.
- •30. Метаболизм кетоновых тел.
- •31) Перекисное окисление липидов (пол). Про- и антиоксидантные системы организма.
- •32) Уровни организации структуры ферментов. Мультиферментные системы.
- •33) Множественные формы ферментов. Изоферменты и их клинико-диагностическое значение.
- •34) Классификация и номенклатура ферментов. Единицы измерения ферментативной активности.
- •36) Регуляция активности ферментов.
- •37) Активаторы и ингибиторы ферментов.
- •39) Химическая природа и функциональные участки молекул ферментов.
- •40) Структура и биологическая роль днк и рнк.
- •41. Распад нуклеиновых кислот в тканях. Метаболизм мочевой кислоты.
- •42. Пути биосинтеза пуриновых и пиримидиновых оснований.
- •43. Современное представление о биологическом окислении. Типы биологического окисления.
- •44. Микросомальное окисление.
- •45.Окислительное фосфорилирование. Теория сопряжения. Влияние ядов на тканевое дыхание и окислительное фосфорилирование
- •46. Оксидазный путь биологического окисления. Субстраты, ферменты и коферменты биологического окисления.
- •47. Строение хромопртеинов .Важнейшие представители и их био. Роль.
- •49.Распад гемоглобина. Основные продукты распада, место их образования и пути выведения.
- •9. Биохимия витаминов.
- •51. Классификация витаминов, общие свойства .Суточная потребность и групповая характристика витаминов.
- •53. Строение, функции и биологическая роль витамина d в организме .Гипо-и гипервитаминоз.
- •54. Структура, функции и биологическая роль витамина к.Понятие об антивитаминах.
- •55. Витамины ,фолиевая кислота и никотиновая кислота, химическая природа , коферментные функции ,влияние на обмен веществ , пищевые источники.
- •56. Структура, коферментные функции и биологическая роль антидерматитных витаминов в6,н,пантотеновой кислоты.
- •Биохимия гормонов и биологически активных веществ
- •57.Роль посредников в гормональной регуляции обмена веществ.
- •1.Передача гормональных сигналов через мембранные рецепторы
- •2. Передача сигналов через внутриклеточные рецепторы
- •3.Передача сигналов через рецепторы, сопряжённые с ионными каналами
- •58.Гормоны гипоталамуса и гипофиза, их строение и механизм действия.
- •2. Кортиколиберин
- •3. Гонадолиберин
- •4. Соматолиберин
- •5.Соматостатин
- •1. Гормон роста, пролактин
- •2.Тиреотропин, лютеинизирующий гормон и фолликулостимулирующий гормон
- •3.Группа гормонов,образующихся из проопиомеланокортина
- •4. Гормоны задней доли гипофиза
- •59. Гормоны коркового вещества надпочечников.
- •1. Синтез и секреция катехоламинов
- •2. Механизм действия и биологическая роль катехоламинов
- •3. Патология мозгового вещества надпочечников
- •2. Биологические функции инсулина
- •3. Механизм действия инсулина
- •2. Передача сигналов через внутриклеточные рецепторы
- •1. Регуляция секреции фсг и лг
- •2. Механизм действия и эффекты фсг и лг
- •1. Синтез андрогенов
- •2. Регуляция синтеза и секреции андрогенов
- •3. Мишени для андрогенов
- •4. Эффекты андрогенов
- •1. Образование эстрогенов
- •2.Регуляция секреции эстрогенов
- •3.Механизм действия и биологические эффекты эстрогенов
- •4. Образование прогестерона
- •5. Биологические эффекты прогестерона
- •64. Современные представления о механизме действия гормонов белковой природы.
- •65.Метаболизм арахидоновой кислоты:простагландины,тромбоксаны,простациклины,лейкотриены.
- •66.Гормоны щитовидной железы и их влияние на обмен веществ.
- •1. Биосинтез йодтиронинов
- •2. Регуляция синтеза и секреции йодтиронинов
- •3. Механизм действия и биологические функции йодтиронинов
- •4. Заболевания щитовидной железы
- •67. Роль цикла трикарбоновых кислот во взаимосвязи обмена белков, липидов, углеводов.
- •69. Роль важнейших макроэргических соединений в обмене веществ.
- •70. Дыхательная функция крови. Основные типы гипоксий.
- •72. Нарушения кислотно-основного состояния и клинико-биохимические показатели кос.
- •73. Роль почек и легких в поддержании кислотно-основного равновесия.
- •74. Электролитный состав плазмы крови.
- •88. Обезвреживающая функция печень. Механизмы конъюгации.
- •89. Тесты лабораторной диагностики при заболеваниях печени
- •90.Белки соединительной ткани: строение,биологическая роль.Особенности метаболизма соединительной ткани.
- •91.Особенности состава и метаболизма нервной ткани.Роль медиаторов в возникновении и проведении нервных импульсов.
- •3.Синтез гормонов(эритропоэтин,кальцитриол)
- •95.Сосудисто-тромбоцитарный гемостаз,компоненты и их функции.
- •96.Плазменно-коагуляционный гемостаз .Компоненты и их функции.
- •97.Система антикоагулянтов. Основные эндогенные антикоагулянты и их функции.
- •98.Система фибринолиза .Компоненты и их функции в системе гемостаза
30. Метаболизм кетоновых тел.
В. ОБМЕН КЕТОНОВЫХ ТЕЛ
При голодании, длительной физической работе и в случаях, когда клетки не получают достаточного количества глюкозы, жирные кислоты

Рис. 8-31. ω-Окисление жирных кислот. ω-Окисление жирных кислот активируется в тех случаях, когда активность β-окисления жирных кислот снижена. 1 - адипиновая кислота; 2 - субериновая кислота.
используются многими тканями как основной источник энергии. В отличие от других тканей мозг и другие отделы нервной ткани практически не используют жирные кислоты в качестве источника энергии. В печени часть жирных кислот превращается в кетоновые тела, которые окисляются мозгом, нервной тканью, мышцами, обеспечивая достаточное количество энергии для синтеза АТФ и уменьшая потребление глюкозы. К кетоновым телам относят β-гидроксибутират, ацетоацетат и ацетон. Первые две молекулы могут окисляться в тканях, обеспечивая синтез АТФ. Ацетон образуется только при высоких концентрациях кетоновых тел в крови и, выделяясь с мочой, выдыхаемым воздухом и потом, позволяет организму избавляться от избытка кетоновых тел.
Синтез кетоновых тел в печени. При низком соотношении инсулин/глюкагон в крови в жировой ткани активируется распад жиров. Жирные кислоты поступают в печень в большем количестве, чем в норме, поэтому увеличивается скорость β-окисления (рис. 8-32). Скорость реакций ЦТК в этих условиях снижена, так как оксалоацетат используется для глюконеогенеза. В результате скорость образования ацетил-КоА превышает способность ЦТК окислять его. Ацетил-КоА накапливается в митохондриях печени и используется для синтеза кетоновых тел. Синтез кетоновых тел происходит только в митохондриях печени.
Синтез кетоновых тел начинается с взаимодействия двух молекул ацетил-КоА, которые под действием фермента тиолазы образуют ацетоацетил-КоА (рис. 8-33). С ацетоацетил-КоА взаимодействует третья молекула ацетил-КоА, образуя 3-гидрокси-3-метилглутарил-КоА (ГМГ-КоА). Эту реакцию катализирует фермент ГМГ-КоА-синтаза. Далее ГМГ-КоА-лиаза катализирует расщепление ГМГ-КоА на свободный ацетоацетат и ацетил-КоА.
Ацетоацетат может выделяться в кровь или превращаться в печени в другое кетоновое тело - β-гидроксибутират путём восстановления.
В клетках печени при активном β-окислении создаётся высокая концентрация NADH. Это способствует превращению большей части ацетоацетата в β-гидроксибутират, поэтому основное кетоновое тело в крови - именно β-гидроксибутират. При голодании для многих тканей жирные кислоты и кетоновые тела становятся основными топливными молекулами. Глюкоза используется в первую очередь нервной тканью и эритроцитами.
При высокой концентрации ацетоацетата часть его неферментативно декарбоксилируется, превращаясь в ацетон. Ацетон не утилизируется тканями, но выделяется с выдыхаемым воздухом и мочой. Таким путём организм удаляет избыточное количество кетоновых тел, которые не успевают окисляться, но, являясь водорастворимыми кислотами, вызывают ацидоз.

Рис. 8-32. Активация синтеза кетоновых тел при голодании. Точечные линии - скорость метаболических путей снижена; сплошные линии - скорость метаболических путей повышена. При голодании в результате действия глюкагона активируются липолиз в жировой ткани и (3-окисление в печени. Количество оксалоацетата в митохондриях уменьшается, так как он, восстановившись до малата, выходит в цитозоль, где опять превращается в Оксалоацетат и используется в глюконеогенезе. В результате скорость реакций ЦТК снижается и, соответственно, замедляется окисление ацетил-КоА. Концентрация ацетил-КоА в митохондриях увеличивается, и активируется синтез кетоновых тел. Синтез кетоновых тел увеличивается также при сахарном диабете (см. раздел 11).
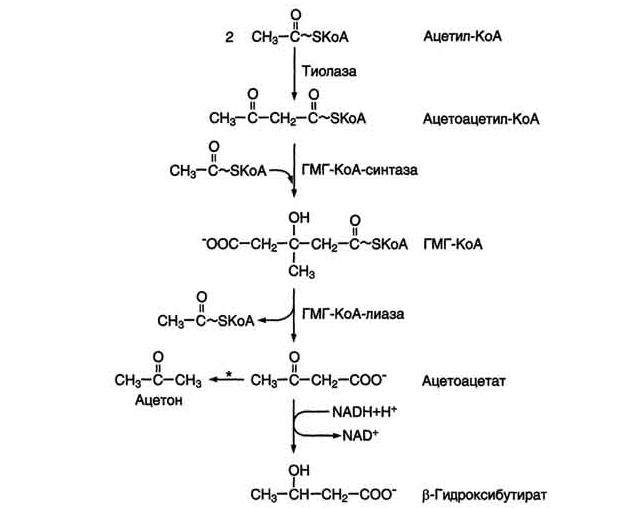
Рис. 8-33. Синтез кетоновых тел в митохондриях гепатоцитов. Регуляторный фермент синтеза кетоновых тел (ГМГ-КоА-синтаза) ингибируется свободным КоА. - реакция идёт неферментативно при высокой концентрации кетоновых тел в крови.
Регуляция синтеза кетоновых тел. Регуляторный фермент синтеза кетоновых тел - ГМГ-КоА синтаза.
ГМГ-КоА-синтаза - индуцируемый фермент; его синтез увеличивается при повышении концентрации жирных кислот в крови. Концентрация жирных кислот в крови увеличивается при мобилизации жиров из жировой ткани под действием глюкагона, адреналина, т.е. при голодании или физической работе.
ГМГ-КоА-синтаза ингибируется высокими концентрациями свободного кофермента А.
Когда поступление жирных кислот в клетки печени увеличивается, КоА связывается с ними, концентрация свободного КоА снижается, и фермент становится активным.
Если поступление жирных кислот в клетки печени уменьшается, то, соответственно, увеличивается концентрация свободного КоА, ингибирующего фермент. Следовательно, скорость синтеза кетоновых тел в печени зависит от поступления жирных кислот.
Окисление кетоновых тел в периферических тканях
При длительном голодании кетоновые тела становятся основным источником энергии для скелетных мышц, сердца и почек. Таким образом
глюкоза сохраняется для окисления в мозге и эритроцитах. Уже через 2-3 дня после начала голодания концентрация кетоновых тел в крови достаточна для того, чтобы они проходили в клетки мозга и окислялись, снижая его потребности в глюкозе.
β-Гидроксибутират (рис. 8-34), попадая в клетки, дегидрируется NAD-зависимой дегидрогеназой и превращается в ацетоацетат. Ацетоацетат активируется, взаимодействуя с сук-цинил-КоА - донором КоА:
Ацетоацетат + Сукцинил-КоА → Ацетоацетил- КоА + Сукцинат.
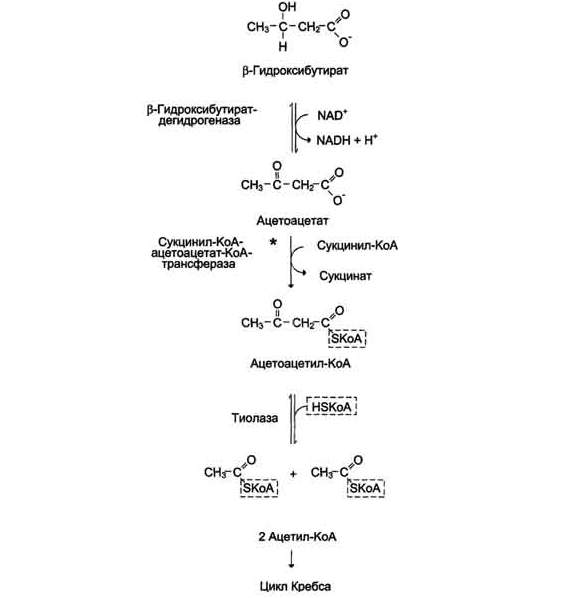
Рис. 8-34. Окисление кетоновых тел в тканях.
Реакцию катализирует сукцинил-КоА-ацето-ацетат-КоА-трансфераза. Этот фермент не синтезируется в печени, поэтому печень не использует кетоновые тела как источники энергии, а производит их "на экспорт". Кетоновые тела - хорошие топливные молекулы; окисление одной молекулы β-гидроксибутирата до СО2 и Н2О обеспечивает синтез 27 молекул АТФ. Эквивалент одной макроэргической связи АТФ (в молекуле сукцинил-КоА) используется на активацию ацетоацетата, поэтому суммарный выход АТФ при окислении одной молекулы β-гидроксибутирата - 26 молекул.
Кетоацидоз. В норме концентрация кетоновых тел в крови составляет 1-3 мг/дл (до 0,2 мМ/л), но при голодании значительно увеличивается. Увеличение концентрации кетоновых тел в крови называют кетонемией, выделение кетоновых тел с мочой - кетонурией. Накопление кетоновых тел в организме приводит к кетоацидозу: уменьшению щелочного резерва (компенсированному ацидозу), а в тяжёлых случаях - к сдвигу рН (некомпенсированному ацидозу), так как кетоновые тела (кроме ацетона) являются водорастворимыми органическими кислотами (рК~3,5), способными к диссоциации:
СН3-СО-СН2-СООН ↔ СН3-СО-СН2-СОО- + Н+.
Ацидоз достигает опасных величин при сахарном диабете, так как концентрация кетоновых тел при этом заболевании может доходить до 400-500 мг/дл. Тяжёлая форма ацидоза - одна из основных причин смерти при сахарном диабете. Накопление протонов в крови нарушает связывание кислорода гемоглобином, влияет на ионизацию функциональных групп белков, нарушая их кон-формацию и функцию.
