
lection_part1-2
.pdf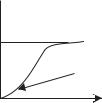
Во-первых, классическая теория теплоемкости вещества не дает зависимости теплоемкости от температуры, что наглядно проявляется в опытах, особенно при низких температурах (рис. 15.1). Во-вторых, классическая теория теплоемкости принимает атом за материальную точку, обладающую тремя степенями свободы, хотя его строго следует рассматривать
СV 
R
~T3
T
Рис. 15.1
как ТТ, т.е. атом обладает шестью степенями свободы. При этом необходимо учитывать, что при разных температурах эффективный вклад всех степеней свободы в теплоемкость будет различным. При понижении температуры некоторые степени свободы дают малый вклад, как бы «замораживаются». С учетом этого закон равномерного распределения энергии по степеням свободы требует уточнения. Внутренняя энергия молекул может принимать лишь определенные, строго фиксированные – дискретные – значения. Например, атом при низких температурах, сколь угодно близких к нулю Кельвина, обладает, в основном, колебательными степенями свободы. Самый низкий из энергетических уровней, соответствующих такому состоянию молекул, называют нулевым. Далее с повышением температуры активизируется вращение молекул, и при высоких температурах становится справедлив закон равномерного распределения энергии по степеням свободы.
В металлах концентрация носителей тока – электронов достаточно велика, они слабо связаны с атомами, поэтому часто оперируют понятием «электронного газа» в металлах. Следует отметить, что о ситуации с теплоемкостью металлов долгое время говорили, как о «катастрофе с теплоемкостью». Это связано с тем, что помимо атомов, находящихся в узлах кристаллической решетки, вклад в теплоемкость должны давать и носители тока. Этот вклад также дискретен, становится значительным по сравнению с вкладом решетки (ионов в узлах) лишь при низких температурах.
Все вышеперечисленные факторы были учтены в новой – квантовой теории строения вещества. К этому вопросу мы еще вернемся в третьей, последней части курса физики.
171
15.2. Фаза. Метастабильные состояния. Диаграммы состояния. Тройные точки. Фазовые переходы (ФП) I и II рода. Явление сверхтекучести (ФП II рода)
Под фазой в термодинамике понимают равновесное состояние ве-
щества, отличающееся по своим физическим свойствам (строение, теплоемкость, электропроводность и т.п.) от других равновесных состояний
(других фаз) этого же вещества. Переход вещества из одной фазы в дру-
гую (фазовый переход) связан с качественным изменением свойств вещества, например, кристаллизация расплава (жидкости). При этом, как отмечалось выше, может образоваться не только монокристалл (фаза), но и поликристалл (также является фазой), а также аморфное ТТ (так называемая неустойчивая – метастабильная фаза). Ясно, что вещество, находясь в од-
ном и том же агрегатном состоянии (ТТ), может быть представлено сразу в виде нескольких фаз.
Любая химическая система, состоящая из некоторого числа компонентов, имеет определенное число степеней свободы. В отличие от степеней свободы, в молекулярной физике, химической термодинамике под степенями свободы понимают набор тех физических параметров, изменение которых в определенном интервале не приводит к изменению фазо-
вого состава системы. Количество степеней свободы, которыми облада-
ет многофазная система, определяется согласно следствию из правила
фаз Гиббса: |
|
с = k − f + n , |
(15.3) |
где с – число степеней свободы; k – число независимых компонентов; f – число фаз в данной системе; n – число физических условий, определяющих состояние системы (обычно n=2 – P и Т).
В точках, где число степеней свободы оказывается отрицательным, система является термодинамически неустойчивой.
Переход вещества из одного агрегатного состояния в другое или из одной фазы в другую удобно описывать с помощью графического изображения – фазовой диаграммы, или диаграммы состояния, диаграммы равновесия, дающей соотношение между параметрами состояния физико-химической системы (температурой Т, давлением Р и др.) и её составом Х. В общем случае, когда система состоит из одного компонента, это изображение трехмерное, но поскольку многие процессы часто протекают при постоянном значении одного из параметров, то используют сечения трехмерного изображения соответствующей постоянному параметру плоскости. Например, при постоянном давлении используют сечение Т–Х – диаграмму Т–Х. Аналогичными соображениями обосновывается применение диаграмм Р–Х и P–Т.
172

Пример P–Т диаграммы состояния однофазной системы – углекислого газа СО2, изучением состояния которого занимался Т.Эндрюс еще в XIX в. (см. лекция 13, вопрос 1), приведен на рис. 15.2, где К – точка безвариантности (нонвариантности), и, согласно формуле (15.3), с=0, или тройная точка, в которой сосуществуют все три агрегатных состояния – жидкое, твердое и газообразное.
Диаграмма имеет простейший вид (рис.15.2), если однокомпонентная система характеризуется наличием только одной кристаллической (ТТ), жидкой и газообразной (парообразной) фазы (только в этом случае смысл понятия «агрегатное состояние» и понятия «фаза» совпадают).Если же вещество в одном из агрегатных состояний, например, кристаллическом, при изменении условий меняет свое строение (сингонию), другие свойства (характеризуется несколькими фазами), то диаграмма состояния (рис.15.2) усложняется, появляется несколько критических точек – точек безвариантности.
P |
|
ТТ |
|
|
|
|
|
|
|||
Па |
|
Жидкость |
|||
|
(solid) |
||||
=534996 |
|
|
|
(liquid) |
|
|
K |
Газ (gas) |
|||
|
|
||||
кр |
|
|
|
||
|
|
|
|
|
|
P |
|
|
|
|
|
|
Tкр=-58,6 |
°С<0 T |
|||
Рис. 15.2
Пример Т–Х диаграммы состояния двухкомпонентной системы с неограниченной взаимной растворимостью приведен на рис. 15.3.
Рис. 15.3
173
Неограниченной растворимостью друг в друге (с образованием полностью гомогенной – однородной среды) обладают обычно вещества со сходными физико-химическими свойствами, например, располагающиеся в одной подгруппе Периодической таблицы Д.И. Менделеева (золото Au и серебро Ag).
Следует отметить тот факт, что при кристаллизации системы без особых технических приспособлений (например, организации подпитки по како- му-то из компонентов), в общем случае изменяется ее состав, т.е. следует рассматривать динамическое равновесие в системе.
Ликвидусом (от лат. liquidus – жидкий) системы называется кривая, вдоль которой происходит полное плавление кристаллов данного вещества с ростом температуры или начало их равновесной кристаллизации.
Солидусом (от лат. solidus – плотный, твердый) системы называется кривая, вдоль которой происходит полная кристаллизация сплава (или твердого раствора) или начало их равновесного плавления.
Между солидусом и ликвидусом находятся в равновесии обе фазы (расплав и ТТ).
Если же растворение веществ друг в друге неполное или процесс идет с образованием различных химических соединений и их модификаций (по строению и прочим физико-химическим свойствам, но одинакового агрегатного состояния – α, β,γ,...), то диаграмма состояния может значительно усложняться. Естественно, диаграмма состояния усложняется и при увеличении компонентов в системе. В этом случае она будет уже не трехмерной, как в случае одного компонента, а n-мерной, где n – число компонентов; при этом рассматриваются вышеназванные сечения по каждому из компонентов и зависимости их содержания в жидкой и твердой фазах от концентрации других компонентов. Последние зависимости для многокомпонентных систем получить, как правило, очень трудно из-за совместного многофакторного влияния других компонентов с учетом изменения этого влияния при измененииусловийпроведениятехнологическихпроцессов.
Переход вещества из одной фазы в другую – фазовый переход – всегда связан с качественными изменениями свойств вещества. При-
мерами фазовых переходов могут служить не только плавление, кристаллизация, испарение, т.е. изменения агрегатного состояния вещества, но и переходы, связанные с изменениями в составе, строении и свойствах вещества, например, изменение модификации кристаллического вещества (смена сингонии и, следовательно, изменение свойств).
При фазовых переходах I рода скачкообразно изменяются плотность, объем, концентрация, энтропия (увеличение беспорядка) и выделяется или поглощается теплота – теплота фазового перехода. Например, при плавлении вещества должна быть затрачена энергия на разрыв связей атомов в кристаллической решетке, а при кристаллизации, при образовании этих связей излишек энергии выделяется.
174

При медленном нагревании вещества выше температуры плавления и его дальнейшем охлаждении, на графике зависимости изменения температуры от времени T=f(t) появляются горизонтальные участки (рис. 15.4), т.е. температура в системе остается в течение некоторого времени постоянной, хотя извне (нагревательная спираль) теплота системе сообщается.
Зависимость вида, приведённого на рис.15.4, называется темпера-
турно-временным режимом (ТВР).
T 
Tпл
T0
0 t
Рис. 15.4
Следует отметить, что при увеличении масштаба изображения реальных ТВР их линии будут выглядеть волнообразными, так как при проведении технологического процесса поддержание постоянства температуры всегда проводится с конечной точностью, в пределах которой возможны флуктуации температурного поля, а, следовательно (см. фазовые диаграммы), существенное изменение состава и свойств получаемых материалов. Поэтому при проведении технологических процессов требуется четко выдерживать
температуру, скорость (это производная dT dt – угол наклона кривой к
dt – угол наклона кривой к
оси времени) и время (моменты) ее изменения.
К фазовым переходам I рода относятся изменение агрегатного состояния (плавление и кристаллизация, испарение и конденсация, сублимация и обратный ей переход из газовой фазы в ТТ), переход вещества из одной кристаллической модификации в другую, переход из нормального в сверхпроводящее состояние под действием сильного магнитного поля. Выделение теплоты фазо-
вогоперехода– характерныйпризнакфазовогопереходаI рода.
При фазовых переходах II рода не происходит поглощения или выделения теплоты, плотность изменяется непрерывно, скачкообразно изменяются теплоемкость, вязкость, электропроводность, коэффициент теплового расширения (КТР). Примерами фазовых переходов II рода могут служить переходы веществ в сверхпроводящее и сверхтекучее состояния при низких температурах, переход вещества из ферромагнитного в парамагнитное состояние при нагреве до определенной температуры (температура перехода – температура Кюри). В квантовой теории явления сверхпро-
водимости и сверхтекучести объясняются с единой точки зрения, показывается их общность.
175
Сверхтекучесть – состояние жидкости, в котором она протекает через узкие щели и капилляры без трения. Единственным представителем семейства сверхтекучих жидкостей долгое время считался жидкий гелий 4Не, становящийся сверхтекучим ниже температуры Т=2,17 К. Сверхтекучее состояние гелия назвали Не–II, в отличие от обычного Не–I. Сверхтекучесть Не–II была открыта П.Л.Капицей (р.1894г.) в 1938г.
При рассмотрении вопроса об ограниченности классической теории теплопроводности говорилось о том, что при температурах сколь угодно близких к нулю Кельвина в веществе продолжается движение – т.н. нулевые колебания атомов и молекул (в квантовой теории показывается, что энергия тепловых возбуждений может представляться в виде суммы энергий hω особых квантов – фононов (h– постоянная Планка, ω – циклическая частота колебаний)). Сверхтекучесть Не–II была объяснена Л.Д.Ландау в 1941 г. в его квантовой теории двухжидкостной гидродинамики. Согласно этой теории Не–II можно представить состоящим из двух взаимопроникающих компонент: нормальной и сверхтекучей. В нормальной составляющей жидкого гелия возможно возбуждение тепловых колебаний, с наличием которых связано существование внутреннего трения – вязкости. В сверхпроводящей же составляющей до температуры Т=2,17 К эти колебания не возникают, при этом частицы Не–II представляют так называемый конденсат – коллектив сильно взаимодействующихмеждусобойчастиц.
ЛЕКЦИЯ 16. РАСТВОРЫ
1.Растворы (общие сведения).
2.Осмос и осмотическое давление. Закон Рауля.
3.Многокомпонентныетвердыерастворы(МТР). ПрименениеМТР
16.1. Растворы (общие сведения)
Растворами называют физически однородные (гомогенные) смеси двух или нескольких веществ. Физическая однородность достигается равномерным перемешиванием молекул, чем раствор отличается от механических смесей, в которых перемешаны не молекулы, а макроскопические частицы вещества. От химических соединений растворы отличаются тем, что состав раствора может изменяться в широких пределах, а вещества в химические соединения вступают в строго определенных пропорциях.
Раствор нельзя считать просто механической смесью молекул, так как при смешивании вещества взаимодействуют между собой с рядом эффектов: изменяется суммарный объем (спирт + вода), выделяется или поглощается теплота, образуются сольваты (непрочные соединения непостоянного состава молекул компонентов раствора, если растворитель – вода, то сольваты называют гидратами) и т.д.
176
Раствор состоит из растворителя и растворенных веществ. Растворителем считается вещество, которое до растворения находилось в том же агрегатном состоянии, что и после растворения (вода+сахар, растворитель
– вода). Если же компоненты раствора до и после растворения находятся в одинаковом агрегатном состоянии (вода+спирт), то растворителем считается компонент, присутствующий в большем количестве.
Растворы называются слабыми или разбавленными, если число молекул растворенных веществ очень мало по сравнению с числом молекул растворителя, в противном случае растворы называются крепкими. Очень крепкие растворы называются концентрированными. Раствор, находящийся в динамическом равновесии с растворяющимся веществом, называется насыщенным (растворение – процесс двухстороннего перехода: молекул из растворяемого вещества в раствор и обратно).
Относительное содержание компонентов в растворе характеризуется их концентрациями. Различают массовые (массовая доля), мольные
(мольная доля), молярные (молярность), объемные концентрации.
Массовая доля есть отношение массы данного компонента к массе всех компонентов раствора. Сумма всех массовых долей равна единице.
Мольная доля есть отношение количества компонента к сумме количеств всех веществ, составляющих раствор.
Молярность есть отношение количества растворенного вещества к массе растворителя.
Объемной концентрацией компонента называется количество его (в граммах или молях) в единице объема раствора.
Раствор называется ненасыщенным, если концентрация растворенного вещества в нем меньше, чем в насыщенном растворе. Если же она больше, то раствор называется пересыщенным (и является метастабильным). В присутствии зародышей растворяемого вещества его избыток выпадает из раствора и раствор становится насыщенным.
Газы также могут растворяться в жидкостях и ТТ. При растворении газа, например, в жидкости молекулы газа переходят из газа, где они слабо взаимодействуют между собой, в раствор, где они подвергаются сильному притяжению со стороны молекул растворителя (возникают связи). С этим связан тот факт, что в подавляющем большинстве случаев тепловой эффект при растворении газов положителен (выделяется теплота).
Согласно принципу Ле-Шателье с увеличением температуры растворимость газов должна убывать, а с увеличением давления газа над раствором – возрастать.
Растворы могут быть как жидкими, так и твердыми (см. 3 вопрос).
Многие сплавы при переходе из жидкого состояния в твердое сохраняют свою однородность, причем соотношения между компонентами в таких фазах могут изменяться без нарушения однородности. Такие сплавы называются твердыми растворами (ТР). ТР представляет собой однофазную сис-
177
тему, состоит из одного вида кристаллитов, т.е. характеризуется единой кристаллической решеткой. ТР существует не при строго определенном соотношении компонентов, а в определенном интервале концентраций.
16.2. Осмос и осмотическое давление. Закон Рауля
Если два раствора отделены друг от друга пористой перегородкой, через которую могут проходить молекулы растворителя и растворенного вещества, то начнется процесс перехода молекул из одного раствора в другой до выравнивания концентраций обоих растворов и установления динамического равновесия. Подобное равновесие осуществимо в случае проницаемой перегородки.
Перегородки (ткани растительного и животного происхождения), проницаемые для молекул растворителя, но непроницаемые для молекул растворенного вещества, называются полупроницаемыми. Если раствор отделен от чистого растворителя полупроницаемой перегородкой, то через нее молекулы чистого растворителя переходят в область, занятую раствором. Это явление называется осмосом (осмос происходит и в тех случаях, когда полупроницаемая перегородка разделяет два раствора различной концентрации). В результате осмоса возникает разность давлений между раствором и чистым растворителем. Осмос прекращается при определенной разности давлений, которая называется осмотическим давлением. Существование осмотического давления объясняется нескомпенсированными с другой стороны перегородки ударами молекул растворенного вещества (удары молекул растворителя будут примерно одинаковыми с обеих сторон и не будут создавать давления). Его величину для разбавленных растворов можно вычислить, как и для идеальных газов по закону Я.Х.Вант-Гоффа (1852–1911): осмотическое давление в слабых растворах подчиняется тем же законам, что и давление идеальных газов:
Р |
= |
NkT |
=ν |
RT |
, |
(16.1) |
|
|
|||||
осм |
V |
|
V |
|
||
|
|
|
|
|||
где N и v – соответственно число молекул и молей растворенного вещества в объеме раствора V. Осмотическое давление клеток многих растений достигает 5–20 атмосфер.
Осмосом объясняется набухание и разрыв оболочек семян растений, замоченных в воде (проницаемых для воды), оживание и насыщение красок увядших цветов, опущенных в воду, напоенность водой верхушек деревьев. Осмос играет важную роль и в жизнедеятельности клеток, так как обмен веществ в живых организмах осуществляется посредством растворов – соков и крови, омывающих полупроницаемые перегородки растительных и животных клеток.
178

Механизм осмоса до конца еще не выяснен, но согласно одной из точек зрения он объясняется различной растворимостью в материале перегородки соприкасающихся с ней веществ. Перегородка растворяет чистый растворитель с одной ее стороны, образуется пересыщенный для другой стороны раствор, тогда перегородка начинает отдавать в жидкий раствор часть растворителя, растворяя при этом его новые порции.
Если в жидкости растворено нелетучее вещество, то свободную поверхность жидкости можно считать полупроницаемой перегородкой: через нее свободно будут проходить молекулы растворителя, но не смогут проходить молекулы растворенного вещества. В результате давление насыщенного пара (пара, находящегося в равновесии с жидкостью) над раствором будет при одной и той же температуре меньше, чем над растворителем. Пусть Р0 – давление насыщенного пара над поверхностью растворителя, а Р – давление над поверхностью раствора в трубке осмометра (рис. 16.1).
Р
Пар
Р0 h
Раствор |
Рис. 16.1
Осмометр в классическом варианте (Пфеффер (1845–1920)) представляет собой глиняный сосуд, в порах которого осаждена механически непрочная
пленка железисто-синеродистой меди Cu2 Fe(CN )6 , являющаяся проницае-
мойперегородкойдляводы, нонепроницаемой, например, длясахара.
В горло сосуда вставлена длинная вертикальная трубка. Если сосуд заполнить водным раствором сахара и погрузить в чистую воду, то уровень жидкости в трубке в результате осмоса (воды в сосуд) изменится, достигая
высоты h. Тогда осмотическое давление Pосм = ρр− раgh.
В состоянии равновесия P − P = ρ |
|
gh |
|
P |
− P |
|
ρпара |
|
Р |
|
пара |
и |
0 |
|
= |
|
|
осм |
. |
||
|
|
|
|
|||||||
0 |
|
|
|
P0 |
|
ρр−ра |
|
Р0 |
||
|
|
|
|
|
|
|
||||
Если раствор разбавленный, то различием между плотностью раствора и
растворителя можно пренебречь. Тогда с учетом равенства |
ρпара |
= |
nпара |
|
ρр− ра |
nр−ля |
|||
|
|
(где nпара – число молекул пара, а nр-ля – число молекул растворителя в единице объема раствора) и закона Вант-Гоффа (16.1) Росм = n1kT (n1 – число молекул растворенного вещества в единице объема раствора) можно получить
179

P0 − P |
= |
|
n1 |
= |
|
|
ν1 |
. |
(16.2) |
P |
n |
|
ν |
|
|||||
|
р−ля |
|
р−ля |
|
|||||
0 |
|
|
|
|
|
|
|||
Формула (16.2) выражает закон Ф.М. Рауля (1830–1901): относи-
тельное понижение давления насыщенного пара растворителя над поверхностью слабого раствора нелетучего вещества равно отношению числа молей растворенного вещества к числу молей растворителя.
Из закона Рауля также следует, что при одном и том же давлении температуракипениярастворавышетемпературыкипениячистогорастворителя.
16.3. Многокомпонентные твердые растворы (МТР) и их диаграммы состояния. Применение МТР
(перед изучением данного вопроса следует ознакомиться с вопросом 2 лекции 15)
Рентгенографические исследования ТР (общее определение ТР дано в вопросе 1) показывают, что существуют три структурных типа ТР: ТР замещения, внедрения и вычитания.
В ТР замещения на основе химического элемента атомы растворенного вещества А замещают в кристаллической решетке атомы растворителя В, статистически (хаотически) распределяясь среди них (рис. 16.2, а). В ТР замещения между химическими соединениями вида АВ и АС атомы (ионы) компонентов размещаются в соответствии с рис. 16.2, б.
а) |
A б)B C |
в) |
|
Рис. 16.2 |
|
Многокомпонентными или сложными ТР (МТР) называются ТР с числом компонентов n ≥ 3. Сложные ТР замещения обычно состоят из атомов элементов нескольких групп (подгрупп) Периодической таблицы Д.И.Менделеева. Как известно, в группе находятся элементы, характеризуемые подобными физико-химическими свойствами. Примером может служить четырехкомпонентный ТР, состоящий из атомов двух групп (А, В) одной группы (и обычно одной и той же подгруппы) Периодической таблицы и (С, D) другой группы (и одинаковой подгруппы): AlGaAsSb, где алюминий Al и галлий Ga – элементы III группы, а мышьяк As и сурьма Sb
– V группы. Такие ТР представляют собой как бы две кристаллические
180
