
lection_part1-2
.pdf−компрессионные, действие которых основано на изотермическом сжатии идеального газа (манометры Мак-Леода);
−теплоэлектрические, в которых используется измерение теплопроводности газов в зависимости от давления. Подразделяются на термопарные и вакуумметры сопротивления;
−ионизационные, использующие явление ионизации остаточного газа потоком электронов, испускаемых накаленным катодом (электронные ионизационные вакуумметры), или альфа-частицами, получаемыми радиоактивным препаратом (радиоактивные ионизационные вакуумметры). Ионный ток в этих приборах служит мерой молекулярной концентрации, т. е. давления газа;
−электроразрядные магнитны, в которых мерой давления служит ток разряда, возникающий при низких давлениях под действием электрического и магнитного полей (разновидностью вакуумметров этого класса являются магнетронный и инверсно-магнетронный вакуумметры).
ЛЕКЦИЯ 11. ОСНОВЫ ОБЩЕЙ ТЕРМОДИНАМИКИ
1.Степени свободы. Внутренняя энергия идеального газа (ИГ), работа и теплота. Первое начало термодинамики. Энтальпия. Закон Гесса.
2.Теплоемкость (здесь вводно, см. далее: Классическая теория теплоемкости вещества, границы ее применимости).
3.Применение первого начала термодинамики к изопроцессам ИГ (изохорный, изобарный, изотермический). Адиабатический (уравнение Пуассона) и политропный процессы.
4.Определение показателя Пуассона методом Клемана–Дезорма.
11.1.Степени свободы. Внутренняя энергия идеального газа (ИГ), работаитеплота. Первоеначалотермодинамики.
Энтальпия. Закон Гесса
В общем случае под степенями свободы понимают минимальный набор параметров, с помощью которого можно полностью описать состояние системы (тела). Это могут быть независимые координаты, полностью описывающие положение тела (молекулы) в пространстве. Материальная точка, движущаяся в некоторой плоскости (xOy) имеет две степени (x, y), в пространстве – три степени свободы (x, y, z). Напомним, что в термодинамике (ТД) молекулы (многоатомные в общем случае) рассматриваются как система материальных точек (шариков, т.к. основная масса заключена в малом ядре), соединенных между собой жесткими недеформируемыми связями. Абсолютно
131
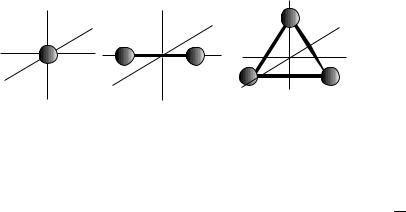
твердое тело (АТТ) – (любая идеальная n-атомная молекула) – в общем случае имеет шесть степеней свободы: три координаты, описывающие по-
ложение центра масс; две координаты, определяющие в пространстве положение оси, проходящей через центр масс и некоторую фиксированную точку, угол поворота тела вокруг названной оси по отношению к некоторому начальному положению. Таким образом, АТТ обладает тремя степенями свободы поступательного движения и тремя степенями свободы вращательного движения. Если тело не АТТ и его части могут смещаться друг относительно друга, то необходимо рассматривать дополнительные степени свободы для описания
колебательногодвижения. |
|
|
z |
|
|
z |
z |
|
|
|
|
|
||
x |
O y |
O |
y |
O y |
а) |
x |
x |
в) |
|
|
б) |
|||
|
|
Рис. 11.1 |
|
|
В статистической физике показано, что средняя кинетическая энер-
гия поступательного движения одноатомной молекулы ИГ ε = 32 kT ((9.1)
из (9.25)). Так как при хаотичном тепловом движении молекулы все три взаимноперпендикулярных направления движения равновероятны, то для одноатомной молекулы (рис. 11.1, а), имеющей три поступательные степе-
ни свободы (i=3), средняя кинетическая энергия на одну поступательную степень свободы равна
< ε |
поступ |
>= |
1 kT . |
(11.1) |
|
|
2 |
|
Формула (11.1) выражает закон статистической физики – закон равномерного распределения энергии по степеням свободы, он справедлив для любой (n-атомной) молекулы.
Кинетической энергией вращения для одноатомной молекулы пренебрегают, т.к. для материальной точки радиус
r → 0 Tвр = |
Iω |
2 |
= |
mr 2ω2 |
→ 0 . |
2 |
|
2 |
|||
|
|
|
|
Для двухатомной молекулы (рис. 11.1,б) к трем поступательным степеням свободы добавляются две вращательных, т.е. число степеней свободы i=5, а для многоатомной (три и более атомов, рис. 11.1,в) – три вращательных степени свободы (i=6). Нежесткая же двухатомная молекула имеет еще (плюс) одну колебательную степень свободы, а нежесткая трехатомная – еще три. Т.к. средняя кинетическая энергия гармонических ко-
132

лебаний примерно равна потенциальной энергии, то на каждую колебательную степень свободы приходится энергия 2 12 kT =kT .
Таким образом, считая по-прежнему энергию одной степени свободы
kT |
, можно записать, что средняя энергия одной молекулы равна |
|
||||
2 |
|
|||||
|
|
|
) kT |
|
|
|
|
< ε >= (i |
+i |
+ 2i |
, |
(11.2) |
|
|
паступ |
вращат |
колебат |
2 |
|
|
Полная энергия термодинамической системы (ТДС) состоит из кинетической энергии механического движения ТДС как единого целого и ее макрочастей: потенциальной энергии ТДС во внешних полях (гравитационном, электромагнитном) и внутренней энергии ТДС U.
Внутренняя энергия – энергия механического движения и взаимодействия (микро)частиц, составляющих (макро)ТДС, а также энергия электронных оболочек и взаимодействия нуклонов (протонов и нейтронов) в ядрах атомов. Однако для процессов, не сопровождающихся химическими или ядерными превращениями, можно считать последние составляющие внутренней энергии неизменными и не учитывать их. Поскольку получается, что выбор «точки» отсчета для внутренней энергии произволен, естественно, что она определяется с точностью до произвольной постоянной. Значение этой константы в большинстве случаев неважно, т.к. в законы физики, как правило, входит разность ∆U .
Зависимость вида U = f (V ,T ) называется калориметрическим урав-
нением.
Т.к. в ИГ пренебрегают силами взаимодействия между молекулами и считают их связи жесткими (т.е. отсутствуют колебания), то внутренняя энергия ИГ – это кинетическая энергия поступательного и вращательного движения его молекул; с учетом формул (11.1) и (11.2) для произвольного количества вещества получают:
U = |
i |
kT |
m |
N |
A |
= |
i |
ν RT . |
(11.3) |
|
2 |
M |
2 |
||||||||
|
|
|
|
|
|
Внутренняя энергия является однозначной функцией состояния ТДС, т.е. не зависит от способа (пути) перехода ТДС в это состояние, а лишь от значения параметров, характеризующих данное состояние (обычно P, V, T). Согласно уравнению (11.3) внутренняя энергия ИГ не зависит от его объема – закон Д.П.Джоуля (1818–1889). Передачу энергии между телами (ТДС) и, следовательно, изменение их внутренней энергии можно осуществлять через работу и теплопередачу (теплота – эквивалент энергии). При этом энергия механического движения может превращаться в тепловую и наоборот. В отличие от внутренней энергии понятия работы и теплопередачи употребляют всегда в контексте с описанием способа изменения состояния ТДС, например, работа адиабатического сжатия ИГ нагрев ИГ (сообщение теплоты) и его изобарное расширение.
133
Первое начало термодинамики является эмпирически (опытно) установленным законом и, по сути, частным случаем закона сохранения энергии (XIX в.):
δ Q = dU +δ A . |
(11.4) |
Формула (11.4) – вся теплота, сообщенная ТДС, идет на изменение ее внутренней энергии и на работу ТДС против внешних сил (знак
«d» – обозначение полного дифференциала, его определение и свойства см. математику). Для ИГ положительной считается работа расширения ИГ, отрицательной – работа сжатия, в общем случае:
V2 |
|
δ A = Fdr = PSdr = PdV и A = ∫PdV . |
(11.5) |
V1
Если постоянен объем, т.е. процесс – изохорный, то из уравнений (11.4) и(11.5) Q = ∆U , еслижепостояннодавление, т.е. процесс – изобарный, то
V2
A = ∫PdV = P∆V и Q = ∆U + P∆V .
V1
В ряде случаев удобно пользоваться не понятием теплоты, а поняти-
ем тепловой функции, теплосодержания или энтальпии |
|
H =U + PV . |
(11.6) |
Энтальпия – функция состояния, приращение которой при изобарическом процессе равно теплоте, полученной системой. Таким образом, величина Q имеет различный смысл в зависимости от того, что остается постоянным: давление или объем. В первом случае под Q понимают внутреннюю энергию, а во втором – энтальпию.
В химии тепловым эффектом реакции называют количество теплоты, выделяющееся в результате реакции; он называется стандартным, если измерен при t=25°С и Р=760 мм.рт.ст. Реакция называется экзотермиче-
ской, если протекает с выделением теплоты (положительный тепловой
эффект), эндотермической – с поглощением (отрицательный): |
|
||||||
С + O2 = (СO2 ) + 394кДж (экзотермическая реакция), |
(11.7) |
||||||
СO + |
|
1 |
O2 |
= (СO2 ) + 283кДж , |
(11.8) |
||
2 |
|||||||
|
|
|
|
||||
С + |
1 |
O2 |
= (СO) +111кДж . |
(11.9) |
|||
2 |
|||||||
|
|
|
|
|
|||
При постоянном объеме тепловой эффект определяется как разность внутренних энергий системы до и после реакции ∆QV = ∆U , а при постоян-
ном давлении – как разность энтальпий ∆QP = ∆H . И внутренняя энергия, и
энтальпия – функции состояния, не зависящие от способа (пути) перехода ТДС в это состояние, а лишь от значения параметров, характеризующих
134

данное состояние (обычно P, V, T). Обобщенно это выражается правилом (1840г.), законом русского академика Г.И.Гесса (1802–1850): тепловой эффект реакции зависит лишь от природы и физического состояния (состав, структура) исходных веществ и конечных продуктов реакции (соответственно при V=const или при P=const), но не зависит от промежуточных стадий реакции.
Если все начальные и конечные продукты реакции находятся в твердом или жидком состояниях, то величины ∆QV ≈ ∆QP вследствие весьма
малого изменения объема и, следовательно, малой работы ТДС против внешних сил. Если же среди начальных и конечных продуктов реакции есть газообразные вещества, то величины ∆QV и ∆QP сильно отличаются.
Закон Гесса позволяет обращаться с уравнениями реакций, как с обычными алгебраическими, и рассчитывать тепловые эффекты реакций, которые трудно или невозможно осуществить в чистом виде. Например, теплота образования газообразной окиси углерода из твердого углерода и кислорода не может быть непосредственно измерена, т.к. углерод никогда не сгорает целиком в окись углерода, а всегда с образованием некоторого количества двуокиси. Для ее определения измеряют теплоту полного сгорания твердого углерода (11.7), потом измеряют теплоту сгорания окиси углерода в двуокись (11.8), а затем, вычитая уравнение (11.8) из уравнения (11.7), получают необходимое уравнение (11.9).
11.2. Теплоемкость
Удельная теплоемкость – теплота, которую надо сообщить 1 кг вещества для повышения его температуры на 1 К:
δ Q |
|
|
с = mdT |
, |
(11.10) |
где т – масса вещества.
Пользуются также понятием молярной теплоемкости (для одного моля вещества):
Cm = M c = |
δ Q |
, |
(11.11) |
ν dT |
где М – молярная масса вещества, v – количество молей вещества.
Если известны удельная и молярная теплоемкость вещества, то теплоемкость конкретного тела можно определить как Стела = с m или
Cтела = Сm ν .
Различают теплоемкости при постоянном давлении и при постоянном объеме. Для ИГ, рассматривая уравнение (11.4) совместно с уравне-
135

нием (11.3) и (11.5), получают, что при постоянном объеме молярная теплоемкость равна
C |
= |
δ QV |
= |
dUm |
= |
i |
R , |
(11.12) |
dT |
|
2 |
||||||
V |
|
|
dT |
|
|
|||
а при постоянном давлении -
CP = δdTQP = dUdTm + P dVdTm = CV + P dVdTm = СV + R = i +2 2 R . (11.13)
Уравнение (11.13) - уравнение Ю.Р.Майера (1814–1878): выводится с учетом уравнения Менделеева–Клапейрона РVm=RT и РdVm+VmdР= РdVm=RdT при постоянном давлении.
При сравнении уравнений (11.12) и (11.13) видно, что молярная теплоемкость при постоянном давлении больше, т.к. часть подводимой теплоты расходуется еще и на совершение ИГ работы расширения (против внешних сил).
Для нахождения удельной (молярной) теплоемкости смеси газов используют уравнение теплового баланса:
m |
с |
∆Т = m с |
∆Т + m |
с |
∆Т +... с |
|
∑miсVi |
|
|
= |
i |
, |
(11.14) |
||||||
|
|||||||||
|
см Vсс |
1 V1 |
2 V 3 |
Vсс |
|
mсм |
|
|
|
|
|
|
|
|
|
|
|
|
|
где тсм – масса смеси; сvcc – удельная теплоемкость вещества; тi – масса.
Приведенные выше рассуждения классической (не квантовой) теории теплоемкости справедливы лишь для ИГ, т.е. в ряде частных случаев, и потому ограниченно применимы. Границы применимости классической теории теплоемкости вещества будут рассмотрены после изучения строения и свойств твердого тела (ТТ) (см. далее «Классическая теория теплоемкости вещества, границы ее применимости»).
11.3. Применение первого начала термодинамики к изопроцессамИГ(изохорный, изобарный, изотермический). Адиабатический(уравнениеПуассона) иполитропныйпроцессы
Изопроцессом называется процесс, при протекании которого оста-
ются постоянными масса газа m и любой из его параметров состояния (P, V или T). При m = const,V = const процесс называется изохорным. Со-
гласно формуле (11.5), работа при изохорном процессе равна
|
|
V1 |
|
|
|
|
|
A = |
V∫1 |
|
|
|
(11.15) |
|
PdV = 0 . |
|
||||
Формула (11.4) с учетом формул (11.3) и (11.15) имеет вид |
|
|||||
|
|
|
i |
. ( δA = 0 ) |
(11.16) |
|
δ |
Q = dU = ν CV dT = |
|
ν R dT |
|||
2 |
||||||
136
При |
m = const, P = const процесс называется изобарическим. Со- |
|||
гласно формуле (11.5) работа при изобарном процессе равна |
|
|||
|
V2 |
|
||
|
A = ∫PdV = P∆V . |
(11.17) |
||
|
V1 |
|
||
Формула (11.4) с учетом формул (11.3) и (11.17) имеет вид |
|
|||
|
δ Q = dU +δ A = dU + PdV =ν СP dT = |
i + 2 |
ν R dT . |
(11.18) |
|
|
|||
|
2 |
|
|
|
При |
m = const,Т = const процесс называется изотермическим |
|||
(dT=0). Согласно формуле (11.5) работа при изотермическом процессе равна
V |
V |
νRTV |
|
V2 |
|
|
|
A = ∫2 |
PdV = ∫2 |
dV =νRT ln |
. |
(11.19) |
|||
V |
|||||||
V |
V |
|
1 |
|
|
||
1 |
1 |
|
|
|
|
|
|
Формула (11.4) с учетом формул (11.3) и (11.19) имеет вид |
|
||||||
|
δ Q = dU +δ A = δ A . |
(11.20) |
|||||
Следует заметить, что при недостатке подвода теплоты из внешней среды работа расширения ИГ может совершаться и за счет убыли внутренней энергии ИГ, и, следовательно, его температура понизится.
Адиабатным называется процесс, протекающий без теплообмена с окружающей средой (δQ = 0 ). Адиабатными можно считать процессы, происходящие в камере сгорания тепловых двигателей, распространение звуковых волн в газах и т.д.
Быстрое адиабатное сжатие воздуха в двигателях типа «дизель» приводит к повышению температуры дизеля до 500–600°С и к самовоспламенению при впрыске топлива. Первое начало термодинамики в случае адиабатного процесса имеет вид: dU = −δA , которое с учетом формул (11.3) и (11.5) можно записать так:
|
|
|
|
|
dU = −δA ν CV dT = −PdV . |
(11.21) |
|||||||||||
|
|
Из уравнения Менделеева–Клапейрона (РVm=RT) следует, что |
|||||||||||||||
|
|
|
|
|
|
РdVm+VmdР=RdT. |
|
|
(11.22) |
||||||||
|
|
Разделив выражения (11.22) на (11.21), получают |
|
||||||||||||||
|
|
|
|
|
PdV |
+ VdP |
|
= − |
|
R |
(11=.13 ) − |
C P − CV |
. |
(11.23) |
|||
|
|
|
|
|
PdV |
|
|
|
|
||||||||
|
|
|
|
|
|
|
C V |
C V |
|
||||||||
|
|
Если, |
следуя С.Д.Пуассону |
|
(1781–1840), |
ввести |
обозначение |
||||||||||
γ = |
|
C P |
(показатель адиабаты или показатель Пуассона), то выраже- |
||||||||||||||
|
|
||||||||||||||||
|
|
C V |
|
|
|
|
|
VdP |
|
|
|
|
|
|
|
||
ние |
(11.23) |
примет |
вид 1 + |
|
|
= −γ + 1 , |
разделяя |
переменные |
|||||||||
|
PdV |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
137
|
|
|
|
|
|
P |
dP |
V |
dV |
|
|
|
|
dP |
= −γ |
dV |
и |
интегрируя |
∫2 |
= −γ ∫2 |
, |
получают |
|||
|
|
P |
V |
|||||||||
|
P |
V |
|
|||||||||
|
|
|
|
P1 |
|
V1 |
|
|
||||
ln P = −γ lnV +ln(const) или |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
ΡV γ |
= const |
, |
|
|
|
(11.24) |
|
т.е. уравнение Пуассона для адиабатного процесса. С использованием уравнения Менделеева–Клапейрона можно получить связь параметров V и T, Р и T при адиабатном процессе:
|
|
|
|
|
|
|
|
|
P2 |
|
|
V1T2 |
|
|
T2 |
|
|
V1 |
|
γ −1 |
|
|
TV γ −1 = const , |
|
||||||||
|
|
|
|
|
|
|
|
|
= |
|
|
= |
|
|
или |
(11.25) |
||||||||||||||||
|
|
|
|
|
|
|
|
|
P |
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
V T |
|
|
T |
|
|
V |
2 |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
1 |
|
2 |
|
1 |
1 |
|
|
|
|
|
|
|
|
|
||||||||||
V1 |
|
|
1 |
|
|
P2 |
|
|
T2 |
|
|
γ |
|
|
P2 |
|
γ |
−1 |
T2 |
γ |
или T γ P1−γ = const . |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
= |
T2 |
|
γ −1 |
|
|
= |
|
γ −1 |
|
|
|
|
|
= |
|
(11.26) |
||||||||||||||||
V |
|
|
P |
|
|
P |
|
|
|
|||||||||||||||||||||||
2 |
T |
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|||||||||||
|
1 |
|
|
|
|
1 |
|
|
1 |
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
1 |
|
|
|
|||||
|
|
|
Так как СV |
= |
|
i |
R |
и C |
|
|
= |
i + 2 |
R , |
то для одноатомного газа i=3 и по- |
||||||||||||||||||
|
|
|
2 |
|
P |
|||||||||||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
||||||
казатель адиабаты γ = 53 ≈ 1,67 ; для двухатомного i=5 и показатель Пуас-
сона γ = 75 =1,4 ; для трех- и более – i=6 и γ = 86 ≈1,33 . Работа при адиабатическом процессе:
T2 |
(*) |
|
|
A = − ∫ν CV dT =ν CV (T1 |
−T2 ) . |
(11.27) |
|
T1 |
|
|
|
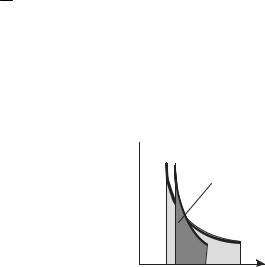
P Адиабата
Адиабата
 Аад Аад<Аиз
Аад Аад<Аиз
Изотерма
 Аиз
Аиз
V
Рис. 11.2
Переход (*) соответствует идеальному случаю, в общем случае теплоемкость равенства СV = f (T ) и интегрирование усложняется. Работа
при адиабатическом процессе меньше, чем при аналогичном изотермическом (см. площади под кривыми, рис. 11.2).
138
С учетом равенства |
СV |
= |
|
|
R |
|
из формулы (11.13) и ν R = |
PV |
из урав- |
||||||||
|
γ −1 |
T |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
нения Менделеева–Клапейрона выражение (11.27) примет вид |
|
|
|||||||||||||||
A =ν |
|
R |
(T |
−T ) = |
P1V1 |
|
1 |
− |
T2 |
|
|
|
|||||
|
|
|
|
. |
|
(11.28) |
|||||||||||
|
γ −1 |
|
1 |
2 |
|
γ −1 |
|
|
T1 |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Рассмотренные выше процессы – изохорный, изобарный, изотермический, адиабатный – можно записать одним уравнением – уравнением политропного процесса:
PV n = const , |
(11.29) |
где n – показатель политропы (все эти процессы называются политропными), т.е.:
а) V=const, C=CV , n=-∞ |
|
P |
= const ; |
|
|
||
|
|
T |
|
б) P=const, C=CP, n=0 |
PV0=const; |
||
δQ |
|
|
|
в) T=const, C= dT =∞, n=1 |
PV=const; |
||
г)δQ = 0 ; C=0, n = γ |
ΡV γ = const . |
||
11.4. Определение показателя Пуассона методом Клемана–Дезорма
Ученые Клеман (1779–1842) и Дезорм (1777–1862) в 1819г. осущест-
вили следующий метод измерения показателя адиабаты γ для газов. В герметичный баллон, содержащий несколько литров какого-либо газа при давлении, равном внешнему атмосферному, накачивают еще порцию того же газа. Давление газа в баллоне становится больше атмосферного. Выдержав газ некоторое время до выравнивания температур воздуха вне баллона и газа в баллоне, измеряют манометром давление газа P1 в баллоне при данной температуре T0. Затем за короткое время через кран выпускают часть газа из баллона, при этом газ в баллоне адиабатически расширится, его давление сравняется с атмосферным Р0, а температура понизится до температуры Т. После того как кран закрывают, газ начинает медленно нагреваться до температуры Т0 окружающего воздуха и его давление станет равным Р2. Зная все параметры P,V, T, характеризующие каждое из этих
трех состояний, можно определить показатель адиабаты для газов γ.
139
Состояние 1: P1,V1, |
T0 |
→ состояние 2: P0,V2, |
T → состояние 3: |
||||
P2,V2,T0. |
|
|
|
(11.24), получают γ PdV +VdP = 0 |
, от- |
||
Дифференцируя уравнение |
|||||||
куда для изменения состояния газа (адиабатического процесса) 1 →2: |
|
||||||
|
γ P(V2 |
−V1 ) +V (P0 − P1 ) = 0 . |
(11.30) |
||||
В |
состояниях 1 |
и |
|
3 температуры |
одинаковы, |
т.е. |
|
PV = const PdV +VdP = 0 |
|
|
|
|
|
|
|
и |
P(V2 −V1 ) +V (P2 − P1 ) = 0 . |
(11.31) |
|||||
Разделив по частям уравнение (11.30) на выражение (11.31) получают: |
|||||||
|
|
γ = |
P1 − P0 |
|
|
||
|
|
|
. |
(11.32) |
|||
|
|
P − P |
|||||
|
|
|
1 |
2 |
|
|
|
ЛЕКЦИЯ 12. ОСНОВЫ ОБЩЕЙ ТЕРМОДИНАМИКИ II
1.Обратимые и необратимые процессы. Циклы. Цикл Карно.
2.Энтропия. Второе начало термодинамики и его статистический смысл. Флуктуации. Броуновское движение.
3.Термодинамические (ТД) функции. Общие критерии термодинамической устойчивости. Принцип Ле-Шателье–Брауна.
12.1. Обратимыеинеобратимыепроцессы. Циклы. ЦиклКарно
Термодинамический (ТД) процесс, совершаемый системой, называется обратимым, если после его завершения можно возвратить систему и все взаимодействующие с ней тела в начальное состояние так, чтобы в других телах (окружающей среде) не возникло каких-либо остаточных изменений. В противном случае процесс называется необратимым, например, переход механической энергии в тепловую под действием силы трения. Для осуществления обратного процесса требуется, чтобы остановившееся тело вновь пришло в движение за счет энергии, выделившейся при охлаждении его и окружающей среды. Опыты показывают, что хаотичное (тепловое) движение частиц тела не может самопроизвольно привести к возникновению упорядоченного движения всех частиц тела как единого целого. Для этого необходим компенсирующий процесс: отдача системой теплоты другому телу и совершение над ним работы. При этом система возвращается в исходное состояние, но есть остаточные изменения в окружающей среде. Таким образом, все процессы, сопровождаемые трением, являются необратимыми. Вообще реальные процессы можно считать обратимыми лишь, если они протекают достаточно медленно.
140
