
lection_part1-2
.pdfВискозиметр Оствальда-Пинкевича (В.Ф. Оствальд (1853–1932),
А.П. Пинкевич (1883–1939)) представляет собой U-образную стеклянную трубку (рис. 8.10) с двумя расширениями 1 и 2 и насосом 3, позволяющим перегнать жидкость из одного расширения в другое. Для двух жидкостей используются два идентичных вискозиметра. Так как путь l, проходимый жидкостями между расширениями одинаков, то, зная время (t и t0) истечения одинакового объема
(V=Qt=V0=Q0t0) жидкостей, из формулы (8.14) можно определить вязкость исследуемой жидкости:
|
Qt |
|
= |
|
|
ρ |
|
η0 |
|
|||
|
|
|
(8.14) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ρ |
|
, |
||
|
Q t |
0 |
|
|
η |
|
0 |
|||||
0 |
|
|
|
|
|
|
|
|
|
|||
откуда |
|
|
|
|
|
ρ0 t0 |
|
|||||
|
η =η |
0 |
|
(8.15) |
||||||||
|
|
|
|
|||||||||
|
|
|
|
|
|
|
ρ t |
|||||
|
|
|
|
|
|
|
|
|
|
|||
или |
|
|
|
|
|
|
t0 |
|
|
|
||
|
|
ξ =ξ |
0 |
|
|
(8.15') |
||||||
|
|
|
|
|||||||||
|
|
|
|
|
|
|
t , |
|
||||
приданнойтемпературеТ. Зависимостьξ=ƒ(T) (η=ƒ(T)) являетсянелинейной. Если шарик падает в жидкости, простирающейся безгранично по всем направлениям, не оставляя за собой никаких завихрений, то на него действует сила внутреннего трения, равная по закону (1851г.) Д.Г. Стокса
(1819–1903):
F = 6πηrv , |
(8.16) |
где r – радиус шарика;
ν – его скорость.
Если шарик свободно падает в вязкой жидкости, то на него будут действовать сила тяжести mg=ρШVg и выталкивающая сила (Архимеда)
FA=ρЖVg, равная весу вытесненной жидкости (V – объем шарика, ρШ–
плотность шарика, ρЖ – плотность жидкости). На основании второго зако-
на Ньютона с учетом соотношения (8.16) получают выражение
m |
∂v |
= ρ |
Ш |
Vg − ρЖVg −6πηrv . |
(8.17) |
|
∂t |
|
|
|
|
|
|
|
|
101 |
|
Сила сопротивления с увеличением скорости движения шарика возрастает, а ускорение уменьшается и, наконец, шарик достигает такой скорости, при которой ускорение становится равным нулю и тогда уравнение (8.17) принимает вид
3 |
πr3g(ρШ − ρЖ ) −6πηrv = 0 , |
(8.18) |
|||
4 |
|
|
|
|
|
где вместо объема подставили V = |
3 |
πr3 |
. В этом случае шарик движется |
||
|
|
4 |
|
|
|
с постоянной скоростью ν0. Такое движение шарика называется установившимся. Решая уравнение (8.18) относительно коэффициента внутреннего трения, получают
η = |
2(ρШ − ρЖ )r2 g |
(8.19) |
. |
||
|
9v0 |
|
Скорость шарика ν0 можно определить, зная расстояние l, пройденное шариком, и время t, за которое шарик проходит это расстояние: ν0=l/t. То-
гда из выражений (8.17) и (8.19) следует, что коэффициент вязкости равен
η = |
2(ρШ − ρЖ )r2 gt |
. |
(8.20) |
|
9l |
||||
|
|
|
Практически невозможно осуществить падение шарика в безграничной среде, т.к. всегда жидкость находится в каком-то сосуде, имеющем стенки и дно. Поэтому в формуле (8.20) вводится поправочный коэффициент
K = |
|
1 |
|
|
, |
1+ 2,4 |
r |
|
|||
|
R |
||||
|
|
|
|||
где R – радиус цилиндрического сосуда. Тогда формула (8.20) принимает вид
η = |
2(ρ |
Ш |
− ρ |
Ж |
)r2 gt |
. |
(8.21) |
|
|
|
r |
|
|||||
|
9l(1+ 2,4 |
) |
||||||
|
|
|
||||||
|
|
|
|
|||||
|
|
|
|
|
R |
|
|
|
102
8.5. Поверхностное натяжение в жидкостях. Капиллярные явления
(обзор (осн. понятия), более полно см. раздел физики «Молекулярная физика и термодинамика»)
На частицу (молекулу) жидкости действуют силы притяжения со стороны окружающих частиц. Если частица находится внутри жидкости и удалена от ее поверхности на расстояние больше радиуса сферы взаимодействия частиц, то эти силы в среднем уравновешиваются. Если же частица нахо-
дится в приграничном слое малой, сравнимой с радиусом действия частиц, толщины (например, в капле), то появляется результирующая сила,
направленная внутрь жидкости. Поэтому для извлечения молекулы из внутренних слоев на поверхность требуется совершить работу. Работа, ко-
торую надо затратить, чтобы изотермически и квазистатически увеличить поверхность жидкости на единицу при сохранении объема неизмен-
ным, называется поверхностным натяжением жидкости. По-другому,
поверхностное натяжение можно охарактеризовать как свободную поверхностную энергию жидкости, приходящуюся на единицу поверхности.
Жидкости характеризуются различными значениями поверхностного натяжения, поэтому в случае раствора, содержащего несколько компонентов, состав поверхностного слоя будет отличаться от состава раствора в его «объемной» части.
Любая система в неравновесном состоянии стремится перейти в равновесное состояние, характеризуемое минимумом свободной энергии. Для жидкости, не ограниченной стенками сосуда, формой с наименьшей поверхностью (и, следовательно, энергией) является шар. Получению шаровой (в невесомости) формы капли мешает сила тяжести. Потенциальная энергия в поле сил тяготения пропорциональна объему, а энергия поверхностного натяжения – площади поверхности капли. Чем больше объем, тем сильнее влияние силы тяжести, малые же капли практически шарообразны. На поверхности капли, как правило, имеют полусферическую форму, причем, чем больше капля растекается по поверхности твердого тела, образуя тонкую пленку, тем о лучшей смачиваемости поверхности данного тела (вещества) этой жидкостью говорят. Смачиваемостью поверхности сосуда жидкостью определяется форма ее поверхности (в случае несмачиваемости можно налить в стакан воду с горкой, не перелив воду через край стакана).
103
Капиллярами называют трубки малого внутреннего диаметра, что обусловливает яркое проявление действия сил поверхностного натяжения, например, в искажении формы поверхности жидкости в капилляре (она будет либо сферически – выпуклой для несмачиваемых поверхностей, либо сферически – вогнутой – для смачиваемых). В состоянии равновесия при искривлении формы поверхности на концах капилляра давления будут разными, т.е. будет появляться дополнительная разность давлений на концах, обусловленная поверхностным натяжением.
8.6. Движение тел в жидкостях и газах
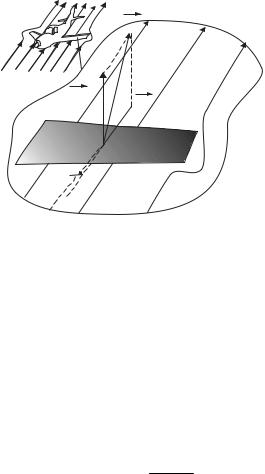
На тело, движущееся в жидкости или газе действует сила R,
являющаяся равнодействующей двух сил (рис. 8.10): RЛС (сила лобо-
вого сопротивленияr , направленная против движения тела в сторону потока) и RПС (подъемная сила, направленная перпендикулярно дви-
жению). При движении в идеальной жидкости Rлс=0.
R
Rпс  Rлс
Rлс
α
Рис. 8.11
Если тело симметрично, то Rпс=0, а если несимметрично и не имеет обтекаемой формы (плавно утончающейся хвостовой части), то пограничный слой вязкой среды «постоянно отрывается» от поверхности тела.
За телом образуется течение, направленное в противоположную набегающему потоку сторону (вихри, вращаются в противоположную сторону). Лобовое сопротивление зависит от формы и расположения тела относительно потока:
Rлс = C |
ρ v2 |
|
|
лс 2 |
S , |
(8.22) |
|
104
где Слс – экспериментально определяемый безразмерный коэффициент сопротивления;
S – наибольшее поперечное сечение тела.
Лобовое сопротивление можно значительно уменьшить подбором
обтекаемой формы, не способствующей завихрению. Подъемная сила определяется аналогичным образом:
R |
= C |
ρ v2 |
S , |
(8.23) |
|
2 |
|||||
пс |
пс |
|
|
где Спс – безразмерный коэффициент подъемной силы. Характеристикой крыла является качество крыла: K=Cпс/Слс. Для
крыла самолета (подводного крыла) требуется большая подъемная сила при малом лобовом сопротивлении, это условие хорошо выполняется при
малых углах атаки α (угол к встречному потоку).
МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА
ЛЕКЦИЯ 9. ОСНОВЫ МОЛЕКУЛЯРНОЙ ФИЗИКИ I
1.Основные понятия молекулярно-кинетической теории (МКТ)
итермодинамики.
2.Газовые законы. Уравнение (Менделеева–Клапейрона) состояния идеального газа (ИГ).
3.Основное уравнение МКТ.
4.РаспределениеДж.К.Максвелламолекулпоскоростямиэнергиям.
5.Барометрическая формула (распределение Больцмана).
9.1.Основные понятия молекулярно-кинетической теории
(МКТ) и термодинамики
Механика имеет дело с отдельными телами (обычно описывает движение не более трех тел). Молекулярная физика изучает системы, состоящие из огромного числа N (NA=6,02 1023 моль-1) непрерывно хаотически движущихся частиц.
Исследовать процессы в таких системах с помощью законов механики практически невозможно. Однако молекулярная физика и термодинамика выработали свои особые методы изучения таких систем. Существует
два общих подхода (метода):
105
-статистический – основывается на квантовой теории строения вещества и использует новые – статистические – закономерности, проявляющиеся только в коллективном поведении частиц системы; оперирует характеристиками отдельных частиц (скорость, энергия), используя их усреднение (наиболее вероятные значения) для описания всей системы;
-термодинамический (ТД) – изучает общие свойства макросистем (не вдаваясь в строение, происходящее внутри), находящихся в состоянии термодинамического равновесия; устанавливает соотношения между макропараметрами: обычно Р (давлением), V (объемом) и T (температурой) системы на основе обобщения большого числа опытных данных. Поэтому термодинамику часто называют феноменологической (от греч. «являющееся») теорией.
Оба подхода тесно связаны и хорошо дополняют, а в ряде случаев дублируют друг друга.
Дадим ряд определений.
Термодинамической системой (ТДС) называют мысленно выделенную совокупность тел (макросистему), которая рассматривается на основе ТД подхода. Открытая ТДС – ТДС, обменивающаяся с окружающей средой веществом и энергией, закрытая – только энергией. Напротив, изолированная ТДС (или замкнутая ТДС) – ТДС, не способная к обмену веществом и энергией с окружающей средой (идеальный случай, т.к. энергия может излучаться и поглощаться без соприкосновения изолированных тел, для замкнутой имеется ввиду неспособность обмениваться энергией через совершение механической работы). Адиабатная ТДС – замкнутая ТДС, не способная к обмену энергией с окружающей средой посредством теплообмена (реальные теплоизолированные системы с малым рассеянием теплоты).
ТД параметры делятся: на интенсивные, не зависящие от количе-
ства вещества в ТДС (P, T), и экстенсивные, зависящие и пропорциональные ему (V); на внешние, зависящие от положения и свойств внешних по отношению к ТДС тел (например, стенок сосуда – V), и внутренние, зависящие еще и от координат и скоростей частиц самой системы (Р, энергия).
В 1866г. австрийский физик Л.Больцман (1844–1906), будучи студентом, доказал, что величиной, характеризующей состояние ТДС независимо от ее микроскопической структуры, может быть средняя кинетическая энергия поступательного движения одной молекулы:
ε = |
3 kT , |
(9.1) |
|
2 |
|
где k – постоянная Больцмана, k=1,38 10-23 Дж/К; Т – термодинамическая температура (по шкале Кельвина (англ. У. Томсон (1824–1907), за научные заслуги лорд Кельвин)) – мера кинетической энергии (теплового движения) частиц вещества. В настоящее время в международной практике, наряду с термодинамической шкалой, принято использовать международную
106
практическую шкалу Цельсия (швед. A. Celsius (1701–1744)) Т=[t(°C)+273,15°]К. Считается, что при T=0 K – «нуль кельвин» – прекращается всякое движение. Такая температура не достижима, хотя воз-
можно сколь угодно близкое приближение к ней.
ТД равновесием называется состояние системы, характеризующееся при постоянных внешних условиях неизменностью параметров (P,V,T) и отсутствием потоков вещества и энергии в системе.
Равновесное состояние системы характеризуется следующими свойствами:
1)оно не зависит от предыстории системы (от предшествующих состояний);
2)переход системы в равновесное состояние необратим;
3)в равновесном состоянии реализуется определенное стационарное (не зависящее от времени) распределение молекул по скоростям.
ТД процессом называется любое изменение состояния системы, связанноес изменением хотябы одного термодинамического параметра. ТД процесс называется равновесным, если изменение состояния ТДС происходит при
t→∞ (время), т.е. каждое предыдущее состояние характеризуется мало отличающимися от последующего ТД параметрами (P,V,T). Реальные процессы имеют конечную скорость (время) протекания и не являются равновесными,
номогутбытьприближеннымикним– квазиравновесными.
Модель идеального газа (ИГ) основывается на трех допущениях:
–собственный объем молекул пренебрежимо мал по сравнению с объемом сосуда;
–силы взаимодействия между молекулами отсутствуют;
–столкновение молекул друг с другом и со стенками сосуда в процессе хаотического теплового движения носит упругий характер.
Модель ИГ с успехом применяется для описания реальных газов при
нормальных условиях (н.у.): P0=101325 Па=760 мм.рт.ст., Т0=273,15 К, а также при высоких температурах и низких давлениях. При иных условиях от уравнения ИГ можно перейти к теории реальных газов, вводя в эти уравнения поправки, учитывающие собственный объем молекул и силы взаимодействия между ними.
9.2.Газовые законы. Уравнение (Менделеева–Клайперона)
состояния ИГ
Простейшие примеры ТД процессов – изопроцессы (постоянной остается масса газа m=const и один из ТД параметров P, V или T). Они описываютсяэкспериментально установленнымизаконами:
а) изотермический (m=const, T=const) (рис.9.1, а) закон Бойля–Мариотта
(англ. Р. Бойль (1627–1691), фр. Э. Мариотт (1620–1684)):
107
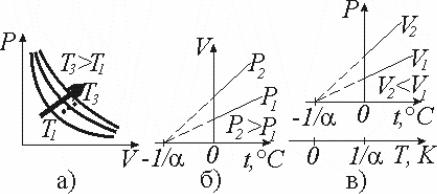
PV=const; |
(9.2) |
б) изобарный (m=const, P=const) (рис. 9.1, б) закон Ж.Л. |
Гей-Люссака |
(1778–1850): |
|
V=V0(1+αt). |
(9.3) |
При н.у. (Р0 и Т0) α=1/273,15 K-1;
в) изохорный (m=const, V=const) (рис. 9.1, в) закон Ж.Л. Гей-Люссака
(1778–1850):
P=P0(1+αt). |
(9.4) |
Выражая время t через температуру T законы Гей-Люссака можно переписать в виде:
V1 |
T1 |
|
P |
T |
|
|
= T |
|
1 |
1 |
|
V |
и |
|
= T . |
(9.5) |
|
P |
|||||
2 |
2 |
|
2 |
2 |
|
Рис. 9.1
Закон А. Авогадро (1776–1856): 1 моль любых газов при одинаковых температуре и давлении занимают одинаковый объем.
При н.у. молярный объем Vm=22,41 10-3 м3 (22,41 литра), а число частиц в одном моле любого газа NA=6,02 1023 моль-1.
Закон Дж. Дальтона (1766–1844): давление смеси газов равно сумме
n
парциальных давлений газов, входящих в эту смесь: P = ∑Pi .
i =1
Парциальное давление – то, которое производил бы газ, входящий в состав смеси, если бы занимал сам весь объем, занимаемый смесью.
Уравнением состояния или термическим уравнением состояния
называется функция f(P,V,T)=0, связывающая все макропараметры системы (ИГ). Получают его, следуя Б.П.Э. Клайперону (1799–1864) и Д.И.
Менделееву (1834–1907 гг.).
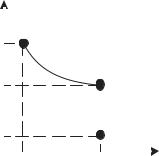
Изменение состояния ИГ в результате двух изопроцессов (сначала изотермического, а затем изохорного), изображено на рис. 9.2.
108
|
|
|
|
|
|
|
|
|
P/ |
= |
T |
|
Соответственно получают: P1V1=P'1V2 |
и |
1 |
1 |
. Исключая из |
||||||||
|
|
|
|
|
|
|
|
|
P |
|
T |
|
|
|
|
|
|
|
|
|
|
2 |
|
2 |
|
уравнений величину P'1, получают уравнение Клапейрона: |
||||||||||||
P1V1 = |
P2V2 = B = const . |
|
|
(9.6) |
||||||||
T1 |
|
T2 |
|
|
|
|
|
|
|
|||
P |
|
|
, |
, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
P1 |
|
|
P1 V1 T1 ,/ |
, |
|
|
|
|
|
|
||
P1 / |
|
|
|
P1 V2 |
T1 |
|
|
|
|
|
|
|
|
|
|
|
|
, |
, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
P2 |
|
|
|
|
P2 V2 T2 |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V1 |
V2 |
|
V |
|
|
|
|
|||
Рис. 9.2
Так как все состояния ИГ были выбраны произвольно, то уравнение (9.6) выполняется в любом ТД процессе для данной массы m ИГ (значение постоянной В зависит от природы газа).
Менделеев объединил уравнение Клапейрона с законом Авогадро. Так как при данных давлении и температуре газы занимают одинаковый объем, для одного моля газа можно записать:
PVm = RT , |
(9.7) |
где R– универсальная газовая постоянная, не зависящая от природы
ИГ R=k NA=8,31 Дж/(моль К).
Чтобы перейти к произвольной массе газа, заметим, что объем, который занимают v молей газа в v раз больше молярного объема Vm, т.е.
M |
Vm |
|
V=νVm (по пропорции m |
V |
(М – масса одного моля (молярная масса) |
газа) с учетом ν=m/M получают то же V=νVm). Тогда |
||
PVmv = vRT |
(9.8) |
|||
или |
m |
|
|
|
PV = |
RT . |
(9.8') |
||
M |
||||
|
|
|
||
109

Иногда уравнение (9.8) записывают в виде
P = |
kNAT |
= nkT , |
(9.9) |
|
|||
|
Vm |
|
|
где n – концентрация частиц вещества (атомов, молекул).
9.3.Основное уравнение МКТ
Врамках модели ИГ получим основное уравнение МКТ, связывающее давление газа с механическими характеристиками молекул – скоростью и энергией.
 ∆S
∆S
v∆t
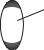
Рис. 9.3
Пусть одноатомный ИГ находится в сосуде; выделим малую площадь на стенках сосуда. Импульс, передаваемый площади ∆S одной молекулой при каждом соударении, равен (см. лекция 3, Теория удара): m0v1)=2m0v1, где v1 – нормальная составляющая скорости молекулы.
За время ∆t с площадкой ∆S столкнутся молекулы, заключенные в
объеме ∆V=∆Sν∆t. Далее непрерывное хаотическое движение молекул для упрощения расчетов заменяют на равновероятное движение молекул вдоль трех взаимно перпендикулярных направлений, считая, что вдоль каждого направления движется одна треть всех молекул со скоростью v. За время ∆t из тех молекул, что движутся перпендикулярно площади ∆S (рис. 9.3), столкнутся с ней половина (всего 1/6). Число молекул, которые соударяются с ∆S равно
N = 16 nV = 16 n∆Sv∆t .
Суммарный импульс, передаваемый площади ∆S, равен
∆p = ∆p0 N = 2m0v N = 13 m0nv 2∆S∆t .
Тогда давление газа определяют по формуле
P = |
F |
= |
∆p |
= |
1 m nv2 . |
(9.10) |
|
∆S |
∆t∆S |
||||||
|
|
|
3 0 |
|
110
