
lection_part1-2
.pdf
С точки зрения МКТ давление газа есть импульс, передаваемый его молекулами единице поверхности сосуда в единицу времени.
Молекулы газа движутся с различными скоростями, поэтому в вы-
ражении |
(9.10) |
должна стоять средняя скорость v = |
∑v / N , но при |
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ср |
i |
|
i |
|
|
|
||
этом |
к |
более точному значению приводит квадратичное |
усреднение |
||||||||||||||||||||||||||||||
v = |
1 |
∑v2 |
: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
N |
i |
i |
|
|
|
|
|
|
|
P = 1 m n < v |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
кв |
>2 |
. |
|
|
|
|
|
|
(9.11) |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Уравнение (9.11) – основное уравнение МКТ. Учитывая, что |
||||||||||||||||||||||||||||||||
n=N/V, |
уравнение (9.11) можно записать в виде: |
|
|
|
|
1 |
|
|
|
|
|||||||||||||||||||||||
|
РV = |
1 |
m0 N < v |
кв |
>2 |
= |
|
1 |
m < v |
кв |
>2 |
|
|
или |
РV |
|
= |
|
M < v |
кв |
>2 . |
||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
3 |
|
|
|||||||||||||||||||||||||||||
(9.12) |
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m |
|
3 |
|
|
||||||||||
С учетом уравнения (9.7) получают |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
< v |
кв |
>= |
3kN AT = |
3kT = |
3RT . |
|
|
|
|
|
|
(9.13) |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
m0 N A |
m0 |
|
|
M |
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
Для воздуха ( M = 29 10−3 кг/ моль ) |
|
< v |
кв |
>≈ 500м/ с. |
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Средняя кинетическая энергия поступательного движения одной мо- |
||||||||||||||||||||||||||||||||
лекулы: |
|
|
|
|
|
|
|
|
|
|
|
< vкв >2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
< ε >= |
m0 |
|
|
= |
E |
= |
3 kT . |
|
|
|
|
|
|
|
(9.14) |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
N |
2 |
|
|
|
|
|
|
|
|
|
|
|
||
Сучетом уравнения (9.14) основное уравнение МКТ можно записать
вследующем виде:
P = |
1 |
|
2 |
nm0 < v |
кв |
>2 |
= |
2 |
n < ε > . |
(9.15) |
|
3 2 |
3 |
||||||||||
|
|
|
|
|
|
||||||
При Т=0 К поступательное движение молекул прекращается и газ не оказывает давления на сосуд.
9.4. Распределение Дж.К.Максвелла молекул по скоростям и энергиям
Несмотря на то, что скорости всех молекул в процессе хаотического движения непрерывно меняют значения и направления, средняя скорость vкв остается постоянной при данной температуре (одна из статистиче-
111

ских, проявляющихся при наличии большого числа частиц в системе, закономерностей). Это объясняется тем, что в состоянии равновесия реализуется некоторое стационарное распределение молекул по скоростям, подчиняющееся определенному статистическому закону. Этот закон был получен Дж.К. Максвеллом (1831–1879) на основе теории вероятности. Функция (распределения Максвелла молекул по скоростям) f(v) определяет относительное число (долю) молекул dN/N, скорости которых находятся в интервале [v,v+dv]:
|
m |
|
|
3 |
2 |
− m0v 2 |
|
0 |
|
v2 e 2kT . |
(9.16) |
||||
f (v) = 4π |
|
|
|
|
|||
|
|
|
|
||||
|
2πkT |
|
|
|
|
||
По сути, функция распределения молекул по скоростям f(v) равна вероятности dW встречи в газе молекулы со скоростью, заключенной в интервале [v,v+dv]:
f (v) = |
dN |
dW |
|
||
|
= |
|
. |
(9.17) |
|
N dv |
dv |
||||
Вероятность же встречи молекулы |
со скоростью из интервала |
||||
(−∞;+∞)– событие достоверное – равна 1, т.е. |
|||||
|
+∞∫ f (v)dv =1 . |
(9.18) |
|||
|
−∞ |
|
|
|
|
Уравнение (9.18) – условие нормировки. |
|||||
f(v) |
T1<T2 |
|
|
|
|
|
|
|
|
dN(v) |
|
|
|
|
dS= |
N |
|
0 |
|
|
|
|
|
|
|
dv |
|
v |
|
|
v |
v< |
v < |
|
|
|
в< |
< кв |
|
|
|
Рис. 9.4
Функция распределения всегда однозначна (вероятность не может иметь несколько значений для данного значения какого-то параметра), конечна (вероятность конечное число).
Подробнее о статистических закономерностях и функциях распределения см. в разделе «Элементы квантовой физики».
Максимум зависимости (и вероятности) f(v) (рис. 9.4) будет соответствовать наиболее вероятному значению скорости vв. Данное значение можно получить, исследуя уравнение (9.16) на экстремум:
112
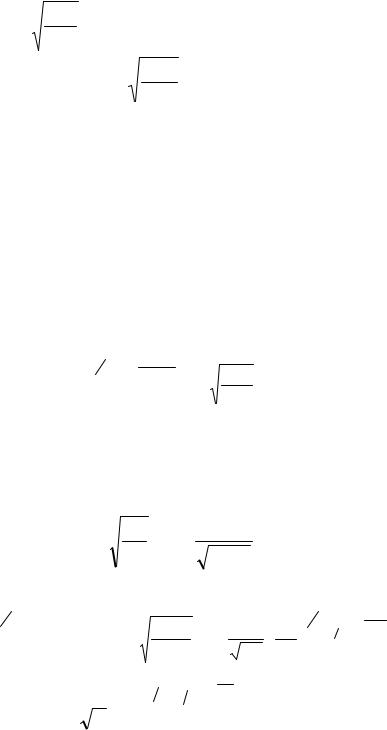
|
|
|
|
|
m |
v2 |
|
|
|
|
|
|
|
|
|
|
− |
m0v2 |
|
|
|
|
|
|
|
− |
m0v2 |
|
|
||
|
d |
|
− |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
2kT |
+ v2 |
|
|
m |
|
2kT |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
v2e |
|
2kT |
= 0 , откуда |
|
2ve |
|
|
|
|
|
|
− |
0 |
|
e |
|
2v = 0 , |
|||||||||||
|
dv |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2kT |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
что возможно при трех значениях: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
v = 0 , v = ∞ (min функции) и |
|
m0 v2 |
|
=1 (max функции – наиболее веро- |
|||||||||||||||||||||||||||
|
|
2kT |
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
2kT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
ятная скорость), т.е. v |
= |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
в |
|
m0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
или |
|
|
|
|
|
|
|
|
|
|
|
vв = |
|
|
|
2RT . |
|
|
|
|
|
|
|
(9.19) |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
M |
|
|
|
|
|
|
|
|
|
|
|
|
Для получения средней скорости используют методику, принятую в |
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
∞ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
статистической физике: < g(x) >= ∫ xf (x)dx . Подставляя |
x=v, f(x)=f(v) и |
||||||||||||||||||||||||||||||
|
|
|
|
|
∞ |
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dx=dv (< v >= ∫vf (v)dv ) |
и интегрируя с использованием табличного ин- |
||||||||||||||||||||||||||||||
теграла |
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
∞ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
∫x3e−αx2 dx = |
|
, |
|
|
|
|
|
|
(9.20) |
|||||||||||||
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
2α |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
получают среднюю скорость: |
|
|
|
|
|
|
|
|
|
m v2 |
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
∞ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
m |
|
|
|
|
3 |
2 |
|
|
− |
0 |
|
|
|
|
8RT |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
< v >= ∫v3 |
4π |
|
|
|
|
|
e |
|
|
2kT |
dv = |
|
|
|
. |
|
|
|
(9.21) |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
π M |
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
0 |
|
2π kT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Из |
формул |
(9.13), |
|
|
|
|
((9.19) |
|
и |
|
(9.21) |
следует, |
что |
|||||||||||||||||
< vкв >≈1,22vв; < v >≈1,13vв (рис. 9.4). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
Для получения функции распределения молекул по энергиям (ε)
необходимо в равенстве dN (v(ε)) = Nf (v(ε))dv (см. 9.20) провести, исходя
из уравнения ε = |
m |
v2 |
|
, замены v = |
|
2ε |
; dv = |
|
dε |
|
|
|
|
|
|
|
|
|
||||||||||||||
|
0 |
|
|
|
|
m0 |
|
|
|
. |
|
|
|
|
|
|
|
|||||||||||||||
|
2 |
|
|
|
|
2m0 |
ε |
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Тогда |
|
|
|
|
|
|
|
|
|
|
|
|
m0 |
|
2ε |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
m |
|
|
|
3 |
2 |
|
2ε |
|
− |
|
|
1 |
|
|
|
4 |
1 |
3 |
|
|
− |
ε |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|||||||||||||||||
0 |
|
|
|
|
|
|
2kT m0 |
|
|
|
|
|
|
|
kT dε |
|||||||||||||||||
f (v(ε))dv = 4π |
|
|
|
|
|
|
|
|
|
e |
|
|
|
|
dε = |
|
|
|
|
|
|
ε1 2e |
|
|||||||||
|
|
|
|
|
|
|
|
m0 |
|
2m0ε |
2π |
|
|
|
||||||||||||||||||
|
2πkT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
kT |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ε |
|
|
|
|
|
|
|
|
|
и |
|
|
|
|
|
|
|
|
dN(ε) |
|
2 |
|
|
|
−3 2 |
|
1 2 |
−kT |
. |
|
|
|
|
|
|
|
(9.25) |
|||||
|
|
f |
(ε) = |
|
Ndε |
|
= |
π |
|
(kT ) |
|
ε |
|
|
e |
|
|
|
|
|
|
|
|
|
||||||||
113
Находя среднее значение энергии аналогично (9.21), получают (9.1):
ε= 32 kT .
9.5.Барометрическаяформула(распределениеБольцмана)
До сих пор считалось распределение молекул в пространстве равномерным. Однако в действительности это не так, поскольку моле-
кулы газа всегда находятся в поле внешних сил, например, в поле тяготения. Силы тяготения удерживают атмосферу у поверхности земли, не давая ей рассеяться вследствие теплового движения в окружающем про-
странстве. В результате устанавливается некоторое стационарное рас-
пределение молекул, при котором давление и концентрация молекул (плотность) убывают с ростом высоты (атмосфера разрежается).
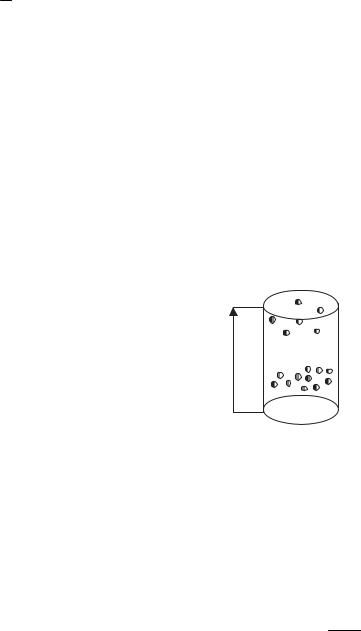
Найдем зависимости P=f(h) и n=f(h) в предположении однородного поля тяготения и постоянства температуры.
dh 










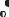 S
S



Рис. 9.5
Из уравнения Менделеева – Клапейрона
P = |
m RT |
= |
ρ R T |
, ρ = |
PM |
|||
|
|
|
|
. |
||||
V |
|
M |
M |
RT |
||||
Разность давлений на верхнее и нижнее основание мысленно выделенного цилиндра (рис. 9.5) равна весу столба воздуха, приходящемуся на единицу S основания, т.е. гидростатическому давлению P столбика dh:
dP = −ρ g dh = − PMRT g dh .
Знак «–» показывает, что давление убывает с ростом высоты. Разделяя в дан-
ном дифференциальном уравнении переменные |
dP |
= − |
Mgdh |
и интегрируя |
|||||||||||||
P |
RT |
||||||||||||||||
P dP |
h2 |
Mgdh |
|
|
P |
|
Mgh |
|
|
|
|
||||||
∫ |
|
|
= − ∫ |
|
, получают |
ln |
|
= − |
|
|
|
|
|
|
|
|
|
P |
|
RT |
P0 |
|
RT |
|
|
|
|
|
|
||||||
P0 |
h1 |
|
|
|
|
|
|
|
Mg∆h |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
− |
|
|
|
|
|
||
или |
|
|
|
P = P e |
RT |
|
|
|
(9.23) |
||||||||
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
114
Уравнение (9.23) – барометрическая формула Л.Больцмана
(1844–1906 гг.).
Так как по условию рассмотрения T=const, то из формулы (9.23) с учетом равенства (9.12) получают зависимость n=f(h) для концентрации:
|
n |
|
|
P |
= e− |
Mg∆h |
|
|
|
n = n 0 e − |
Mg ∆ h |
|
|||||||||
|
= |
|
|
RT |
|
|
|||||||||||||||
|
|
|
RT |
. |
(9.24) |
||||||||||||||||
|
|
|
|
||||||||||||||||||
|
n0 |
|
P0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Распределение (9.24) можно переписать в другом виде с учетом ра- |
|||||||||||||||||||||
венств M = m0 N A |
и R = kN |
A |
: |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
m0 g∆h |
|
|
U 0 |
|
|
|
|||
|
n = n0e |
− |
Mg∆h |
= n0e |
− |
= n0e |
− |
|
|
||||||||||||
|
|
RT |
|
|
|
|
kT |
|
|
kT , |
(9.25) |
||||||||||
где U0 – потенциальная энергия молекулы во внешнем силовом поле (тяготения).
ЛЕКЦИЯ 10. ОСНОВЫ МОЛЕКУЛЯРНОЙ ФИЗИКИ II
1.Эффективный диаметр молекулы. Среднее число столкновений и средняя длина свободного пробега.
2.Опыты Р. Броуна, О. Штерна, Элдриджа, Б. Ламмерта, Д. Миллера, П. Куша, Цартмана, Ж. Перренакакэкспериментальноеобоснование молекулярно-кинетической теории (МКТ).
3.Явления переноса (тепломассоперенос) в термодинамически неравновесных системах. Законы Фика, Фурье, Ньютона (внутреннее трение – вязкость – см. также лекция 8, вопрос 3).
4.Методы получения вакуума и свойства разреженных газов.
10.1. Эффективный диаметр молекулы. Среднее число столкновений и средняя длина свободного пробега
Конечные размеры молекул и высокая их концентрация приводит к тому, что в процессе хаотического теплового движения они непрерывно сталкиваются между собой, а в промежутках между двумя последовательными соударениями движутся равномерно и прямолинейно. Расстояние, которое проходит молекула между двумя соударениями, называется длиной сво-
бодного пробега. Эти расстояния могут быть сколь угодно различными, поэтому вводят понятие средней длины свободного пробега, которое является характеристикой всей совокупности молекул при данных P и T.
Получим выражение для средней длины.
Для этого введем ряд упрощений. Будем считать молекулы шариками, диаметра d~10-10 м, зависящего от химической природы вещества. При-
близительно оценить диаметр d молекулы при известных условиях (Р,V,T) можно следующим образом:
115
4 |
|
3 |
|
3 |
M |
|
ρ , |
Vm = M ρ = N AV0 = N A 3 |
π d |
|
d = 3 |
4 |
π N |
A |
|
|
|
|
|
|
|
|
где V0 – объем одной молекулы.
Минимальное расстояние d, на которое во время соударения сближаются центры двух молекул, называется эффективным диаметром мо-
лекулы.
d 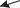
 <v>
<v>
d
Рис. 10.1
Подсчитаем среднее число столкновений, испытываемых молекулой в единицу времени. «Заморозим» все молекулы, кроме рассматриваемой, тогда с последней столкнутся те молекулы, центры которых отстоят от траектории рассматриваемой молекулы на расстоянии r≤d. Рассматриваемую молекулу можно считать движущейся внутри ломаного цилиндра ра-
диусом r (рис. 10.1). Среднее число столкновений в единицу времени,
может быть найдено как число молекул, заключенных внутри, рассматриваемого цилиндра:
<z >= |
n∆V |
= |
nS<v >∆t |
=n π d2 <v >. |
(10.1) |
|
∆t |
∆t |
|||||
|
|
|
|
Вообще число столкновений должно зависеть от относительной скорости vот молекул.
|
v1 |
α v2 |
|
|
|
|
|
|
|
|
vот |
|
|
|
|
|
|
|
|
Рис. 10.2 |
→ |
|
→ |
|
||
Пусть скорости молекул до соударения |
и |
соответственно. При |
||||||
v1 |
v2 |
|||||||
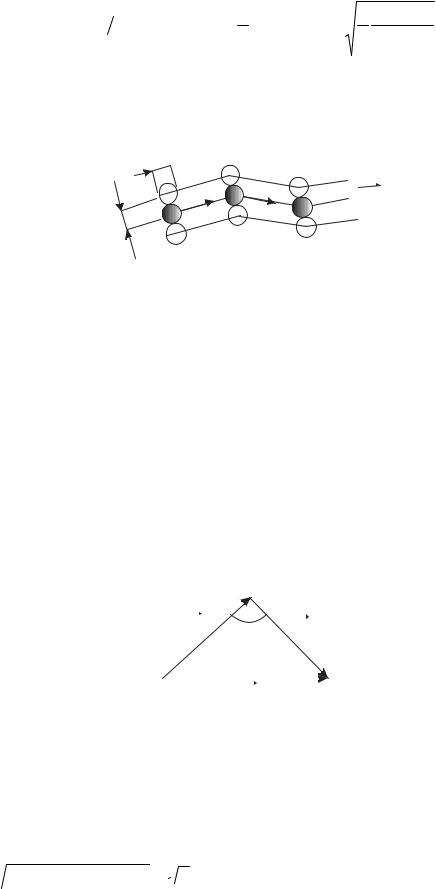
столкновении угол (рис. 10.2) между данными скоростями может прини-
мать любое значение: |
α > |
π |
; |
α < |
π |
, т.е. среднее значение функции |
|
|
2 |
|
|
2 |
|
<cosα > = 0. Относительная скорость
vот =  v12 + v22 − 2v1v2 cosα ≈
v12 + v22 − 2v1v2 cosα ≈  2 < v >. Поэтому уравнение (10.1) при учете движения других молекул следует записать в виде
2 < v >. Поэтому уравнение (10.1) при учете движения других молекул следует записать в виде
116
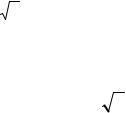
< z >= 2n π d2 <v >, |
(10.2) |
что точнее описывает действительность.
Из кинематики следует, что < z >=< v >< λ >, откуда средняя длина свободного пробега равна
< λ >=< z > / < v >=1/( 2n π d 2 ) . |
(10.3) |
Хотя реальное строение молекул гораздо сложнее, зависимости (10.2) и (10.3) дают значение, хорошо согласующееся с опытным. Подход с использованием эффективных диаметра d и сечения молекул оказывается достаточно точным.
10.2. Опыты Р. Броуна, О. Штерна, Элдриджа, Б. Ламмерта,
Д. Миллера, П. Куша, Цартмана, Ж. Перрена как экспериментальное обоснование молекулярно-кинетической теории
В 1827г. английский ботаник Р. Броун (1773–1858), наблюдая под микроскопом взвешенные в воде и газе частицы, обнаружил их непре-
кращающееся со временем непрерывное хаотическое (зигзагообраз-
ное) движение. Оживленность (интенсивность) названного впоследствии броуновским движения росла с увеличением температуры (т.к. уменьшается вязкость жидкости) и с уменьшением массы (размеров) взвешенных в жидкой или газообразной среде (броуновских) частиц независимо от химической природы их и среды. Французский ученый Ж. Перрен (1870–1942) наблюдал броуновское движение в двумерном случае – в плоскости – на поверхности мыльных пузырей.
Броуновское движение было объяснено на основе МКТ лишь спустя почти 80 лет как передача взвешенным в среде частицам импульса от сталкивающихся с ними в результате теплового движения молекул среды. Математическая теория броуновского движения была построена в 1905г.
А.Эйнштейном (1879–1955) и в 1906г. М.Смолуховским (1872–1917).
Экспериментальная проверка распределения (Дж.Максвелла) молекул по скоростям была проведена впервые (1920г., испарение серебра) немецким физиком О.Штерном (1888–1969) и (1921г., термоэлектронная эмиссия с поверхности разогретого металла в вакуум) американским физиком О.У.Ричардсоном (1879–1959), а затем (1927г., испарение кадмия) Элд-
риджом, (1926–1929гг., испарение ртути) Б.Ламмертом (1892–1957), (1955г., испарение калия и таллия) Д.К.Миллером (1866–1941) и
П.Кушем (р.1911г.), (испарение висмута) Цартманом.
117

3  21
21
 s
s
Рис. 10.3
В ставшем классическим опыте Штерна покрытая серебром платиновая проволока (рис.10.3), располагавшаяся вдоль осей цилиндров 2, 3,
после откачки из цилиндра 3 воздуха до давления ~ 10−5 −10−6 мм.рт.ст. нагревалась в результате прохождения по ней электрического тока до тем-
пературы выше точки плавления ( 960,8 −961,9o С ) серебра (max до 1200°С). Атомы серебра, испаряясь, осаждались на охлаждаемых стенках цилиндра 3. Если цилиндры покоились, то изображение щели получалось четким, а если цилиндр 3 вращался (n~2500–2700мин-1), то размытым. При этом ско-
рость s = vτ , где v =ω R – линейная скорость точек поверхности вращающегося цилиндра 3 радиуса R; τ = l / v – время прохождения атома-
ми серебра |
расстояния вдоль пунктирного криволинейного участка дли- |
ной l. Тогда |
s =ω Rl / v v =ω Rl / s . Опыты Штерна дали значения |
560–640 м/c, близкие к значению средней квадратичной скорости (584 м/с согласно МКТ, (см. формулу9.13).
S1 |
S2 |
A |
P |
|
D1 D2 |
Рис. 10.4
Элдридж и Ламмерт на базе опытов Штерна и А.И.Л.Физо (1819– 1896) (опыт по измерению скорости света, 1851г., см. раздел «Оптика») разработали селекторы скоростей атомов в пучке (рис. 10.4). Атомы металла, испаряясь в печи А, вылетают наружу и через систему диафрагм (щелей) S1, выделяющих узкий атомный пучок, попадают на прорези зубчатого диска D1 и далее на прорези диска D2, смещенные относительно
прорезей D1 на малый угол (α ~ 2o ). Когда диски покоятся, атомы, проходя прорези D1, задерживаются на зубцах D2. Когда же диски вращаются, ато-
118
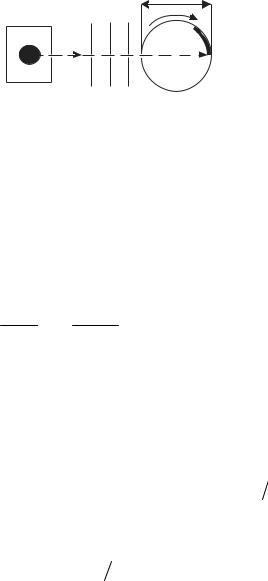
мы с определенными скоростями будут достигать приемника Р (охлаждаемой жидким азотом стеклянной пластины, наблюдаемой в микроскоп и/или фотометрически). Максимум прохождения будет наблюдаться тогда, когда за
время пролета атомами расстояния между дисками они повернутся на угол α
(при угловой скорости вращения дисков ω). Меняя скорость ω, можно изучать в пучке распределение атомов по скоростям. Однако максимум прохождения будет наблюдаться и для атомов с большими скоростями при
α+2π, α+4π, т.д. или, другими словами, для кратных угловых скоростей вращения дисков 2ω, 3ω, т.д. Для выделения атомов с одной, характер-
ной именно для данной ω скоростью v, Миллер и Куш вместо зубчатых дисков использовали сплошные цилиндры с вырезанными вдоль образующих цилиндра под малым угломα к ним узкими винтовыми канавками. По канав-
кам могут пройти атомы, для которых tgα = ω R / v (R – радиус цилинд-
ра).
d
|
|
2 |
A |
S |
1 |
C |
Рис. 10.5
В опытах Цартмана (рис. 10.5) атомы, испаряясь из печи А и проходя через систему диафрагм (щелей) S, попадают в неподвижном цилиндре в точку 1, а во вращающемся с угловой скоростью ω – в точку 2. Это происходит вследствие затраты атомами, обладающими конечной скоростью v, времени на прохождение расстояния, равного диаметру цилиндра d.
Точка попадания смещается от точки 1 к 2 по поверхности цилиндра на расстояние l = vT = ω2d T = ω2vd 2 . В окрестность точки 1 попадают
атомы с наибольшими скоростями, а в окрестность точки 2 – с наименьшими. По истечении 10 часов предварительно фотометрированную стеклянную пластинку 12 вновь фотометрируют. В предположении реализации в печи для атомов в парах металла распределения Максвелла по скоростям можно рассчитать плотность распределения вещества на пластинке 12.
Широкую известность получили также опыты Ж.Перрена (1908–
1911гг.) по определению постоянной Авогадро |
( NA = k R ) на основе рас- |
||
пределения Больцмана (9.24). Из формулы (9.24) следует, что |
|||
k = |
(m0 − mж)gh |
. |
(10.4) |
|
|||
|
Tln (n1 n2 ) |
|
|
119
Параметры, входящие в формулу (10.4), определялись следующим образом.
Взвешенные в жидкости частицы вещества совершают броуновское движение. Берется жидкость с плотностью немного меньшей плотности вещества частиц, тогда поле тяжести будет сильно ослаблено архимедовой подъемной силой и возникнет «атмосфера» – распределение частиц, подобное существующему в атмосфере Земли. Потенциальная энергия частицы при этом определяется как потенциальная энергия частицы вещества m0 в однородном поле тяготения за вычетом потенциальной энергии опускающегося объема (массы mж) жидкости, которую вытесняет частица при подъеме под действием архимедовой силы. Путем растирки и растворения мастики спиртом и водой и последующего центрифугирования Перрен получил однородную эмульсию с практически одинаковыми размерами и массой взвешенных частиц, легко определяемыми экспериментально с помощью микроскопа (визуально). Визуально определялось также и среднее изменение концентрации в различных микрослоях капли эмульсии (по двум направлениям – вдоль и поперек капли).
Результаты вышеописанных опытов полностью подтверждают основные положения молекулярно-кинетической теории (МКТ).
10.3. Явления переноса (тепломассоперенос) в термодинамически неравновесных системах. Законы Фика, Фурье, Ньютона (внутреннее трение – вязкость – см. также лекция 8, вопрос 3)
Ранее были даны определение и свойства равновесного состояния и термодинамического (ТД) равновесия и ТД системы (лекция 9, вопрос 1). Равновесные состояния реализуются в ТДС только в отсутствие потоков. Если существуют неоднородности – области, в которых значения характеризующих среду величин (концентрация (плотность), скорость частиц, температура среды) отличаются от значений в соседних областях, то возникают явления переноса – потоки вещества (диффузия), энергии (теплопроводность, теплопередача), импульса (внутреннее трение – вязкость, см. лекция 8, вопрос 3). Под потоком обычно понимают передачу количества чего-либо (энергии, массы, импульса) в единицу времени через единичную площадку. Потоки при самопроизвольном (без внешнего воздействия) протекании процессов всегда направлены в сторону областей с меньшим значением энергии, концентрации (плотности) и импульса и приводят к выравниванию значений этих величин, характеризующих состояние среды.
Вследствие подобия условий все явления переноса описываются сходными по форме записи опытными законами. В общем виде можно записать:
120
