
- •Образования «национально-исследовательский томский политехнический университет»
- •Глава 1. Основы микробиологии
- •1.1. Морфология микроорганизмов .1.1. Систематика и номенклатура микроорганизмов
- •1.1.2. Формы бактерий
- •1.1.3. Структура бактериальной клетки и методы ее исследования
- •Включения Нефотоситезирцющие Основные
- •1.1.4. Морфология микробов-эукариотов: дрожжевых и плесневых грибов
- •Зкзоспоры
- •1.1.5. Методы микроскопического исследования микроорганизмов
- •Электронная микроскопия
- •1.2. Физиология микроорганизмов 1.2.1. Питание бактерий
- •1.2.2. Питательные среды
- •1.2.3. Условия культивирования бактерий
- •1.2.4. Дыхание бактерий
- •1.2.5.Ферменты бактерий
- •1.2.6. Культуральные свойства бактерий
- •1.2.6. Выделение чистых культур микроорганизмов
- •Глава 2. Химические основы жизни
- •2.1. Липиды
- •2.1.1. Жирные кислоты и родственные липиды
- •Глава 7. Сельскохозяйственная биотехнология 360
- •Глава 8. Экологическая биотехнология 368
- •2.1.2. Жирорастворимые витамины, стероиды и другие липиды
- •2.2. Сахара и полисахариды
- •2.2.2. Дисахариды и полисахариды
- •2.3. Белки
- •2.3.1. Биологические функции белков
- •2.3.2. Белковые аминокислоты и полипептиды
- •2.3.3. Структура белков
- •Первичная структура белков
- •Глава 7. Сельскохозяйственная биотехнология 360
- •Глава 8. Экологическая биотехнология 368
- •Глава 7. Сельскохозяйственная биотехнология 360
- •Глава 8. Экологическая биотехнология 368
- •2.4.5. Биосинтез нуклеиновых кислот и белков (матричные биосинтезы)
- •I I аденин
- •Глава 3. Технологические основы биотехнологических производств
- •3.1. Процессы в биотехнологии
- •3.4. Контроль и управление биотехнологическими процессами; моделирование и оптимизация
- •Глава 4. Генная инженерия
- •4.3. Получение фармакологических препаратов с помощью методов генной инженерии
- •4.3.1. Биосинтез инсулина человека в клетках кишечной палочки
- •4.3.2. Биосинтез соматотропина и других гормонов человека
- •4.3.3. Получение интерферонов
- •4.3.4. Получение иммуногенных препаратов и вакцин
- •4.3.5. Другие области применения генной инженерии
- •1. Новые методы диагностики и исследований
- •2. Генная инженерия и белковая инженерия ферментов
- •3. Получение бактерий для деградации токсикантов и ксенобиотиков
- •5. Биоматериалы
- •4.5. Преимущества и опасность генной инженерии
- •4.5. Меры безопасности
- •Глава 5. Промышленная микробиология
- •5.1. Производство первичных метаболитов
- •5.1.1. Производство аминокислот
- •5.1.2. Производство органических кислот
- •5.1.3. Получение витаминов
- •5.2. Производство вторичных метаболитов
- •5.3. Производство белков одноклеточных и многоклеточных
- •5.3.1. Производство белка одноклеточных организмов
- •5.3.2. Производство грибного белка (микопротеина)
- •5.3.3. Производство цианобактерий
- •Глава 6. Инженерная энзимология
- •6.1. Методы получения иммобилизованных ферментов
- •6.1.1. Физические методы иммобилизации
- •6.1.2. Химические методы иммобилизации ферментов
- •Носитель Вставка Фермент Иммобилизованный фермент
- •6.2. Применение иммобилизованных ферментов
- •6.3. Промышленные процессы с использованием иммобилизованных ферментов
- •6.3.1. Разделение рацемических смесей аминокислот
- •6.3.2. Производство кукурузного сиропа с высоким содержанием
- •Глава 7. Сельскохозяйственная биотехнология
- •7.1. Биопестициды
- •7.1.1. Технология получения бактериальных энтомопатогенных
- •7.1.2. Технология получения грибных энтомопатогенных
- •7.1.3. Технология получения вирусных энтомопатогенных препаратов
- •7.2. Биологические удобрения
- •7.2.1. Технология получения сухого нитрагина
- •7.2.2. Технология получения сухого азотобактерина
- •7.2.3. Технология получения фосфоробактерина
- •Глава 8. Экологическая биотехнология
- •8.1. Аэробная биологическая очистка сточных вод
- •8.1.1. Основные характеристики сточных вод
- •8.1.2. Процессы с участием активного ила
- •8.1.3. Аэробная обработка ила
- •8.1.4. Вторичная очистка сточных вод с помощью капельных биологических фильтров
- •8.2. Анаэробная переработка отходов
- •1Связь, a-мальтоза
6.1.2. Химические методы иммобилизации ферментов
Главным отличительным признаком химических методов иммобилизации является то, что путем химического воздействия на структуру фермента в его молекуле создаются новые ковалентные связи, в частности, между белком и носителем.
Иммобилизация ферментов путем образования новых ковалент- ных связей между ферментом и носителем - наиболее массовый способ получения промышленных биокатализаторов. В отличие от физических методов этот способ иммобилизации обеспечивает прочную и необратимую связь фермента с носителем и часто сопровождается стабилизацией молекулы энзима. Однако расположение фермента относительно носителя на расстоянии одной ковалентной связи создает стерические трудности в осуществлении каталитического процесса. Фермент отделяют от носителя с помощью вставки, в роли которой чаще всего выступают бифункциональные и полифункциональные агенты (бромциан, гидразин, глутаровый диальдегид и др.) (рис. 6.2).
Рис.
6.2. Схема иммобилизации фермента
химическим методом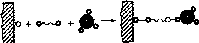
Носитель Вставка Фермент Иммобилизованный фермент
Принципиально важно, чтобы в иммобилизации фермента участвовали функциональные группы, не существенные для его каталитической функции. Так, гликопротеины обычно присоединяют к носителю через углеводную, а не через белковую часть молекулы фермента.
Число методических приемов, разработанных для осуществления ковалентной иммобилизации ферментов, исключительно велико. Все методы химической иммобилизации классифицируют в зависимости от природы реакционной группы носителя, вступающей во взаимодействие с молекулой фермента. Ниже представлен ряд примеров, иллюстрирующих некоторые способы химической иммобилизации ферментов.
Иммобилизация ферментов на носителях, обладающих гидроксигруппами
—OCN —OH
H
H
H
—OH
цианат
носитель
CNBr
_O^C=NH имидокарбонат
H |
—O-C—NH— |
Ф |
—OH |
|
O
производное
уретана
Ф
H2N-
H |
—O-C-NH— |
Ф |
—OH |
|
производное
изомочевины
NH
Иммобилизация ферментов на носителях, обладающих аминогруппами
Первичные аминогруппы носителя, связанные с ароматическим кольцом, предварительно превращают в соли диазония, которые затем подвергают разнообразным реакциям сочетания. В реакции сочетания вступают фенольные, аминные, гуанидиновые, тиольные группы белков. Так, в щелочной среде фенольные радикалы тирозина образуют прочные азосоединения, в составе которых белок связан с носителями:
H
\\
//
-N=N +
HO-
фенольный радикал фермента
HO
азосоединение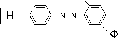
Иммобилизация ферментов на носителях, обладающих активированными производными карбоксильной группы
![]()
W
//
Ф
соль диазония
тивированные эфиры и другие производные карбоновых кислот. Например:
O
о
-о
H
;о
р
Cl
-о
H
—C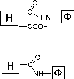
Иммобилизация на носителях, обладающих сульфгидрильными группами
Сульфгидрильные группы носителя и фермента легко окисляются с образованием дисульфидных связей под действием кислорода воздуха:
[O]
H —sh + sh—[ф - H — s-s—[ф]
Иммобилизация путем химического присоединения биокатализатора к носителю отличается высокой эффективностью и прочностью связи. Несмотря на это, методы ковалентной иммобилизации ферментов все еще малодоступны для промышленного использования в связи со сложностью и дороговизной их применения. Однако они остаются незаменимыми инструментами в практике проведения научных и лабораторных исследований по созданию энзимов с контролируемыми свойствами.
Препараты иммобилизованных ферментов, полученные с применением химических методов, обладают по крайней мере двумя важными достоинствами. Во-первых, ковалентная связь фермента с носителем обеспечивает высокую прочность образующегося конъюгата. Иными словами, при достаточно широком варьировании условий, таких, как рН и температура, фермент не десорбируется с носителя и не загрязняет целевых продуктов катализируемой им реакции. Это особенно важно при реализации процессов медицинского и пищевого назначения, а также для обеспечения устойчивых, воспроизводимых результатов в аналитических системах. Во-вторых, химическая модификация ферментов способна приводить к существенным изменениям их свойств, таких, как субстратная специфичность, каталитическая активность и стабильность. Именно химическими методами путем многоточечного ковалентного закрепления белковой структуры удается достигнуть наибольших эффектов стабилизации ферментов.
