
- •Образования «национально-исследовательский томский политехнический университет»
- •Глава 1. Основы микробиологии
- •1.1. Морфология микроорганизмов .1.1. Систематика и номенклатура микроорганизмов
- •1.1.2. Формы бактерий
- •1.1.3. Структура бактериальной клетки и методы ее исследования
- •Включения Нефотоситезирцющие Основные
- •1.1.4. Морфология микробов-эукариотов: дрожжевых и плесневых грибов
- •Зкзоспоры
- •1.1.5. Методы микроскопического исследования микроорганизмов
- •Электронная микроскопия
- •1.2. Физиология микроорганизмов 1.2.1. Питание бактерий
- •1.2.2. Питательные среды
- •1.2.3. Условия культивирования бактерий
- •1.2.4. Дыхание бактерий
- •1.2.5.Ферменты бактерий
- •1.2.6. Культуральные свойства бактерий
- •1.2.6. Выделение чистых культур микроорганизмов
- •Глава 2. Химические основы жизни
- •2.1. Липиды
- •2.1.1. Жирные кислоты и родственные липиды
- •Глава 7. Сельскохозяйственная биотехнология 360
- •Глава 8. Экологическая биотехнология 368
- •2.1.2. Жирорастворимые витамины, стероиды и другие липиды
- •2.2. Сахара и полисахариды
- •2.2.2. Дисахариды и полисахариды
- •2.3. Белки
- •2.3.1. Биологические функции белков
- •2.3.2. Белковые аминокислоты и полипептиды
- •2.3.3. Структура белков
- •Первичная структура белков
- •Глава 7. Сельскохозяйственная биотехнология 360
- •Глава 8. Экологическая биотехнология 368
- •Глава 7. Сельскохозяйственная биотехнология 360
- •Глава 8. Экологическая биотехнология 368
- •2.4.5. Биосинтез нуклеиновых кислот и белков (матричные биосинтезы)
- •I I аденин
- •Глава 3. Технологические основы биотехнологических производств
- •3.1. Процессы в биотехнологии
- •3.4. Контроль и управление биотехнологическими процессами; моделирование и оптимизация
- •Глава 4. Генная инженерия
- •4.3. Получение фармакологических препаратов с помощью методов генной инженерии
- •4.3.1. Биосинтез инсулина человека в клетках кишечной палочки
- •4.3.2. Биосинтез соматотропина и других гормонов человека
- •4.3.3. Получение интерферонов
- •4.3.4. Получение иммуногенных препаратов и вакцин
- •4.3.5. Другие области применения генной инженерии
- •1. Новые методы диагностики и исследований
- •2. Генная инженерия и белковая инженерия ферментов
- •3. Получение бактерий для деградации токсикантов и ксенобиотиков
- •5. Биоматериалы
- •4.5. Преимущества и опасность генной инженерии
- •4.5. Меры безопасности
- •Глава 5. Промышленная микробиология
- •5.1. Производство первичных метаболитов
- •5.1.1. Производство аминокислот
- •5.1.2. Производство органических кислот
- •5.1.3. Получение витаминов
- •5.2. Производство вторичных метаболитов
- •5.3. Производство белков одноклеточных и многоклеточных
- •5.3.1. Производство белка одноклеточных организмов
- •5.3.2. Производство грибного белка (микопротеина)
- •5.3.3. Производство цианобактерий
- •Глава 6. Инженерная энзимология
- •6.1. Методы получения иммобилизованных ферментов
- •6.1.1. Физические методы иммобилизации
- •6.1.2. Химические методы иммобилизации ферментов
- •Носитель Вставка Фермент Иммобилизованный фермент
- •6.2. Применение иммобилизованных ферментов
- •6.3. Промышленные процессы с использованием иммобилизованных ферментов
- •6.3.1. Разделение рацемических смесей аминокислот
- •6.3.2. Производство кукурузного сиропа с высоким содержанием
- •Глава 7. Сельскохозяйственная биотехнология
- •7.1. Биопестициды
- •7.1.1. Технология получения бактериальных энтомопатогенных
- •7.1.2. Технология получения грибных энтомопатогенных
- •7.1.3. Технология получения вирусных энтомопатогенных препаратов
- •7.2. Биологические удобрения
- •7.2.1. Технология получения сухого нитрагина
- •7.2.2. Технология получения сухого азотобактерина
- •7.2.3. Технология получения фосфоробактерина
- •Глава 8. Экологическая биотехнология
- •8.1. Аэробная биологическая очистка сточных вод
- •8.1.1. Основные характеристики сточных вод
- •8.1.2. Процессы с участием активного ила
- •8.1.3. Аэробная обработка ила
- •8.1.4. Вторичная очистка сточных вод с помощью капельных биологических фильтров
- •8.2. Анаэробная переработка отходов
- •1Связь, a-мальтоза
4.5. Меры безопасности
Генетическая инженерия с момента зарождения привлекла внимание ученых и широких кругов общественности потенциальной опасностью некоторых исследований. Это опасение было высказано в 1974 г., вскоре после первых успешных экспериментов по получению рекомби- нантных молекул ДНК. Группа известных молекулярных биологов во главе с П. Бергом призвала ученых к ограничению проведения ряда генно-инженерных экспериментов. Характер высказанных опасений был двоякого рода. Во-первых, указывалось на реальную возможность «утечки» клеток с рекомбинантными молекулами ДНК за пределы лабораторий или промышленных производств и, следовательно, угрозу внесения в организм человека или животных вредных чужеродных либо «собственных» продуктов (например, гормонов), но в неконтролируемых концентрациях. Во-вторых, отсутствие достаточных знаний о структуре и функциях генов, находящихся в клонируемом фрагменте ДНК, может привести к тому, что при внесении их в реципиентные клетки они начнут синтезировать не только желаемое вещество, но и какие-либо опасные продукты (например, токсины, продукты онкогенов, т. е. генов, чьи продукты обладают способностью трансформировать эукариотические клетки так, что они приобретают свойства опухолевых клеток).
В 1975 г. данные проблемы обсуждались на Международной конференции, посвященной вопросам получения рекомбинантных молекул ДНК. В ней приняли участие ученые разных областей биологии, а также юристы, представители прессы, государственных и частных промышленных компаний. Участники конференции пришли к выводу, что эксперименты с использованием методов генетической инженерии должны продолжаться, но при обязательном соблюдении определенных правил и рекомендаций.
В настоящее время в России работы генно-инженерного плана регулируются федеральным законом, принятым в 1996 г. Они подразделяются на два типа - ведущиеся в «закрытых» или «открытых» системах. В закрытых системах работы ведутся так, что имеется химический, биологический или физический барьер между генно-инженерными организмами и окружающей средой. В открытых системах такой контакт осуществляется (например, культивирование генно-инженерных овощей и злаков).
Глава 5. Промышленная микробиология
5.1. Производство первичных метаболитов
Первичные метаболиты - низкомолекулярные соединения, необходимые для роста микробов: одни из них являются строительными блоками макромолекул, другие - участвуют в синтезе коферментов. Среди наиболее важных для промышленности первичных метаболитов можно выделить аминокислоты, органические кислоты, нуклеотиды и витамины.
5.1.1. Производство аминокислот
Производство аминокислот в мире постоянно растет и в настоящее время составляет около 400 тыс. тонн/год, хотя потребность в них оценивается гораздо выше.
Как уже отмечалось, недостаток в рационе аминокислот (особенно, незаменимых) отрицательно сказывается на росте и развитии. Так, добавка к кормам животных нескольких долей % дефицитной кислоты может повысить кормовую ценность белка более чем в два раза.
Из всех возможных способов получения аминокислот (химическим путем, микробиологическим и др.) предпочтение отдается микробиологическому: хотя организацию микробного производства нельзя назвать простой, ее преимущество состоит в синтезе оптически чистых (L-аминокислот), тогда как при химическом синтезе получается рацемическая смесь L- и D-аминокислот, которую трудно разделить.
Микробный синтез аминокислот основан на культивировании строго определенного продуцента целевой кислоты в среде заданного состава при строго определенных параметрах ферментации. Продуцентами являются штаммы бактерий, полученные мутантной селекцией или с помощью методов генной инженерии. Бактерии-мутанты, с одной стороны, утратили способность самостоятельно синтезировать некоторые вещества, а с другой стороны, приобрели способность к сверхсинтезу целевой аминокислоты. Уже к 70-м годам прошлого века были получены микробы-суперпродуценты из родов Brevibacterium, Corynebacterium, Micrococcus и др. с помощью которых возможно производить все известные аминокислоты. В настоящее время имеются суперпродуценты, у которых количество синтезируемого специфического белка достигает 10-50 % (здесь важнейшую роль играют многокопийные плазмиды, несущие встроенные гены).
Технология получения аминокислот базируется на принципах ферментации продуцентов и выделения первичных метаболитов, т. е. размножают маточную культуру вначале на агаризованной среде в про
бирках, затем - на жидкой среде в колбах, инокуляторах и посевных аппаратах, а затем - в основных ферментаторах.
Если аминокислота предусмотрена в качестве добавки к кормам, то биотехнологический процесс кормового продукта включает следующие стадии: ферментацию, стабилизацию аминокислоты в культураль- ной жидкости перед упариванием, вакуум-упаривание, стандартизацию упаренного раствора при добавлении наполнителя, высушивание и упаковку готового продукта, в котором должно содержаться не более 10 % основного вещества. Если же аминокислота используется в качестве лекарственного препарата, в этом случае получают изолированные чистые кристаллы, которые высушивают под вакуумом и упаковывают.
Известны два способа получения аминокислот: одноступенчатый и двухступенчатый. Согласно первому способу, например, мутантный ауксотрофный штамм - продуцент аминокислоты - культивируют на оптимальной для биоситеза среде. Целевой продукт накапливается в куль- туральной жидкости, из которой его выделяют согласно определенной технологической схеме.
II
ступень
Микроб - продуцент аминокислоты
культивирование в жидкой питательной среде
I ступень
Биосинтез предшественников аминокислоты и ферментов, катализирующих биосинтез целевого продукта
Биосинтез целевого продукта с участием ферментов
Аминокислота - целевой продукт
Если ферменты биосинтеза аминокислоты накапливаются внутри- клеточно, то после 1-й ступени клетки сепарируют, дезинтегрируют и применяют клеточный сок. В других случаях для целей биосинтеза целевых продуктов применяют непосредственно клетки.
Получение лизина
Типичными продуцентами L-лизина являются бактерии Brevibac- terium flavum и Corynebacterium glutamicum.
Чтобы добиться образования лизина в больших количествах, получают мутанты двух типов. У мутантов первого типа не синтезируется или не функционирует гомосериндегидрогеназа, в результате чего блокируется синтез метионина и треонина. Такие мутанты являются ауксо- трофами по гомосерину или треонину (метионину); внутриклеточная концентрация треонина у них существенно снижена, что снимает блокаду с аспартаткиназы. Поэтому при выращивании мутантных штаммов в среде, где присутствуют лимитирующие концентрации метионина и треонина, они способны образовывать избыточные количества лизина. Мутанты второго типа дефектны по структурному гену, детерминирующему конформацию аспартаткиназы. В итоге фермент теряет чувствительность к высоким концентрациям аллостерического ингибитора — лизина.
Важный фактор, обеспечивающий в культуральной среде высокие концентрации аминокислоты, синтезированной внутри клетки, — проницаемость клеточных мембран. Проницаемость клеточной мембраны увеличивают либо с помощью мутаций, либо путем изменения состава питательной среды. В последнем случае в культуральной среде создают дефицит биотина (1 - 5 мкл/л), добавляют пенициллин (2 - 4 мкг/л), детергенты (твин-40 и твин-60) или производные высших жирных кислот (пальмитаты, стеараты). Биотин контролирует содержание в клеточной мембране фосфолипидов, а пенициллин нарушает биосинтез клеточных стенок бактерий, что повышает выделение аминокислот в среду.
Для культивирования штаммов микроорганизмов при производстве аминокислот как источники углерода наиболее доступны углеводы - глюкоза, сахароза и реже фруктоза и мальтоза. Для снижения стоимости питательной среды в качестве источников углерода используют вторичное сырье: свекловичную мелассу, молочную сыворотку, гидролизаты крахмала, сульфитные щелока. Технология этого процесса совершенствуется в направлении разработки дешевых синтетических питательных сред на основе уксусной кислоты (до 1,5%), пропионовой кислоты, метанола, этанола (до 1 %) и н-парафинов. В качестве источников азота применяют мочевину и соли аммония (сульфаты и фосфаты). Для успешного развития микроорганизмы нуждаются в стимуляторах роста, в качестве которых выступают экстракты кукурузы, дрожжей и солодовых ростков, гидролизаты отрубей и дрожжей, витамины группы В. Кроме того, в питательную среду добавляют необходимые для жизнедеятельности макро- и микроэлементы (Р, Са, Mg, Mn, Fe и др.). На процесс биосинтеза аминокислот существенное влияние оказывает снабжение воздухом, при этом степень аэрации индивидуальна для производства каждой конкретной аминокислоты. Стерильный воздух подается специальными турбинными мешалками (рис. 5.1).
Рис.
5.1. Технологическая схема получения
кормового препарата лизина:
-
подача свекловичной мелассы; 2 - водная
суспензия кукурузного экстракта и
питательных солей; 3 - нагревательная
колонка; 4, 5 - теплообменники; 6 - посевные
аппараты; 7 - подача посевного материала;
8 - система фильтров для очистки и
стерилизации воздуха; 9 - ферментер;
10 - фильтры для очистки отходящих
газов;
-
получение монохлоридгидрата лизина;
12 - подача соляной кислоты; 13, 14 - выход
и подогрев монохлоридгидрата лизина;
15 - выпаривательная установка; 16 -
сборник ЖКЛ; 17 - смешивание ЖКЛ с
наполнителем; 18 - распылитель; 19 -
подача горячего воздуха; 20 - очиститель
воздуха; 21 - отделение сухого препарата
лизина от воздуха; 22 - приемник ККЛ.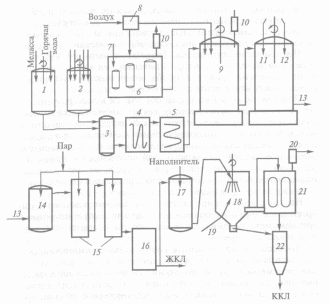
Опыты показали, что лизин появляется в культуральной среде, начиная с середины экспотенциальной фазы роста культуры клеток микроорганизма, и достигает максимума к ее концу. Поэтому на первой стадии технологического процесса формируют биомассу продуцента, которую выращивают в специальных посевных аппаратах в течение суток (рН 7,0 - 7,2; температура 28 - 30 °С), а затем подают в производственный ферментер, заполненный питательной средой. Лизин начинает поступать в культуральную жидкость через 25 - 30 ч после начала ферментации. По завершении процесса ферментации (через 55 - 72 ч) жидкую фазу отделяют от культуры клеток микроорганизма фильтрованием и используют для выделения из нее лизина.
Высокоочищенные препараты лизина получают после фракционирования фильтрата культуральной жидкости методом ионообменной хроматографии на катионите. С этой целью лизин переводят в форму катиона:
NH3
+ (CH2)4
h3n-ch-cooh
Для данного процесса фильтрат обрабатывают соляной кислотой до рН 1,6 - 2,0 (рН < pKj). Обладая двумя положительно заряженными ионогенными группировками, лизин прочно сорбируется на смоле и элюируется с нее в виде индивидуального соединения 0,5 - 5 %-ном раствором гидроксида аммония после выхода всех других катионов. Элюат концентрируют в вакууме при температуре 60 °С, переводят в форму монохлоргидрата, после чего высушивают и дополнительно чистят с помощью перекристаллизации. В результате получают препараты кристаллического лизина 97 - 98 %-й чистоты, которые используют для повышения питательной ценности пищевых продуктов и в медицинской промышленности.
Кроме высокоочищенных препаратов лизина получают иные виды его товарной формы: жидкий концентрат лизина (ЖКЛ), сухой кормовой концентрат лизина (ККЛ) и высококонцентрированные кормовые препараты, характеризующиеся относительно меньшей степенью очистки в сравнении с первым препаратом.
Получение глутаминовой кислоты
cooh (ch2)2 hon-ch-cooh
Глутаминовая кислота - это первая аминокислота, полученная микробиологическим путем. Мутантов, обеспечивающих сверхсинтез этой кислоты, не получено, а «перепроизводство» этой аминокислоты связано с особыми условиями, при которых нарушается синтез мембранных фосфолипидов. Глутаминовая кислота синтезируется исключительно культурами Corynebacterium glutamicum и Brevibacterium flavum.
Субстратами для ее получения являются глюкоза и уксусная кислота, а в начале 60-х гг. прошлого столетия использовали и н-парафины. Особые условия для роста культур создаются добавлением к культу- ральной жидкости пенициллина, который подавляет синтез клеточной стенки, или уменьшением (по сравнению с оптимальной) концентрации биотина (витамина В7) в среде, который индуцирует структурно- функциональные изменения в клеточной мембране, благодаря чему увеличивается ее проницаемость для глутаминовой кислоты, выходящей из клетки в культуральную жидкость. В Японии с помощью селекции выделены температурозависимые штаммы бактерий (термофилы), которые продуцируют высокое содержание глутаминовой кислоты при повышенных температурах: в таких условиях достигают 50 %-го превращения используемого источника углерода в глутаминовую кислоту.
Натриевая соль глутаминовой кислоты широко применяется в пищевой промышленности для улучшения вкуса продуктов питания в консервированном и замороженном виде.
