
- •Введение
- •1. Строение и свойства материалов
- •1.1. Классификация материалов
- •Плазма газ жидкость твердое тело
- •1.2. Кристаллическое строение материалов
- •1.3. Дефекты кристаллического строения
- •1.3.1. Точечные дефекты
- •1.3.2. Линейные дефекты
- •1.3.3. Поверхностные и объемные дефекты
- •1.4. Свойства материалов и методы их испытаний
- •2. Кристаллизация металлов и сплавов
- •2.1. Гомогенная и гетерогенная кристаллизация
- •2.2. Строение металлического слитка
- •2.3. Выращивание монокристаллов
- •2.3.1. Получение монокристаллов из расплава
- •2.3.2. Получение монокристаллов из раствора
- •2.3.2. Получение монокристаллов из паровой фазы
- •2.4. Аморфные металлические сплавы
- •3. Деформация и разрушение металлов
- •3.1. Упругая и пластическая деформация
- •3.2 Деформация моно- и поликристаллов
- •3.3. Влияние температуры на структуру деформированного металла
- •4. Основы теории двойных сплавов
- •4.1. Строение сплавов
- •4.2. Диаграммы состояния двойных сплавов
- •4.3. Диаграмма состояния железоуглеродистых сплавов
- •4.4. Углеродистые стали
- •4.5. Чугуны
- •5. Основы термической обработки стали
- •5.1. Основные превращения в стали
- •5.2. Отжиг стали
- •5.3. Закалка и отпуск
- •6. Поверхностное упрочнение деталей
- •6.1. Упрочнение методом пластической деформации
- •6.2. Упрочнение методом поверхностной закалки
- •6.3. Химико-термическая обработка
- •7. Легированные стали
- •7.1. Влияние легирующих элементов на структуру и свойства
- •7.2. Маркировка и классификация легированных сталей
- •7.3. Конструкционные стали
- •7.4. Инструментальные стали
- •7.5. Стали с особыми свойствами
- •8. Цветные металлы и сплавы
- •8.1. Титан и его сплавы
- •8.2. Алюминий и его сплавы
- •8.3. Магний и его сплавы
- •8.4. Медь и ее сплавы
- •8.5. Другие цветные металлы и сплавы
- •8.6. Материалы с памятью формы
- •9. Неметаллические и композиционные материалы
- •9.1. Полимеры
- •9.2. Пластмассы
- •9.3. Композиционные материалы
- •9.4. Керамические материалы
- •10. Материалы с особыми электрическими свойствами
- •10.1. Физическая природа электропроводности
- •10.2. Факторы, влияющие на удельное сопротивление
- •10.3. Материалы высокой проводимости
- •10.4. Сверхпроводящие металлы и сплавы
- •10.5. Материалы с высоким сопротивлением
- •10.6. Металлы и сплавы различного назначения
- •10.7. Материалы для припоев
- •11. Материалы с особыми магнитными свойствами
- •11.1. Классификация веществ по магнитным свойствам
- •11.2. Природа ферромагнитного состояния
- •11.3. Процессы намагничивания ферромагнетиков
- •Магнитная проницаемость, определяемая по формуле
- •11.4. Классификация магнитных материалов
- •11.4.1. Магнитомягкне материалы
- •Высокочастотные магнитомягкие материалы.
- •11.4.2. Магнитотвердые материалы
- •Заключение
- •Литература
- •Оглавление
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ
ТОМСКИЙ ПОЛИТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
А. Г. Мельников, И. А. Хворова, Е. П. Чинков
МАТЕРИАЛОВЕДЕНИЕ
Рекомендовано в качестве учебного пособия Редакционно-издательским советом Томского политехнического университета
Издательство
Томского политехнического университета
2012
УДК 620.22(075.8)
ББК 30.3я73
М482
Мельников А.Г.
М482 Материаловедение: учебное пособие / А.Г. Мельников, И.А. Хворова, Е.П. Чинков; Национальный исследовательский Томский политехнический университет. − Томск: Изд-во Томского политехнического университета, 2012. – 200 с.
В учебном пособии в краткой форме изложены закономерности формирования структуры и свойств металлических и неметаллических материалов, используемых в приборостроении. Большое внимание уделено фундаментальным основам теории и технологии термической обработки металлических материалов. Учебное пособие соответствует программе дисциплины и предназначено для студентов немашиностроительных специальностей, обучающихся по направлениям: 200400 «Оптотехника», 200300 «Биомедицинская инженерия», 200500 «Метрология, стандартизация и сертификация», 221400 «Управление качеством», 550200 «Автоматизация и управление», 652000 «Мехатроника и робототехника».
УДК 620.22(075.8)
ББК 30.3я73
Рецензенты
Доктор технических наук, профессор,
старший научный сотрудник Института физики
прочности и материаловедения СО РАН Б. П. Гриценко
Главный инженер ООО «Томский
инструментальный завод».
Н. В. Коробейников
© ГОУ ВПО «Национальный исследовательский Томский политехнический университет», 2012
© Мельников А.Г., Хворова И.А., Чинков Е.П. 2012
© Оформление. Издательство Томского политехнического университета, 2012
Введение
Получение, разработка новых материалов и способы их обработки являются основой современного производства, уровень развития которого определяет научно-технический и экономический потенциал страны. Проектирование конкурентно-способных изделий, организация их производства невозможны без достаточного уровня знаний в области материаловедения и технологии конструкционных материалов.
Материаловедение – наука о строении и свойствах металлических и неметаллических материалов, их взаимосвязи и возможности изменения для рационального использования в технике.
Разнообразие свойств материалов является главным фактором, предопределяющим их широкое применение в технике. В современной технике имеется огромное количество различных устройств, машин и механизмов, строительных конструкций, приборов, оборудования и инструментов, которые работают в жестких условиях износа, а также воздействия высоких нагрузок, агрессивных сред, высоких и низких температур. Для того чтобы обеспечить их работоспособность, надежность и долговечность, инженер должен иметь представление о возможности формирования необходимых свойств современных материалов, уметь ориентироваться во множестве вариантов и владеть основами знаний, необходимых при выборе материала для конкретных деталей и изделий. Кроме того, инженер должен знать возможности прогнозирования необходимых свойств используемых материалов и изготавливаемых из них деталей и изделий.
В таких технических отраслях как электротехника и радиоэлектроника качество материалов становится ключом к разработке сложных инженерных решений и созданию новейшей электронной аппаратуры. Применяемые металлические и неметаллические материалы должны обладать особыми физическими свойствами: электрическими, магнитными, тепловыми и т. д. Знание свойств материалов и закономерностей зависимости этих свойств от физической природы, структуры, состава, технологических и эксплуатационных факторов позволяет специалисту не только грамотно выбирать материал при проектировании электротехнических устройств, но и грамотно эксплуатировать их.
1. Строение и свойства материалов
1.1. Классификация материалов
Материал – вещество (совокупность веществ), из которого изготовлено техническое изделие, имеющее функциональное значение.
Конструкционные материалы – материалы, из которых изготавливаются детали машин и конструкций, работающих под нагрузкой.
Материалы классифицируют: по природе – на металлические, неметаллические и композиционные; по технологическому признаку – на деформируемые, литые, свариваемые и др.; по условиям работы – на работающие при низких и высоких температурах, износостойкие и др.; по прочности – на материалы низкой, средней и высокой прочности.
Металлические материалы классифицируют: по основному компоненту сплава – на алюминиевые, медные, никелевые, на железной основе и др.; по типу упрочнения – на закаливаемые, азотируемые и др.; по структурному составу – на одно-, двух- и многофазные. Черные металлы – железо и сплавы (стали, чугуны) с содержанием железа не менее 50 %. Цветные – металлы и их сплавы, имеющие естественную окраску (медь, алюминий, титан и др.). Благородные – золото, серебро, платина и др. Редкоземельные – лантан, неодим, празеодим и др.
Неметаллические материалы подразделяют по изомерному составу и технологическому исполнению (прессованные, тканые, намотанные, формованные и др.), по типам наполнителей (армирующих элементов) и характеру их размещения и ориентации. Пластмассы – материалы на основе высокомолекулярных соединений – полимеров, чаще всего с добавками. Керамические материалы (керамики) – порошки тугоплавких соединений: карбиды, окислы, нитриды, бориды. Керамико-металлические (керметы) – керамика с добавлением металлической связки. Стекла – окислы различных элементов.
Композиционные материалы состоят из металлической или неметаллической матрицы (основы) с заданным распределением упрочнителей и подразделяются на: дисперсноупрочненные – полученные введением в матрицу дисперсных (мелких) частиц; волокнистые – упрочненные непрерывными волокнами и нитевидными кристаллами; слоистые – созданные путем прессования, прокатки разнородных материалов.
Химические связи делятся на ковалентные, ионные, металлические и молекулярные. Ионная связь возникает при полном или частичном обмене валентными электронами, ковалентная – при частичном. Металлическая связь по природе ковалентная, но обобществляется множество электронов. Силы Ван-дер-Ваальса возникают без обмена зарядами.
М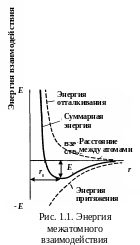 ежатомное
взаимодействие.
Движущими силами объединения частиц
вещества (твердого, жидкого, газообразного)
являются силы взаимного притяжения и
отталкивания. Зная характер взаимодействия
между атомами, можно прогнозировать
свойства материалов. Потенциальная
энергия взаимодействия двух атомов
зависит от расстояния r
между ними и может быть представлена в
виде суммы потенциалов притяжения и
отталкивания (рис.
1.1).
Энергия
притяжения в системе ион-электрон
является причиной металлической связи
и проявляется при всех значениях r.
Энергия отталкивания связана с деформацией
электронных оболочек ионов и проявляется
только на малых расстояниях. Величина
r0
– равновесное расстояние между атомами.
Энергию связи Eс
можно оценить как работу, которую
необходимо затратить, чтобы оторвать
атом и
удалить в бесконечность.
ежатомное
взаимодействие.
Движущими силами объединения частиц
вещества (твердого, жидкого, газообразного)
являются силы взаимного притяжения и
отталкивания. Зная характер взаимодействия
между атомами, можно прогнозировать
свойства материалов. Потенциальная
энергия взаимодействия двух атомов
зависит от расстояния r
между ними и может быть представлена в
виде суммы потенциалов притяжения и
отталкивания (рис.
1.1).
Энергия
притяжения в системе ион-электрон
является причиной металлической связи
и проявляется при всех значениях r.
Энергия отталкивания связана с деформацией
электронных оболочек ионов и проявляется
только на малых расстояниях. Величина
r0
– равновесное расстояние между атомами.
Энергию связи Eс
можно оценить как работу, которую
необходимо затратить, чтобы оторвать
атом и
удалить в бесконечность.
Ковалентная (гомеополярная) связь возникает между нейтральными атомами за счет перекрытия электронных облаков. Обычно осуществляется двумя электронами с противоположно направленными спинами. В пространстве между атомами электроны создают состояния с повышенной электронной плотностью. Отрицательный заряд стремится сблизить ядра атомов. Если электронная плотность распределена симметрично между атомами, то ковалентную связь называют неполярной, смещена в сторону одного из них – полярной. Насыщенность связи – ограниченное число внешних электронов между ядрами образует ограниченное число химических связей. Направленность в пространстве проявляется в одинаковом геометрическом строении близких по составу химических частиц. Особенность связи – поляризуемость. Ковалентные кристаллы – в основном полупроводники и диэлектрики.
Ионная (гетерополярная) связь образуется за счет электростатического взаимодействия противоположно заряженных ионов, которое не зависит от направления. О связи говорят как о ненаправленной и ненасыщенной. В ионных кристаллах не существует отдельных молекул, «молекулой» считается весь кристалл. Энергия связи – несколько электронвольт. Ионные кристаллы, в основном диэлектрики, имеют высокие температуры плавления, прозрачны в широком диапазоне частот. Идеальной ионной связи нет. Полного перехода электронов от одного атома к другому не происходит, они частично остаются в общем пользовании. Например, в кристалле LiF химическая связь на 80 % ионная, на 20 % – ковалентная. Правильно надо говорить о степени ионности (полярности) ковалентной химической связи.
Металлическая связь. В кристаллической решетке металла внешние электроны покидают атомы, превращая их в катионы. Электростатическое взаимодействие обусловлено отталкиванием ионов (электронов) друг от друга и притяжением ионов и электронов. Электроны стремятся приблизить катионы, уравновешивая силы отталкивания. Благодаря свободным электронам металлы хорошо проводят электрический ток и тепло. При нагревании колебания катионов увеличиваются, электронам труднее продвигаться между ними и электрическое сопротивление металла увеличивается. Металлическая связь существует в твердом, расплавленном и аморфном состоянии металлов.
Атомы ионизированы не полностью, часть валентных электронов остается связанной. Появление ионной и ковалентной составляющих связи между соседними атомами обнаружено во многих металлах.
Молекулярная связь. Взаимодействие молекул не приводит к разрыву или образованию новых связей. Отдельные молекулы связаны слабыми ван-дер-ваальсовыми силами. В полярных молекулах центры тяжести положительного и отрицательного зарядов не совпадают и они ориентируются так, чтобы рядом находились концы молекул с противоположными зарядами. Возникает ориентационное взаимодействие – притяжение. Индукционное взаимодействие возникает между полярными и неполярными молекулами. Неполярная молекула поляризуется и становится полярной, молекулы притягиваются слабее, чем в случае полярных молекул. Дисперсионное взаимодействие возникает между неполярными молекулами. При движении электроны создают состояния с повышенной электронной плотностью с одной стороны молекулы. Неполярная молекула становится полярной. Это вызывает перераспределение зарядов в соседних молекулах, между ними устанавливаются кратковременные связи. Если бы молекулы только притягивались, то это привело бы к слиянию. На малых расстояниях электронные оболочки отталкиваются – межмолекулярное отталкивание. Эти же силы удерживают молекулы друг около друга и в жидкостях, поэтому молекулярные кристаллы относительно легко плавятся или даже возгоняются (возгонка – переход вещества из твердого состояния в газообразное, минуя жидкое). Если температура ниже точки плавления или возгонки, то молекулы собираются в упорядоченные каркасы, каждая из которых ориентирована в пространстве определенным образом. Молекулярные кристаллы – это молекулы с насыщенными связями (O2, N2, CO2, H2O), атомы инертных газов (Ar, Ne, Kr, Xe). В электрическом отношении молекулярные кристаллы – диэлектрики.
В реальных кристаллах химические связи в чистом виде встречаются редко: имеет место их наложение. Одна из них преобладает, определяя структуру и свойства твердого тела.
Рождение материала происходит в направлении усложнения структуры (рис. 1.2), отражает определенные уровни его строения
