
- •Образования «национально-исследовательский томский политехнический университет»
- •Глава 1. Основы микробиологии
- •1.1. Морфология микроорганизмов .1.1. Систематика и номенклатура микроорганизмов
- •1.1.2. Формы бактерий
- •1.1.3. Структура бактериальной клетки и методы ее исследования
- •Включения Нефотоситезирцющие Основные
- •1.1.4. Морфология микробов-эукариотов: дрожжевых и плесневых грибов
- •Зкзоспоры
- •1.1.5. Методы микроскопического исследования микроорганизмов
- •Электронная микроскопия
- •1.2. Физиология микроорганизмов 1.2.1. Питание бактерий
- •1.2.2. Питательные среды
- •1.2.3. Условия культивирования бактерий
- •1.2.4. Дыхание бактерий
- •1.2.5.Ферменты бактерий
- •1.2.6. Культуральные свойства бактерий
- •1.2.6. Выделение чистых культур микроорганизмов
- •Глава 2. Химические основы жизни
- •2.1. Липиды
- •2.1.1. Жирные кислоты и родственные липиды
- •Глава 7. Сельскохозяйственная биотехнология 360
- •Глава 8. Экологическая биотехнология 368
- •2.1.2. Жирорастворимые витамины, стероиды и другие липиды
- •2.2. Сахара и полисахариды
- •2.2.2. Дисахариды и полисахариды
- •2.3. Белки
- •2.3.1. Биологические функции белков
- •2.3.2. Белковые аминокислоты и полипептиды
- •2.3.3. Структура белков
- •Первичная структура белков
- •Глава 7. Сельскохозяйственная биотехнология 360
- •Глава 8. Экологическая биотехнология 368
- •Глава 7. Сельскохозяйственная биотехнология 360
- •Глава 8. Экологическая биотехнология 368
- •2.4.5. Биосинтез нуклеиновых кислот и белков (матричные биосинтезы)
- •I I аденин
- •Глава 3. Технологические основы биотехнологических производств
- •3.1. Процессы в биотехнологии
- •3.4. Контроль и управление биотехнологическими процессами; моделирование и оптимизация
- •Глава 4. Генная инженерия
- •4.3. Получение фармакологических препаратов с помощью методов генной инженерии
- •4.3.1. Биосинтез инсулина человека в клетках кишечной палочки
- •4.3.2. Биосинтез соматотропина и других гормонов человека
- •4.3.3. Получение интерферонов
- •4.3.4. Получение иммуногенных препаратов и вакцин
- •4.3.5. Другие области применения генной инженерии
- •1. Новые методы диагностики и исследований
- •2. Генная инженерия и белковая инженерия ферментов
- •3. Получение бактерий для деградации токсикантов и ксенобиотиков
- •5. Биоматериалы
- •4.5. Преимущества и опасность генной инженерии
- •4.5. Меры безопасности
- •Глава 5. Промышленная микробиология
- •5.1. Производство первичных метаболитов
- •5.1.1. Производство аминокислот
- •5.1.2. Производство органических кислот
- •5.1.3. Получение витаминов
- •5.2. Производство вторичных метаболитов
- •5.3. Производство белков одноклеточных и многоклеточных
- •5.3.1. Производство белка одноклеточных организмов
- •5.3.2. Производство грибного белка (микопротеина)
- •5.3.3. Производство цианобактерий
- •Глава 6. Инженерная энзимология
- •6.1. Методы получения иммобилизованных ферментов
- •6.1.1. Физические методы иммобилизации
- •6.1.2. Химические методы иммобилизации ферментов
- •Носитель Вставка Фермент Иммобилизованный фермент
- •6.2. Применение иммобилизованных ферментов
- •6.3. Промышленные процессы с использованием иммобилизованных ферментов
- •6.3.1. Разделение рацемических смесей аминокислот
- •6.3.2. Производство кукурузного сиропа с высоким содержанием
- •Глава 7. Сельскохозяйственная биотехнология
- •7.1. Биопестициды
- •7.1.1. Технология получения бактериальных энтомопатогенных
- •7.1.2. Технология получения грибных энтомопатогенных
- •7.1.3. Технология получения вирусных энтомопатогенных препаратов
- •7.2. Биологические удобрения
- •7.2.1. Технология получения сухого нитрагина
- •7.2.2. Технология получения сухого азотобактерина
- •7.2.3. Технология получения фосфоробактерина
- •Глава 8. Экологическая биотехнология
- •8.1. Аэробная биологическая очистка сточных вод
- •8.1.1. Основные характеристики сточных вод
- •8.1.2. Процессы с участием активного ила
- •8.1.3. Аэробная обработка ила
- •8.1.4. Вторичная очистка сточных вод с помощью капельных биологических фильтров
- •8.2. Анаэробная переработка отходов
- •1Связь, a-мальтоза
2.3.3. Структура белков
Способность белков выполнять различные биологические функции обусловлена тем, что белки могут существовать в самых различных конформациях. Принято подразделять их структуру на три уровня, а при наличии нескольких полипептидных цепей рассматривают еще и четвертый уровень.
Таблица 2.3
Структура белков
1.
Первичная
Последовательность
аминокислотных остатков, соединенных
пептидными связями
2.
Вторичная
Способ
расположения полимерной цепи в
пространстве, обусловленный
водородными связями между NH-
и COOH- группами,
близко расположенными в последовательности
аминокислотными остатками
3.
Третичная
Складывание
и сгибание полипептидной цепи,
обусловленное водородными, ионными
и ковалентными (дисульфид- ными)
связями между радикалами аминокислот,
часто далеко расположенных друг
от друга
4.
Четвертичная
Характер
упаковки полипептидных цепей;
структура стабилизируется теми
же силами, что и третичная
Первичная структура белков
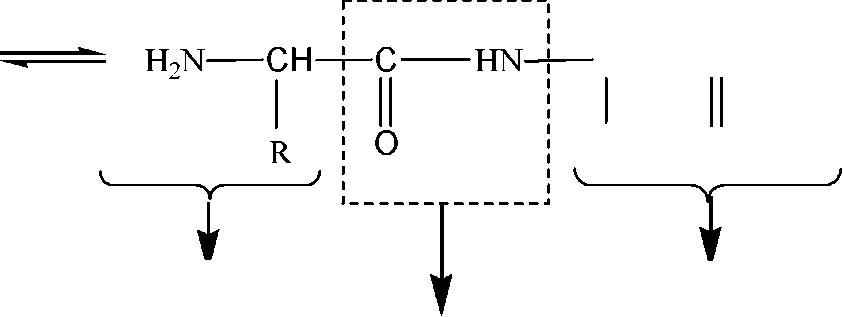
Первичной структурой называют порядок чередования (последовательность) аминокислотных остатков в белке.
Белки построены из остатков a-аминокислот, соединенных между собой пептидной связью, которая образуется между a-карбоксильной группой одной аминокислоты и a-аминогруппой другой аминокислоты:
CH C OH
h2n-
+
H2-
R
O
R
0
CH C OH
+ H2O
N-концевая
аминокислота
C-концевая
аминокислота
пептидная
связь
Ri
0
Структуру белков принято изображать, начиная с N-концевой аминокислоты.
Даже идентичные по длине и аминокислотному составу пептиды могут быть разными веществами. Например, из двух аминокислот Gly и Met можно построить два дипептида Gly-Met и Met-Gly. Из трех разных аминокислот можно получить шесть различных по структуре три-
18
пептидов. При n=20 число возможных изомеров равно 2-10 , а если учесть, что одна аминокислота может встречаться более одного раза, то число изомеров является невообразимым. Однако в живой природе реализуются не все возможности, так, например, в организме человека имеется только около 100 тыс. белков.
Вторичная структура
Вторичная структура белков обусловлена образованием водородной связи между амино- и карбоксильной группами соседних аминокислотных остатков:
hn
Известно два типа вторичной структуры: a-спираль и b-структура (складчатый слой, складчатый листок).
Рис.
2.1. Молекулярная модель полипептидной
цепи, свернутой в a-спираль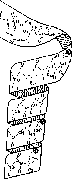
В складчатом слое (b-структура) пептидные связи располагаются параллельно друг другу в один слой, образуя фигуру, подобную листу, сложенному гармошкой. Слой может быть образован двумя или большим количеством пептидных цепей; смежные цепи в слое ориентированы N-концами в противоположные стороны (антипараллельно) или в одну сторону (параллельно). Слой может быть образован двумя или большим количеством пептидных цепей:
—h-"o=c^ch'r \_h"
Л.В. Тимощенко, М.В. Чубик 1
ОСНОВЫ БИОТЕХНОЛОГИИ Учебное пособие 1
O OH 54
(3'_^5') T-A-T-T-C-C-A-G 167
к о д 181
Pi ' 196
1. Новые методы диагностики и исследований 233
2. Генная инженерия и белковая инженерия ферментов 233
3. Получение бактерий для деградации токсикантов и ксенобиотиков 237
5. Биоматериалы 238
ГЛАВА 5. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ 244
Аминокислота - целевой продукт 248
h3n-ch-cooh 252
Бродильные процессы 254
Окислительные процессы 256
Классификация антибиотиков 269
Основные этапы промышленного получения антибиотиков 271
ГЛАВА 6. ИНЖЕНЕРНАЯ ЭНЗИМОЛОГИЯ 326
Иммобилизация ферментов адсорбцией: 335
Иммобилизация ферментов путем включения в гели 338
Иммобилизация ферментов микрокапсулированием 339
