
- •Чухрій ю.П., Щербакова в.Г. Хімія.: Посібник до практичних занять. Частина 2. Одеська державна академія холоду, 2011. - 91 .
- •1. Хімічна рівновага
- •1.1. Оборотність хімічних реакцій
- •1.2. Хімічна рівновага
- •1.3. Константа хімічної рівноваги
- •1.4. Розрахунки концентрацій рівноважних систем
- •1.5. Порушення хімічної рівноваги
- •2. Концентрація розчиненої речовини
- •3. Іонно-молекулярні (іонні) реакції обміну
- •3.1. Визначення поняття йонних реакцій
- •3.2. Напрям протікання йонних реакцій
- •3.3. Складання рівнянь йонних реакцій
- •3.4. Скорочене йонне рівняння
- •4. Водневий показник
- •5. Гідроліз солей
- •5.1. Визначення поняття
- •5.2. Складання рівнянь гідролізу
- •5.3. Основні випадки гідролізу
- •5.4. Ступінчастий гідроліз
- •5.5. Рівновага гідролізу
- •5.6. Необоротний гідроліз
- •6. Окисно – відновні реакції
- •6.1. Теорія овр
- •6.2. Ступінь окиснення
- •6.3. Класифікація овр
- •6.4. Складання рівнянь овр
- •6.4.1. Метод електронного балансу
- •6.5. Еквіваленти окисників і відновників
- •6.6. Окисно – відновна двоїстстість
- •6.7. Пероксид гідрогену
- •6.8. Напрям протікання овр
- •7. Електрохімія
- •7.1. Електрохімічні процеси
- •7.2. Окисно-відновні потенціали
- •7.3. Вимірювання електродних потенціалів
- •7.4. Гальванічний елемент
- •7.5. Порівняння закономірностей електрохімічних процесів
- •Ю.П.Чухрій, в.Г. Щербакова
- •Посібник до практичних занять Частина 2
- •65082, Одеса, вул. Дворянська, 1⁄ 3
4. Водневий показник
Вода – дуже слабкий амфоліт, тобто одночасно дисоціює як кислота і як основа:
Н2О ⇆ Н+ + ОН - (Кдис = 1,8∙10-16)
кислота основа
За законом діючих мас:

Кв = [Н+][ОН -] = 1 ∙ 10-14 - йонний добуток води
Для води і розбавлених водних розчинів при певній температурі добуток концентрацій йонів гідрогену і гідроксид-йонів є величина стала.
Розчини, у яких концентрації іонів гідрогену та гідроксид-йонів однакові, наз. нейтральними розчинами:
[Н+] = [ОН -] = 10-7 моль/л, отже, Кв = 10-7 ∙ 10-7 = 10-14.
Якщо концентрація катіонів гідрогену відома, то тим самим визначена і концентрація гідроксид-йонів:
[H+]
=
 =
=
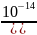 ;
[ОН -]
=
=
.
;
[ОН -]
=
=
.
Математична конверсія концентрацій йонів на від’ємний десятковий логарифм дає більш зручну у користуванні шкалу кислотності із застосуванням нової величини - водневого показника:
рН = - lg[Н+],
а також величину гідроксильного показника pOH = - lg[ОН-]. Показники пов’язані співвідношенням:
рН + рОН = 14.
Використання від’ємного логарифму має наслідком обернений зв’язок між величиною рН і кислотністю розчинів: чим менше величина рН, тим більш кислотним є розчин.
Порівняння:
Кислий розчин → [Н+] 10-7 моль/л → рН < 7
Нейтральний розчин → [Н+] = 10-7 моль/л → рН = 7
Лужний розчин → [Н+] < 10-7 моль/л → рН 7
Зворотний розрахунок проводять потенціюванням:
[Н+] = 10-рН та [ОН -] = 10-рОН
Приклад 4.1. [Н+] = 10-2 моль/л. Визначити [ОН-].
Розв'язок.
[ОН
-] =
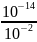 = 10-12
моль/л
= 10-12
моль/л
Приклад 4.2. [ОН -] = 10-3 моль/л. Розрахувати рН.
Розв’язок.
1-й
спосіб. Розраховуємо
концентрацію [Н+]
=
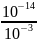 = 10-11
моль/л,
= 10-11
моль/л,
далі розраховуємо рН = - lg 10-11 = 11.
2-й спосіб. Розраховуємо рОН = - lg 10-3 = 3, розраховуємо
рН = 14 – рОН = 14 – 3 = 11.
Приклад 4.3. Розрахуйте концентрацію катіонів Н+ у розчині
з рН = 2,7.
Розв’язок.
[Н+] = 10-2,7 = 0,002 моль/л.
[Н+], моль/л
100 10-1 10-2 10-3 10-4 10-5 10-6 10-7 10-8 10-9 10-10 10-11 10-12 10-13 10-14
│ │ │ │ │ │ │ │ │ │ │ │ │ │ │

 Збільшення кислотності
║ Збільшення
лужності
Збільшення кислотності
║ Збільшення
лужності
│ │ │ │ │ │ │ │ │ │ │ │ │ │ │
рН 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
Надлишок Н+
Надлишок
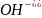
рН < 7 рН 7
Нейтральний
рН = 7
Мал.1. Зв’язок між концентрацією Н+ , рН і реакцією
середовища розчину
Таблиця 4.
Інтервал переходу забарвлення індикаторів
-
Індикатор
Інтервал переходу рН
рТ
Забарвлення
у кислому
середовищі
у лужному
середовищі
Метилоранж
3,1 – 4,4
4
Червоне
Жовте
Лакмус
5,0 – 8,0
7
Червоне
Синє
Фенолфталеїн
8,0 –10,0
9
Безбарвний
Червоне
Для розведених розчинів слабких електролітів зв'язок ступеня дисоціації і константи дисоціації виражається законом розбавляння Оствальда:
К = α2С,
тут:
К – константа дисоціації; α
 1 (100%) – ступінь дисоціаціїї;
1 (100%) – ступінь дисоціаціїї;
С – концентрація електроліту.
Розрахунок концентрації катонів гідрогену для слабких електролітів:
через ступінь дисоціації [Н+] = αС; окремий випадок – сильні електроліти, для яких α = 1: [Н+] = Скислоти;
через константу дисоціації [Н+] = αС =
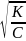 ∙ С =
∙ С =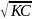
.
Приклад 4.4. Розрахуйте рН 0,17 н. СН3СООН, якщо константа дисоціації 1,75∙10-5.
Розв’язок. Записуємо рівняння дисоціації:
СН3СООН ⇆ СН3СОО- + Н+
Розраховуємо концентрацію йонів гідрогену:
[Н+]
=
=
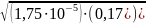 = 0,17∙10-2
моль/л
= 0,17∙10-2
моль/л
Визначаємо рН = - lg 0,17∙10-2 = 2,77.
Приклад 4.5. Розрахуйте рН 0,1 М розчину гідроксиду амонію
(α = 1,3%).
Розв’язок. Записуємо рівняння дисоціації:
NH4OH ⇆ NH4+ + OH -
Розраховуємо концентрацію гідроксид-йонів:
[ОН-]
= αС =
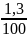 ∙
0,1 = 1,3∙10-3
моль/л,
∙
0,1 = 1,3∙10-3
моль/л,
отже, рОН = - lg 1,3∙10-3 = 2,89. Визначаємо рН =14 – 2,89 = 11,11.
Приклад 4.6. Розрахувати рН 1% розчину форміатної кислоти з густонию розчину 1 г/см3 і Кдис = 2,2∙10-4.
Розв’язок. Записуємо рівняння дисоціації: НСООН ⇆ НСОО- + Н+.
Визначаємо масу кислоти у розчині об’ємом 1 л:
mкислоти
= ωmрозчину
= ωρV =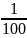 ∙1∙ 1000 = 10 г
∙1∙ 1000 = 10 г
Розраховуємо молярну концентрацію кислоти: Мнсоон = 46 г/моль,
СМ
=
=
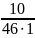 = 0,22 M
= 0,22 M
Розраховуємо концентрацію катіонів гідрогену:
[Н+]
=
=
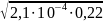 = 6,8∙10-3
моль/л
= 6,8∙10-3
моль/л
Визначаємо рН = - lg 6,8∙10-3 = 2,17.
Для практичного визначення рН розчинів найчастіше користуються індикаторами. Кислотно основні індикатори – складні органічні сполуки (слабкі кислоти аба слабкі основи), що змінюють своє забарвлення від концентрації йонів Н+ або ОН- . Зміна забарвлення індикаторів відбувається у певному інтервалі рН розчину (див. табл. 4.)
Для підтримання сталості рН середовища у розчин вводять буферні сіміші, які вбирають йони водню або гидроксид-йони, тому значення рН розчину залишається практично незмінним.
Буферними розчинами називають суміші слабкої кислоти (або слабкої основи) та її солі. Не змінюється рН і при розведенні, тому що залежить лише від співвідношення концентрацій компонентів буферної суміші. Формули для обчислення рН буферних сумішей:
рН
= рКкислоти +
lg
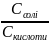 , відповідно, рОН = рКоснови
+ lg
, відповідно, рОН = рКоснови
+ lg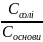 .
.
Буферний розчин характеризується буферною ємкістю – здатністю розчину зберігати сталу величину рН при добавлянні кислот або лугів.
Задачі та вправи
45. Визначити концентрацію: а) катіонів гідрогену у розчині з рН = 3;
б) концентрацію гідроксид йонів з рН = 11.
46. Концентрація гіроксид-йонів у розчині становить 0,00001 моль/л. Визначити коцентрацію йонів Н+ і рН розчину.
47. Концентрація катіонів гідрогену у розчині дорівнює 10-4 моль/л. Визначити рОН розчину.
48. В розчині обємом 500 см3 міститься 0,28 г КОН. Розрахуйте рН розчину. Ступінь дисоціації лугу 100%.
49. Визначити рН 0.001 н. розчину HCN з константою дисоціації 4,9∙10-10.
50. В 1л води розчинили 2,24л аміаку (н.у.). Визначити рН отриманого розчину, якщо α = 0,01.
51. Визначити молярну та еквівалентну концентрацію сульфатної кислоти, якщо відомо, що рН розчину дорівнює 2,2.
