
- •Чухрій ю.П., Щербакова в.Г. Хімія.: Посібник до практичних занять. Частина 2. Одеська державна академія холоду, 2011. - 91 .
- •1. Хімічна рівновага
- •1.1. Оборотність хімічних реакцій
- •1.2. Хімічна рівновага
- •1.3. Константа хімічної рівноваги
- •1.4. Розрахунки концентрацій рівноважних систем
- •1.5. Порушення хімічної рівноваги
- •2. Концентрація розчиненої речовини
- •3. Іонно-молекулярні (іонні) реакції обміну
- •3.1. Визначення поняття йонних реакцій
- •3.2. Напрям протікання йонних реакцій
- •3.3. Складання рівнянь йонних реакцій
- •3.4. Скорочене йонне рівняння
- •4. Водневий показник
- •5. Гідроліз солей
- •5.1. Визначення поняття
- •5.2. Складання рівнянь гідролізу
- •5.3. Основні випадки гідролізу
- •5.4. Ступінчастий гідроліз
- •5.5. Рівновага гідролізу
- •5.6. Необоротний гідроліз
- •6. Окисно – відновні реакції
- •6.1. Теорія овр
- •6.2. Ступінь окиснення
- •6.3. Класифікація овр
- •6.4. Складання рівнянь овр
- •6.4.1. Метод електронного балансу
- •6.5. Еквіваленти окисників і відновників
- •6.6. Окисно – відновна двоїстстість
- •6.7. Пероксид гідрогену
- •6.8. Напрям протікання овр
- •7. Електрохімія
- •7.1. Електрохімічні процеси
- •7.2. Окисно-відновні потенціали
- •7.3. Вимірювання електродних потенціалів
- •7.4. Гальванічний елемент
- •7.5. Порівняння закономірностей електрохімічних процесів
- •Ю.П.Чухрій, в.Г. Щербакова
- •Посібник до практичних занять Частина 2
- •65082, Одеса, вул. Дворянська, 1⁄ 3
6.3. Класифікація овр
Міжмолекулярні реакції, в яких окисник та відновник містяться в різних речовинах (простих чи складних).
Внутрішньомолекулярні реакції, під час яких відбувається зміна ступенів окиснення атомів, що містяться в одній молекулі.
Диспропорціонування (самоокиснення-самовідновлення) – це реакції під час яких частина атомів елемента збільшує ступінь окиснення, а частина – зменшує.
Задачі та вправи
67. Складіть електронні і повні рівняння внутрішньомолекулярних ОВР і зазначте окисник та відновник:
а) (NH4)2Cr2O7 → N2 + Cr2O3 + H2O;
б) KNO3 → KNO2 + O2;
в) Pb(NO3)2 → PbO + NO2 + O2
68. Складіть електронні і повні рівняння міжмолекулярних ОВР
і зазначте окисник та відновник:
а) H2S + O2 → SO2 + H2O
б) S + HNO3 → H2SO4 + NO
в) C + HNO3 → CO2 + NO + H2O
г) NH3 + O2 → NO + H2O
69. Складіть електронні і повні рівняння ОВР диспропорціонування:
а) NO2 + H2O → HNO3 + NO
б) Ca(OH2) + NO2 → Ca(NO3)2 + Ca(NO2)2 + H2O
в) КСlO3 → KClO4 + КСl
г) S + KOH → K2SO3 + K2S + H2O
д) J2 + Ba(OH)2 Ba(JO3)2 + BaJ2 + H2O
6.4. Складання рівнянь овр
6.4.1. Метод електронного балансу
Метод грунтується на порівнянні ступенів окиснення атомів у вихідних речовинах та продуктах реакції.
Загальний хід складання рівнянь:
записати формули речовин, що вступають у реакцію. За правилами
першим записують відновник, а наступним – окисник;
проставити значення ступенів окиснення елементів у молекулах відновника та окисника;
визначити молекулярні форми продуктів взаємодії окисника і відновника і записати їх у правій частині рівняння, після цього записати інші речовини, що утворяться під час реакції;
скласти електронні схеми процесів окиснення та відновлення. В схемах підібрати коефіцієнти так, щоб загальне число електронів віддане відновником, дорівнювало загальному числу електронів, приєднаних окисником.
Коефіцієнти, що встановлюють електронний баланс як основи процесу ОВР, наз. основними коефіцієнтами реакції.
Далі розставити коефіцієнти в молекулярному рівнянні ОВР з дотриманням вимог електронного балансу і рівності числа атомів кожного елемента в лівій та правій частинах рівняння за таким загальним алгоритмом:
в першу чергу поставити основні коефіцієнти до кожної спряженої пари;
далі послідовно рівняють солі, кислоту(луг), воду;
контроль правильності: рівність числа атомів оксигену у обох частинах рівняння, яка встановлюється автоматично за умови, що всі методичні дії виконано правильно.
Методики складання міжмолекулярних ОВР надані в таблицях 8, 9.
Для реакцій диспропорціонування (дисмутації), в яких атоми одного елемента в молекулі реагенту окиснюються та відновлюються, основні коефіцієнти спочатку ставлять у праву частину рівняння, а далі встановлюють коефіцієнт для реагенту в лівій частині рівняння.
Приклад 6.4.1.1. Написати реакцію дисмутації манганату калію.
Розв’язок.
+6 +7 +4
3K2MnO4 + 2H2O = 2KMnO4 + MnO2 + 4KOH
M n+6 - 1 = Mn+7 2 відновник
Mn+6 + 2 = Mn+4 1 окисник
Сумарне рівняння дисмутації:
2Mn+6 + Mn+6 = 2 Mn+7 + Mn+4
Схема дисмутації:
-1 +2
Mn+7 Mn+6 Mn+6 Mn+4
окиснення відновлення
Задачі та вправи
70. Підберіть коефіцієнти методом електронного балансу для реакцій, що відбуваються за схемами:
а) MnO2 + КСlO3 + KOH → K2MnO4 + KCl + H2O
б) H2S + Cl2 + H2O → H2SO4 + HCl
в) K2Cr2O7 + HCl → Cl2 + CrCl3 + KCl + H2O
г) Cl2 + NaOH → NaCl + NaClO + H2O
д) KMnO4 + HCl → MnCl2 + Cl2 + KCl + H2O
е) KNO2 + KMnO4 + HCl → KNO3 + MnCl2 + KCl + H2O
є) KBr + KMnO4 + H2SO4 → Br2 + MnSO4 + K2SO4 + H2O
ж) H2S + H2SO4(конц) → S + H2O
з) FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
и) Na2SO3 + KMnO4+ H2O → Na2SO4 + MnO2 + KOH
і) H2S + K2Cr2O7 + H2SO4 → S + Cr2(SO4)3 + K2SO4+ H2O
Методика складання рівняння окисно-відновної реакції (ОВР) методом електронного балансу за відомими продуктами.
Таблиця 8
Приклад 6.4.1.2. Скласти рівняння ОВР, що відбувається за схемою:
KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O
Операція |
Приклад |
1. Обчислити ступені окиснення атомів у сполуках
|
+7 +4 +2 +6 KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + середовище +K2SO4 + H2O У молекулах кислот, лугів, води, які є елементами середовища, обчислювати ступені окиснення необов’язково. Виняток – це особливі випадки, коли реагент одночасно виконує дві функції: окисника (відновника) і середовища. |
2. Написати електронні схеми: а) відновлення б) окиснення |
При цьому виконують закон збереження зарядів і визначають основні коефіцієнти ОВР
|
3. Об’єднати схему реакції і електронні схеми |
K
коефіціенти - 2 → 5 ОВР
|
4. Складають рівняння реакції:
а) Розставляють основні коєфіціенти
б) Розставляють коефіцієнти для солей
в) Ставлять коефіцієнт для кислоти
г) Ставлять коефіцієнт для води
|
Основні коефіцієнти в ОВР встановлюють електронний баланс, тому їх обов’язково вносять у рівняння першими:
2KMnO4 + 5Na2SO3 + H2SO4 → 2MnSO4 + + 5Na2SO4 + K2SO4 + H2O
Тільки після цього рівняють усі інші продукти, користуючись такою послідовністю: солі, кислота (основа), вода.
Таким чином рівняють кількість катіонів (тут Na+ i K+):
2KMnO4 + 5Na2SO3 + H2SO4 → 2MnSO4 + + 5Na2SO4 + K2SO4 + H2O
Таким чином рівняють кількість аніонів (тут ):
2KMnO4 + 5Na2SO3 + 3H2SO4 → 2MnSO4 + + 5Na2SO4 + K2SO4 + H2O
Таким чином рівняють кількість катіонів гідрогену: 2KMnO4 + 5Na2SO3 + 3H2SO4 → 2MnSO4 + + 5Na2SO4 + K2SO4 + 3H2O
|
5. Контроль правильності |
Рівність підсумкової кількості атомів оксигену у лівій і правій частинах кінцевого рівняння ( тут по 35 атомів оксигену). Примітка. Оксиген у таких ОВР окремо не рівняють. Баланс атомів оксигену встановлюється автоматично, за умови що рівняння складено правильно. |
Складання рівнянь ОВР методом електронного балансу з визначенням
продуктів.
Таблиця 9
Приклад 6.4.1.3. Написати рівняння окисно-відновної реакції
KMnO4 + KNO2 + H2SO4 → ...
1. Обчислити ступені окиснення атомів у сполуках
|
+7 KMnO4 – найвищий ступінь окиснення атома мангану
+3 KNO2 – проміжний ступінь окиснення атома нітрогену |
2. Визначити окисник і відновник |
KMnO4 – окисник KNO2 – відновник
При визначенні окисника і відновника використовують таблиці ОВР-потенціалів і керуються критеріями визначення напрямку протікання реакції з урахуванням впливу середовища розчину |
3. Визначити середовища протікання реакції |
H2SO4 - кисле середовище (надлишок іонів Н+)
У молекулах кислот, лугів, води, які є елементами середовища, обчислювати ступені окиснення необов’язково. Виняток – це особливі випадки, коли реагент одночасно виконує дві функції: окисника (відновника) і середовища.
|
4. Написати схеми: а) відновлення окисника б) окиснення відновника |
KMnO4 → MnSO4
KNO2 → KNO3
Склад продуктів такої взаємодії залежить від кислотності середовища |
5. Обчислити ступені окиснення атомів у молекулах продуктів |
+2 +5 MnSO4 ; KNO3 |
6. Визначити можливі додаткові продукти ОВР |
+7 +3 +2 +5 KMnO4 + KNO2 + H2SO4 → MnSO4 + KNO3+ … середовище
Можливе додаткове утворення K2SO4 i H2O
|
7. Написати електронні схеми процесу: а) відновлення б) окиснення
|
При цьому виконують закон збереження зарядів і визначають основні коефіцієнти ОВР
|
8. Об’єднати схему реакції і електронні схеми |
KMnO4 + KNO2 + H2SO4 → MnSO4 + KNO3+ + K2SO4 + H2O
коефіцієнти 5 ОВР
|
9. Складають рівняння реакції: а) Розставляють основні коєфіціенти
б) Розставляють коефіцієнти для солей
в) Виставляють коефіцієнт для кислоти (основи)
г) Виставляють коефіцієнт для води
|
Основні коефіцієнти в ОВР встановлюють електронний баланс, тому їх обов’язково вносять у рівняння першими:
2KMnO4 + 5KNO2 + H2SO4 → 2MnSO4 + 5KNO3+ + K2SO4 + H2O
Тільки після цього рівняють усі інші продукти, користуючись такою послідовністю: солі, кислота (основа), вода.
Таким чином рівняють кількість катіонів:
2KMnO4 + 5KNO2 + H2SO4 → 2MnSO4 + 5KNO3+ + K2SO4 + H2O
Таким чином рівняють кількість аніонів:
2KMnO4 + 5KNO2 + 3H2SO4 → 2MnSO4 + 5KNO3+ + K2SO4 + H2O
Таким чином рівняють кількість катіонів гідрогену:
2KMnO4 + 5KNO2 + 3H2SO4 → 2MnSO4 + 5KNO3+ + K2SO4 + 3H2O
|
10. Контроль правильності |
Рівність підсумкової кількості атомів оксигену у лівій і правій частинах кінцевого рівняння ( тут по 30 атомів оксигену). Примітка. Оксиген у таких ОВР окремо не рівняють. Баланс атомів оксигену встановлюється автоматично, за умови що рівняння складено правильно |

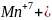 5
→
5
→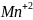 2 (+10
)
2 (+10
)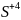
 →
→
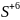 5
(- 10
)
5
(- 10
) MnO4
+ Na2SO3
+ H2SO4
→ MnSO4
+ Na2SO4
+ + K2SO4
+ H2O
MnO4
+ Na2SO3
+ H2SO4
→ MnSO4
+ Na2SO4
+ + K2SO4
+ H2O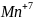 +
5
→
2
основні
+
5
→
2
основні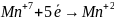 2
(+10
)
2
(+10
)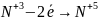 5
(- 10
)
5
(- 10
) 2
основні
2
основні