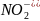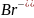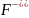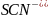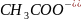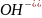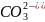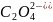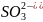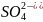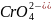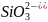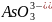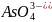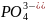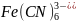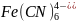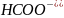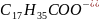- •Чухрій ю.П., Щербакова в.Г. Хімія.: Посібник до практичних занять. Частина 2. Одеська державна академія холоду, 2011. - 91 .
- •1. Хімічна рівновага
- •1.1. Оборотність хімічних реакцій
- •1.2. Хімічна рівновага
- •1.3. Константа хімічної рівноваги
- •1.4. Розрахунки концентрацій рівноважних систем
- •1.5. Порушення хімічної рівноваги
- •2. Концентрація розчиненої речовини
- •3. Іонно-молекулярні (іонні) реакції обміну
- •3.1. Визначення поняття йонних реакцій
- •3.2. Напрям протікання йонних реакцій
- •3.3. Складання рівнянь йонних реакцій
- •3.4. Скорочене йонне рівняння
- •4. Водневий показник
- •5. Гідроліз солей
- •5.1. Визначення поняття
- •5.2. Складання рівнянь гідролізу
- •5.3. Основні випадки гідролізу
- •5.4. Ступінчастий гідроліз
- •5.5. Рівновага гідролізу
- •5.6. Необоротний гідроліз
- •6. Окисно – відновні реакції
- •6.1. Теорія овр
- •6.2. Ступінь окиснення
- •6.3. Класифікація овр
- •6.4. Складання рівнянь овр
- •6.4.1. Метод електронного балансу
- •6.5. Еквіваленти окисників і відновників
- •6.6. Окисно – відновна двоїстстість
- •6.7. Пероксид гідрогену
- •6.8. Напрям протікання овр
- •7. Електрохімія
- •7.1. Електрохімічні процеси
- •7.2. Окисно-відновні потенціали
- •7.3. Вимірювання електродних потенціалів
- •7.4. Гальванічний елемент
- •7.5. Порівняння закономірностей електрохімічних процесів
- •Ю.П.Чухрій, в.Г. Щербакова
- •Посібник до практичних занять Частина 2
- •65082, Одеса, вул. Дворянська, 1⁄ 3
3.4. Скорочене йонне рівняння
Теорія дисоціації розглядає необоротність реакцій у розчинах як наслідок зміщення йонних рівноваг з утворенням слабкодисоційованих сполук: осадів, газуватих речовин, слабких електролітів, що виводяться із зони реакції (у напряму зменшення числа йонів).
Запис у формі скороченого йонного рівняння показує, які йони із складу молекул електроліту сполучаються у молекули нових речовин, тобто, беруть участь у реакції. Такі рівняння показують дію чинників необоротності і напрям довільного зміщення йонної рівноваги.
Приклад 3.4.1. У обмінних реакціях беруть участь різні сполуки аргентуму та хлоридів:
HCl + AgNO3 = AgCl↓+ HNO3
ZnCl2 + 2AgNO3 = 2AgCl↓+ Zn(NO3)2
NaCl + AgF = AgCl↓+ NaF
CuCl2 + Ag2SO4 = 2AgCl↓+ CuSO4
Незважаючи на відмінності молекулярного складу реагентів, у розчині відбувається процес, що описується одним скороченим йонним рівнянням:
Ag+ + Cl - = AgCl↓
Тому:
скорочене йонне рівняння – це більш загальний спосіб опису процесів, що відбуваються у розчині;
з цього випливає, що тільки взаємодія певних йонів спричиняє дію факторів необоротності:
Наприклад: Pb2+ + S2- = PbS↓ - утворення осадів;
H+ + OH- = H2O - утворення слабких електролітів;
2H+ + S2- = H2S↑ - утворення летких речовин.
Саме така взаємодія спричиняє повне чи часткове зміщення йонної рівноваги.
найповніша інформація отримується при одночасному записі молекулярного та скороченого йонного рівняння:
Fe(OH)2 + 2НСl = FeCl2 + 2H2O
Fe(OH)2 + 2H+ = Fe2+ + 2H2O
У цьому прикладі – зміщення йонної рівноваги приводить до розчинення осаду Fe(OH)2 внаслідок утворення дуже слабкого електроліту – Н2О.
у формі йонно-молекулярних рівнянь записують ОВР, які відбуваються у розчинах, що відображено у методі напівреакцій. Однак головна причина зміщення рівноваги ОВР – це перехід електронів, а не солеутворення.
Приклад 3.4.2. Написати йонно-молекулярні рівняння реакцій взаємодії у водних розчинах наступних речовин:
а) HCl i NaOH; б) Pb(NO3)2 i Na2S; в) NaClO i HNO3;
г) K2CO3 i H2SO4; д) CH3COOH i NaOH.
Розв’язок. Записуємо рівняння взаємодії зазначених речовин у молекулярному вигляді:
а) HCl + NaOH = NaCl + H2O
б) Pb(NO3)2 + Na2S = PbS↓ + 2NaNO3
в) NaClO + HNO3 = NaNO3 + HClO
г) K2CO3 + H2SO4 = K2SO4 + CO2↑ + H2O
д) CH3COOH + NaOH = CH3COONa + H2O
Відзначимо, що взаємодія можлива і спричинена зв’язуванням йонів у слабкі електроліти (H2O, HClO), осад (PbS), газ (CO2).
У реакції (д) два слабких електроліти, але реакція завжди відбувається у напрямку сильнішого зв’язування йонів і вода слабкіший електроліт порівняно з оцтовою кислотою, тому рівновага реакції зміщена у сторону утворення води. Виключивши однакові йони з обох частин рівнянь а) Na+ i Cl-; б) Na+ i NO3-; в) Na+ i NO3; г) K+ i SO42-; д) Na+, отримаємо йонно-молекулярні рівняння відповідних реакцій:
а) H+ + OH- = H2O
б) Pb2+ + S2- = PbS↓
в) ClO- + H+ = HClO
г) CO32- + 2H+ = CO2↑ + H2O
д) CH3COOH + OH- = CH3COO- + H2O
Приклад 3.4.3. Складіть молекулярні рівняння реакцій, яким відповідають такі йонно-молекулярні рівняння:
а) SO32- + 2H+ = SO2 + H2O
б) Pb2+ + CrO42- = PbCrO4
в) HCO3- + OH- = CO32- + H2O
г) ZnOH+ + H+ = Zn2+ + H2O
Розв’язок. У лівій частині наведених йонно-молекулярних рівнянь зазначені вільні іони, які утворюються при дисоціації сильних електролітів, отже, при складанні молекулярних рівнянь слід виходити з відповідних розчинних сильних електролітів. Наприклад:
а) Na2SO3 + 2HCl = 2NaCl + SO2 + H2O
б) Pb(NO3)2 + K2CrO4 = PbCrO4 + 2KNO3
в) KHCO3 + KOH = K2CO3 + H2O
г) ZnOHCl + HCl = ZnCl2 + H2O
Задачі та вправи
36. Складіть молекулярні та йонні рівняння реакцій взаємодії
у розчинах між: а) NaHCO3 i NaOH; б)K2SiO3 i HCl; в) BaCl2 i Na2SO4.
37. Якi з речовин: NaCl, NiSO4, Be(OH)2, NaHCO3 будуть взaємодіяти
з розчином NaOH . Напишіть молекулярні і йонні рівняння.
38. Складіть молекулярні та йонні рівняння реакцій взаємодії у розчинах між: а) K2S i HCl; б) FeSO4 i (NH4)2S; в) Cr(OH)3 i KOH.
39. Складіть молекулярнi рівняння реакцій, які виражаються йонно-молекулярними рівняннями:
а) CaCO3 + 2H+ = Ca2+ + H2O + CO2
б) Al(OH)3
+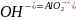 +
2H2O
+
2H2O
в) Pb2+ + 2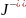 = PbJ2
= PbJ2
40. Складіть молекулярні та йонні рівняння реакцій взаємодії у розчинах між: а) Be(OH)2 i NaOH; б) Cu(OH)2 i HNO3 в) ZnOHNO3 i HNO3.
41. Надлишком гідроксиду калію подіяли на розчини:
а) дигідрогенфосфату калію; б) дигідроксонітрату вісмуту (ІІІ). Напишіть молекулярні та йонні рівняння реакцій цих речовин з КОН.
42. Скласти молекулярні та йонні рівняння реакцій між:
а) хлоридом барію та сульфатом алюмінію; б) хлоридом амонію та гідроксидом калію при нагріванні; в) гідроксидом стронцію та хлоридною кислотою; г) фосфатною кислотою та нітратом кальцію; д) ацетатом калію та сульфатною кислотою.
Реакції з участю слабких електролітів, летких або слабкорозчинних твердих речовин протікають тільки за умови утворення ще менш дисоційованих, менш розчинних і більш летких речовин.
При наявності двох слабких розчинних електролітів порівнюють їх константи дисоціації.
Приклад 3.4.4. Визначити можливість протікання і скласти йонні рівняння реакції: KCN + CH3COOH ⇆ HCN + CH3COOK.
Розв’язок. Для визначення напряму протікання зазначеної реакції порівнюємо Кдис двох слабких електролітів: ацетатної та ціанідної кислот:
KCN + CH3COOH ⇆ HCN + CH3COOK
Кдис
1,74∙10-5
 5∙10-10
5∙10-10
HCN – характеризується меншим числом константи дисоціації, є більш слабкою, отже, реакція протікає у прямому напрямі. Складаємо йонні рівняння реакції:
K+ + CN- + CH3COOH ⇆ HCN + CH3COO- + K+,
виключаємо (викреслюємо) однакові йони у правій і лівій частинах рівняння, записуємо скорочене йонне рівняння:
CN- + CH3COOH ⇆ HCN + CH3COO-.
При наявності двох слабкорозчинних твердих речовин порівнюють їх добутки розчинності.
Приклад 3.4.5. Визначити напрям протікання реакції:
AgJ + Cl- ⇆ AgCl + J-.
Розв’язок. Для відповіді необхідно використати довідкову таблицю з числами добутків розчинності:
AgJ + Cl- ⇆ AgCl + J-
ДР 8,3∙10-17 < 1,78∙10-10
AgJ характеризується меншим числом добутку розчинності, є менш розчинним, отже, реакція протікає у зворотному напрямі.
Таблиця 3. Розчинність кислот, основ, солей у воді
р – розчинне, с – слабкорозчинне, н – нерозчинне, г – сильно гідролізується, «-» - не існує або розкладається водою, в/д – відсутні дані.
Катіони |
Аніони |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Na+ |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
K+ |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
Li+ |
р |
р |
р |
р |
р |
с |
в/д |
в/д |
р |
р |
р |
р |
NH4+ |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
Mg2+ |
р |
р |
р |
р |
р |
н |
р |
р |
с |
р |
н |
н |
Ca2+ |
р |
р |
р |
р |
р |
н |
р |
р |
с |
р |
с |
н |
Sr2+ |
р |
р |
р |
р |
р |
н |
р |
р |
р |
р |
с |
н |
Ba2+ |
р |
р |
р |
р |
р |
н |
с |
р |
р |
р |
р |
н |
Al3+ |
г |
р |
р |
р |
р |
с |
г |
р |
г |
г |
н |
г |
Cr3+ |
г |
р |
р |
р |
р |
р |
г |
р |
г |
г |
н |
г |
Zn2+ |
р |
р |
р |
р |
р |
р |
н |
р |
н |
р |
н |
н |
Mn2+ |
р |
р |
р |
р |
р |
р |
н |
р |
н |
р |
н |
н |
Ni2+ |
р |
р |
р |
р |
р |
р |
н |
р |
н |
р |
н |
н |
Co2+ |
р |
р |
р |
р |
р |
р |
н |
р |
н |
р |
н |
н |
Fe2+ |
р |
р |
р |
р |
р |
р |
н |
р |
н |
р |
н |
г |
Fe3+ |
г |
р |
р |
р |
- |
р |
н |
р |
н |
г |
н |
н |
Ag+ |
с |
р |
н |
н |
н |
р |
н |
н |
н |
с |
н |
н |
Pb2+ |
р |
р |
н |
н |
н |
н |
н |
с |
н |
р |
н |
н |
Hg22+ |
р |
р |
с |
с |
н |
р |
р |
р |
н |
р |
н |
н |
Hg2+ |
р |
р |
с |
с |
н |
р |
р |
р |
н |
р |
н |
н |
Cu2+ |
р |
р |
р |
р |
- |
н |
н |
н |
н |
р |
н |
н |
Bi3+ |
г |
р |
г |
г |
н |
- |
- |
- |
н |
г |
н |
г |
Cd2+ |
р |
р |
р |
р |
р |
р |
н |
р |
н |
р |
н |
н |
Sn2+ |
г |
р |
р |
р |
р |
н |
- |
- |
н |
р |
н |
н |
H+ |
р |
р |
р |
р |
р |
р |
р |
- |
р |
р |
- |
р |
Катіони |
Аніони |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Na+ |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
K+ |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
Li+ |
в/д |
р |
р |
р |
н |
в/д |
в/д |
н |
в/д |
в/д |
в/д |
в/д |
NH4+ |
р |
р |
р |
р |
- |
р |
р |
р |
р |
р |
р |
р |
Mg2+ |
р |
н |
р |
р |
н |
р |
н |
н |
м |
р |
р |
н |
Ca2+ |
н |
н |
с |
м |
н |
н |
н |
н |
н |
н |
р |
н |
Sr2+ |
н |
н |
н |
н |
н |
н |
н |
н |
р |
р |
в/д |
в/д |
Ba2+ |
н |
н |
н |
н |
н |
н |
н |
н |
р |
н |
р |
н |
Al3+ |
н |
- |
р |
р |
н |
г |
н |
н |
- |
- |
р |
н |
Cr3+ |
м |
- |
р |
н |
н |
г |
н |
н |
- |
- |
р |
н |
Zn2+ |
н |
н |
р |
р |
н |
н |
н |
н |
н |
н |
р |
н |
Mn2+ |
м |
н |
р |
р |
н |
н |
н |
н |
н |
н |
р |
н |
Ni2+ |
н |
н |
н |
н |
н |
н |
н |
н |
н |
н |
в/д |
в/д |
Co2+ |
н |
н |
р |
н |
н |
н |
н |
н |
н |
н |
в/д |
в/д |
Fe2+ |
н |
н |
р |
- |
н |
н |
н |
н |
н |
н |
р |
н |
Fe3+ |
н |
- |
р |
р |
н |
н |
н |
н |
р |
н |
р |
н |
Ag+ |
н |
н |
с |
н |
н |
н |
н |
н |
н |
н |
р |
н |
Pb2+ |
н |
н |
н |
н |
н |
н |
н |
н |
с |
н |
р |
н |
Hg22+ |
н |
- |
с |
н |
н |
н |
н |
н |
- |
- |
с |
н |
Hg2+ |
н |
- |
р |
н |
н |
н |
н |
н |
н |
- |
р |
н |
Cu2+ |
н |
- |
р |
р |
н |
н |
н |
н |
- |
н |
р |
н |
Bi3+ |
н |
- |
г |
н |
г |
н |
н |
н |
н |
н |
р |
н |
Cd2+ |
н |
н |
р |
н |
н |
н |
н |
н |
н |
н |
в/д |
в/д |
Sn2+ |
н |
- |
р |
н |
н |
н |
н |
н |
н |
н |
р |
н |
H+ |
р |
р |
р |
р |
н |
р |
р |
р |
н |
н |
р |
н |
В іонних рівняннях реакцій у молекулярній формі записують такі розчинні слабкі електроліти: а) аміни; б) неорганічні кислоти – H2CO3, H2SO3, H2S, HNO2, HCN, HF; в) органічні кислоти – СН3СООН,
НСООН, феноли; г) гідроксиди і органічні основи – NH4OH; д) Н2О2.
Задачі та вправи
43. Визначити можливість безпосереднього перетворення осаду BaSO4 на осад ВаСО3. Написати молекулярні та йонні рівняння таких реакцій.
44. Визначити можлівість і напрям протікання наведених реакцій
(використайте таблицю величин ДР):
а) AgCl + KJ = AgJ + КСl
б) PbS + Na2SO4 = PbSO4 + Na2S
в) BaCO3 + K2CO3 = BaSO4 + K2CO3
г) 2AgBr + K2SO4 = Ag2SO4 + 2KBr.
Складіть скорочені йонні рівняння реакцій, що відбуваються.